Острые кишечные инфекции (ОКИ) являются актуальной проблемой здравоохранения из-за высокой заболеваемости и значительных экономических потерь; так, в 2014 г. в России ОКИ по экономическому ущербу уступают только острым респираторным инфекциям и туберкулезу (Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2014 году»). До настоящего времени в нашей стране отсутствуют согласованные подходы к терапии инфекционных диарей у детей [1, 2].
Несмотря на достигнутые в последние годы успехи в диагностике и терапии инфекционных диарей в России, частота назначения антимикробных препаратов (АМП) остается на высоком уровне, особенно для госпитализированных пациентов [6], поэтому представляется актуальным освещение вопросов лечения бактериальных диарей на современном этапе.
Теоретически, назначая АМП для лечения бактериальных ОКИ, врач ожидает уменьшения выраженности клинических симптомов, сокращения продолжительности заболевания, снижения частоты развития осложнений, прекращения выделения возбудителя, предупреждения дальнейшего распространения инфекции [7]. К сожалению, не всегда эти ожидания сбываются даже при диареях, протекающих по инвазивному типу.
Доказано, что использование антибиотиков далеко не всегда эффективно и безопасно при бактериальной диарее. При энтерогеморрагических эшерихиозах применение бактерицидных АМП приводит к разрушению микробных клеток и массивному высвобождению шигаподобного токсина, что увеличивает риск развития гемолитико-уремического синдрома (ГУС), причем включение в терапию фторхинолонов и триметоприм/сульфометаксозола сопровождается высоким риском развития ГУС, а наиболее безопасными и эффективными оказались карбапенемы, макролиды и рифаксимин [8].
В Санкт-Петербурге за последние годы отмечен неуклонный рост числа случаев ГУСа, ассоциированного с диареей: в начале 2000-х гг. в нашей клинике регистрировалось за год не более одного случая ГУСа, а в 2013–2016 гг. – 9–12 случаев ГУСа, ассоциированных с энтерогеморрагическими эшерихиями, ежегодно.
Применение антимикробной терапии (АМТ) при бактериальных диареях в значительном проценте случаев не только не приводит к санации макроорганизма от возбудителя, а наоборот, способствует продолжительной персистенции бактериального агента в желудочно-кишечном тракте (ЖКТ) вследствие не только подавляющего влияния на аутохтонную микробиоту кишечника, но и прямого иммуносупрессивного действия [9, 10]. По данным отечественных и зарубежных исследователей, затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, получавших АМТ в острую фазу инфекции, по сравнению в лицами, получавшими исключительно патогенетическую терапию [11, 12]. По нашим данным, бактериовыделение сальмонелл в период реконвалесценции отмечено в среднем у 37% детей, лечившихся системными АМП. Влияние АМП на иммунный ответ было доказано нами при шигеллезе, причем комбинированная антибактериальная терапия приводила к выраженной супрессии как гуморального иммунного ответа, так и показателей фагоцитоза [13].
Самым серьезным недостатком широкого использования АМП при лечении бактериальных диарей является быстрое развитие представителями семейства Enterobacteriaceae резистентности к АМП [14]. Так, отечественными авторами зафиксирован неуклонный рост числа штаммов Salmonella enteritidis, устойчивых к большинству стартовых АМП. Например, к налидиксовой кислоте в настоящее время резистентно до 60% циркулирующих штаммов сальмонелл [11]. Все чаще выявляются штаммы кампилобактерий, обладающих широкой антибиотикорезистентностью, в т.ч. к макролидам и фторхинолонам [11, 15]. Параллельно с ростом антибиотикорезистентности отмечено снижение клинической эффективности стартовой АМТ при назначении налидиксовой кислоты, она уменьшилась к 2009 г. по сравнению с 2000–2005 гг. с 61 до 48,3%, а при использовании амикацина – с 53,9 до 31,7% [11, 12].
Кроме того, применение АМП нередко обусловливает развитие аллергических реакций вплоть до анафилактического шока; кроме того, применение антибиотиков может приводить к развитию не только идиопатической антибиотикоассоциированой диареи, но и тяжелых антибиотикоассоциированных колитов, обусловленных токсинообразующими штаммами Clostridium difficile [7, 16].
Проведенные в России немногочисленные фармакоэпидемиологические исследования показали, что у детей, перенесших ОКИ, в большинстве случаев в стационаре используется АМТ (72–100% госпитализированных), причем как минимум у трети больных отсутствуют какие-либо показания к ее назначению, при этом во многих стационарах по-прежнему используются малоэффективные или токсичные препараты (фуразолидон, хлорамфеникол, естественные пенициллины, рифампицин) [6, 18, 19].
В практическом здравоохранении не только отмечаются ошибки в выборе АМП для лечения бактериальных диарей, но и часто встречаются как недостаточные, так и избыточные дозы назначаемых препаратов, неадекватный способ введения, неправильный выбор интервалов между введениями, необоснованное сочетание двух и более АМП [10]. Если доза антибиотика недостаточна и не создает в крови и тканях концентрации, превышающие минимально подавляющие концентрации основных возбудителей инфекции, то это не только становится одной из причин неэффективности лечения, но и создает предпосылки к формированию антибиотикорезистентности микроорганизмов. В современной ситуации при наличии высокоэффективных АМП широкого спектра действий для лечения ОКИ показания к комбинированной АМТ практически отсутствуют и приоритет в лечении остается за монотерапией [15, 16, 20].
Кроме этого до настоящего времени при бактериальных диареях проводится необоснованно длительная АМТ со сменой 3–4 лекарственных средств, широко назначаются повторные курсы АМП при реконвалесцентном бактериовыделении возбудителей ОКИ, реже имеет место неоправданно короткая АМТ [6].
Поэтому в настоящее время показания к использованию антибиотиков в лечении ОКИ строго ограничены и определяются типом диареи и этиологией заболевания, формой тяжести инфекционного заболевания, возрастом и состоянием преморбидного фона пациента [5, 16, 20]. Все вышеперечисленное определяет актуальность поиска новых подходов к лечению бактериальных диарей.
Материал и методы
В открытое сравнительное контролируемое исследование были включены 50 пациентов в возрасте от 6 до 18 лет со среднетяжелой формой ОКИ бактериальной этиологии. Дети были госпитализированы с 1-го по 4-й день болезни, большинство – 35 (70%) – в первые двое суток. Причиной необходимости в стационарном лечении для поступивших на 1–2-е сутки служили фебрильная температура у 39 (78%), многократная рвота у 16 (32%) и появление крови в стуле у 9 (18%) пациентов. Госпитализированные в более поздние сроки дети имели основную жалобу на продолжительную диарею, сохранение лихорадки 76% (38) и гемоколита 10% (5). Средний возраст пациентов, включенных в исследование, составил 9,6±0,7 года. Различий по полу выявлено не было: мальчики и девочки составили 26 (52%) и 24 (48%) соответственно.
Первая группа (основная, n=25) получала комбинированный препарат, соединяющий свойства энтеросорбента и активных метаболитов Bacillus subtilis (B. subtilis) [далее, сорбированный пробиотик) по 1 капсуле 2 раза в сутки в течение 7 дней в острый период заболевания на фоне базисной терапии [22–25]. Базисная терапия включала пероральную регидратацию или инфузионную терапию, диетотерапию, по показаниям назначали антимикробные препараты.
Эффективность использования данного препарата была оценена в сравнении с эффективностью пребиотика, нормалирующего физиологическую флору тонкого и толстого кишечника.Пациенты группы сравнения (n=25) получали его на фоне базисной терапии препарат в возрастной дозе в течение 7 дней, при этом энтеросорбенты не назначались.
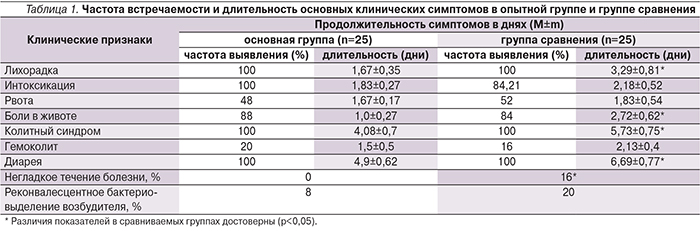
Этиология диареи была установлена для 36 (72%) обследованных пациентов (табл. 1), среди расшифрованных диарей преобладали сальмонеллез (32%) и кампилобактериоз (18%), сравниваемые группы были сопоставимыми по этиологической структуре больных.
У всех пациентов независимо от этиологии заболевание протекало по типу инвазивной диареи, что позволило нам анализировать клиническую картину заболевания, не разделяя больных в зависимости от выделенного бактериального агента.
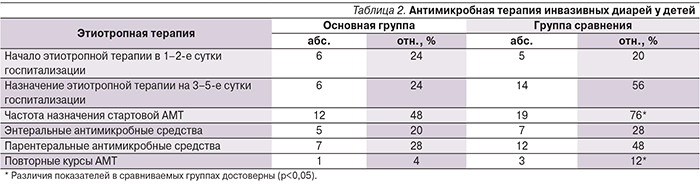
АМТ назначали в соответствии с принципами этиотропной терапии инвазивных ОКИ у детей. Стартовыми АМП являлись цефотаксим, нифуроксазид, препаратами резерва – цефтриаксон, амикацин, рифаксимин. По срокам назначения АМТ дети были разделены на две группы: получавшие терапию с 1–2-го дня пребывания в стационаре и получавшие этиотропную терапию с 3–5-го дня госпитализации (табл. 1).
Нами оценена частота встречаемости основных клинических симптомов и синдромов при бактериальных диареях в сравниваемых группах пациентов. Общеинфекционные симптомы и симптомы диспепсии регистрировались с одинаковой частотой в сравниваемых группах больных.
Результаты исследования и обсуждение
Доказано, что включение в комплексную терапию бактериальных ОКИ сорбированного пробиотика способствовало сокращению продолжительности основных клинических проявлений заболевания (табл. 1).
Так, в основной группе отмечено достоверное уменьшение длительности лихорадочного периода, раньше купировались боли в животе и диарейный синдром, включая синдром колита, по сравнению с пациентами группы сравнения.
Нашей основной целью в лечении бактериальных кишечных инфекций является сокращение частоты назначения АМТ. С этой точки зрения наиболее значимым эффектом применения данного препарата при бактериальных диареях было снижение частоты назначения АМТ в основной группе, – до 48 против 76% в группе сравнения (р<0,05). Причем, как следует из табл. 2, стартовая АМТ в 1–2-й день госпитализации назначалась практически с одинаковой частотой в сравниваемых группах: 24 и 20% соответственно. На фоне проведенной терапии у значительного числа пациентов сохранялись симптомы интоксикации, диарея и симптомы колита, таким образом, отсутствие положительной динамики заболевания привели к назначения АМТ на 3–5-й день диарейного заболевания. В основной группе таких пациентов оказалось 24%, в группе сравнения – 56% (табл. 2), при этом большинству пациентов основной группы были назначены пероральные формы антимикробных средств, в группе сравнения преобладало использование парентеральных антимикробных средств.
На основании полученных данных можно предположить, что эффект применения данного препарата связан с наличием антибиотикоподобных субстанций, продуцируемых B. subtilis.
Формирование реконвалесцентного бактериовыделения возбудителя инфекции было отмечено у 7 пациентов (14%): сальмонеллы выделялись – у 5 детей (10%), шигеллы – у 1 ребенка (2%) и кампилобактерии – у 1 (2%).
Его использование в составе комплексной терапии бактериальных диарей приводило к снижению частоты негладкого течения болезни (суперинфекция вирусными агентами и обострения) и способствовало более редкому формированию реконвалесцентного бактериовыделения (табл. 2). В основной группе пациентов реконвалесцентное бактериовыделение формировалось в 8% случаев против 20% в группе сравнения (р>0,05). Обострений болезни также не наблюдалось в основной группе, в то время как в группе сравнения обострения были зарегистрированы у 16% детей (р<0,05).
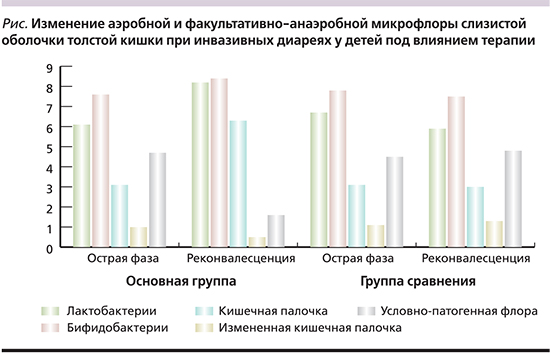
Установлено, что к периоду ранней реконвалесценции бактериальных диарей использование сорбированного пробиотика в комплексной терапии оказывало положительное влияние на просветную микробиоту толстой кишки; в частности, регистрировалось увеличение доли облигатной и факультативной микрофлоры и отмечалось значительное снижение числа выделенных условно-патогенных микроорганизмов.
Так, в основной группе к периоду ранней реконвалесценции наблюдалась полная нормализация показателей анаэробного звена микробиоценоза слизистой оболочки толстой кишки (см. рисунок). Уровни бифидо- и лактобактерий в 1 г испражнений, выраженные в логарифмах, достоверно увеличивались на 1–2 порядка. Наряду с этим в просвете толстой кишки наблюдалось достоверное увеличение (р<0,05) представителей индигенной аэробной микрофлоры с полной элиминацией возбудителя и условно-патогенных бактерий (Klebsiella spp., Proteus spp., St .aureus и грибов рода Candida) Данные изменения можно было охарактеризовать как дисбактериоз I ст. В то же время у большинства (73,68%) больных группы сравнения продолжал регистрироваться дисбактериоз II–III ст. за счет сохраняющегося выделения условно-патогенных микроорганизмов (42%) и St. aureus (18%), выраженного угнетения анаэробной микрофлоры.
Данный сорбированный пробиотик имеет высокий профиль безопасности, что подтверждается параклиническими данными: изменений со стороны клинического и биохимического анализов (уровни амилазы, креатинина, аланинаминотрансферазы) крови, а также со стороны выделительной функции почек, которые свидетельствовали бы о токсическом действии препарата, отмечено не было. Он хорошо переносился детьми независимо от возраста, комплаентность терапии была более 90%, препарат не приводил к развитию аллергических реакций, требующих его отмены. Следовательно, он является высокоэффективным энтеросорбентом с пробиотическим эффектом (сорбированным пробиотиком) и его использование показано пациентам в возрасте старше 6 лет, переносящим бактериальные диареи, как в сочетании с антимикробной терапией, так и виде монотерапии.
Таким образом, рациональная терапия бактериальных диарей приводит к сокращению сроков заболевания, предотвращает затяжное течение болезни, способствует быстрой санации организма от возбудителя, купирует патологические изменения в микробиоценозе толстой кишки, снижает частоту развития осложнений, связанных с антимикробной терапией.



