Гиперэкспрессия HER2 при раке молочной железы (РМЖ) встречается в 20–25 % случаев, ассоциируется с неблагоприятным прогнозом и меньшей эффективностью стандартных вариантов противоопухолевой терапии. Внедрение трастузумаба (моноклонального антитела к внеклеточному домену рецептора HER2) в клиническую практику позволило впервые за многие годы значительно увеличить общую выживаемость больных метастатическим РМЖ с гиперэкспрессией HER2. Основываясь на данных ранних исследований, комбинация трастузумаба с таксанами или винорельбином позволила улучшить выживаемость с 20–22 до 30,5–38,0 месяцев, а с платиновыми производными – до 42.
Применение трастузумаба в адъювантном режиме больными ранними формами HER2-позитивного РМЖ позволило практически вдвое снизить относительный риск рецидива болезни. Таким образом, с появлением трастузумаба больные, опухоли которых имеют гиперэкспрессию HER2 (одна из самых неблагоприятный биологических характеристик), в настоящее время отличаются наилучшим прогнозом и выживаемостью, сопоставимой с таковой при HER2-негативных опухолях.
Стратегия блокады HER2 оказалась настолько успешной, что в настоящее время именно это направление наиболее активно исследуется при РМЖ. К сожалению, не все больные отвечают на терапию трастузумабом, а на определенном этапе у многих отмечается дальнейшее прогрессирование болезни. Это и определяет необходимость поиска дополнительных возможностей блокады HER2. На сегодняшний день в арсенале врачей присутствует еще один анти-HER2-препарат – лапатиниб, а к регистрации в России готовятся пертузумаб и T-DM1.
Идея двойной блокады HER2-рецептора (экстрацеллюлярного домена и тирозинкиназного домена) нашла свое отражение в весьма впечатляющих результатах комбинации трастузумаба и лапатиниба.

Сочетанное применение двух анти-HER-препаратов повышает эффективность таргетной терапии. Так, сравнение эффективности комбинации трастузумаб + лапатиниб с монотерапией лапатинибом проведено в исследовании III фазы EGF104900 на 296 значительно предлеченных больных HER2-положительным РМЖ. Следует отметить, что 73 % из них страдали висцеральными метастазами, у 51 % не определялись стероидные рецепторы. До включения в исследование более чем трети больных было проведено по 6 линий химиотерапии, из которых в среднем в трех линиях назначался трастузумаб.
В результате контроля болезни (полный + частичный регресс + стабилизация болезни ≥ 6 месяцев) удалось добиться у 24,7 % больных в группе терапии трастузумаб + лапатиниб по сравнению с 12,4 % в группе монотерапии лапатинибом (р = 0,01). Выживае-мость без прогрессирования (первичная цель исследования) была статистически значимо лучше у больных группы комбинированного лечения: 12,0 и 8,1 недели соответственно (р = 0,008).
Результаты анализа общей выживаемости оказались впечатляющими. Медиана общей выживаемости в группе комбинированной терапии составила 14 месяцев по сравнению с 9,5 – у больных, получавших монотерапию лапатинибом. Также следует отметить, что использование комбинации двух анти-HER-препаратов не привело к увеличению частоты развития серьезной кардиальной токсичности [1].

Еще одним воздействием на экстрацеллюлярный домен HER-рецепторов стало предотвращение их димеризации. Такой направленностью действия обладает перспективный препарат анти-HER2-терапии пертузумаб – моноклональные антитела, препятствующие образованию HER2-содержащих димеров. В ряде предварительных исследований II фазы было показано, что пертузумаб может быть эффективным после неудачи терапии трастузумабом [2, 3], однако наилучшие результаты были получены при сочетанном применении двух моноклональных антител. В группе из 66 больных, леченных трастузумабом и пертузумабом, частота достижения контроля болезни составила 50 %, медиана времени до прогрессирования – 5,5 месяца. Лечение хорошо переносилось, не отмечено случаев его прекращения из-за кардиальной токсичности [4].
Полученные результаты легли в основу дальнейших рандомизированных исследований (CLEOPATRA [5]; MARIANNE [6]) по изучению эффективности комбинации пертузумаба и трастузумаба уже в первой линии терапии.
Успешным было исследование CLEOPATRA, в которое были включены 808 больных, получавших трастузумаб + доцетаксел и пертузумаб/плацебо в первой линии лечения HER2-положительного РМЖ. При проведении первого промежуточного анализа было показано значительное увеличение медианы времени без прогрессирования, составившее 12,4 месяца в контрольной группе против 18,5 месяца в группе больных, получавших пертузумаб. В группе больных, получавших неоадъювантное лечение трастузумабом, медиана времени до прогрессирования составила 10,4 против 16,9 месяца, в то время как больные, не получавшие ранее трастузумаб, имели значительно большее время до прогрессирования: 12,6 против 21,6 месяца. Объективный эффект в общей группе составил 69,3 против 80,2 % соответственно.
Анализ общей выживаемости [7] (при медиане наблюдения 30,1 месяца в группе плацебо и 29,7 месяца в группе терапии с включением пертузумаба) показал, что относительный риск смерти от прогрессирования метастазов РМЖ был на 34 % меньше в группе больных, получавших пертузумаб.
Число летальных исходов в группе плацебо было выше по сравнению c группой терапии с включением пертузумаба – 38 (154/406) против 28 % (113/402) (отношение рисков [ОР] – 0,66; p = 0,0008). Общая выживаемость в контрольной группе оставила 37,6 месяца, в то время как в группе больных, получавших пертузумаб, медиана не была достигнута. При этом следует отметить, что лечение во второй, третьей и последующих линиях (после окончания терапии в рамках исследования) было сопоставимым в обеих группах.
Ожидаемая 1-, 2- и 3-летняя общая выживаемость представлена в табл. 1.
На основании проведенного исследования комбинация трастузумаб + пертузумаб + доцетаксел рекомендована FDA (Food and Drug Administration) в качестве варианта первой линии лечения метастатического РМЖ с гиперэкспрессией HER2.
Ожидаются результаты еще нескольких исследований эффективности комбинации пертузумаб и трастузумаб в первой линии лечения HER2+-метастатического РМЖ: MARIANNE, предусматривающего использование трастузумаб-DM1 (T-DM1) с или без пертузумаба по сравнению с комбинацией трастузумаба и таксанов в первой линии терапии метастатического или местнораспространенного РМЖ с гиперэкспрессией HER2, и PERTAIN – по оценке эффективности и безопасности применения пертузумаба, трастузумаба и ингибиторов ароматазы [8].
Продолжается также рандомизированное исследование PHEREXA, в котором изучается эффективность и безопасность применения пертузумаба, трастузумаба и капецитабина по сравнению с трастузумабом и капецитабином во второй линии лечения больных HER2+-метастатическим РМЖ.
Неоадъювантная терапия
Трастузумаб в настоящее время является неотъемлемой частью неоадъювантной терапии РМЖ с гиперэкспрессией HER2. Трастузумаб в комбинации с химиотерапией позволяет значительно увеличить частоту полных морфологических ремиссий (pCR) по сравнению только c химиотерапией. Более того, проведенные исследования неоадъювантной терапии РМЖ с гиперэкспрессией HER2 показывают четкую корреляцию между достижением pCR и увеличением безрецидивной выживаемости.
Так, в исследовании NOAH [9] подтверждено: добавление трастузумаба к химиотерапии при местнораспространенном РМЖ (T4Nлюбое либо TлюбоеN2–3) с гиперэкспрессией HER2 позволяет значительно увеличить не только общую эффективность (87 против 74 %; p = 0,009), но и частоту достижения полной морфологической ремиссии (38 против 19 %; р = 0,001). В контрольной группе больных HER2-негативным РМЖ общая эффективность составила 66 % и частота полной морфологической ремиссии – всего 17 %. Первый промежуточный анализ [10] (при медиане наблюдения 3,2 года) показал, что введение в неоадъювантный режим трастузумаба позволило значительно увеличить безрецидивную выживаемость при HER2+-местнораспространенном, в т.ч. воспалительном, РМЖ (ОР – 0,59, 95 % доверительный интервал [ДИ] – 0,38–0,90; p = 0,013). Примечательно следующее: достоверные различия в выживаемости без прогрессирования сохранились и при более позднем анализе: так, 5-летняя безрецидивная выживаемость больных, получивших трастузумаб, составила 58 %, в то время как среди больных группы без трастузумаба – только 43 % (ОР – 0,64, 95 % ДИ – 0,44–0,93; р = 0,016) [11]. Среди больных, достигших полной морфологической ремиссии, выживаемость без прогрессирования была достоверно лучше в группе терапии трастузумабом (ОР – 0,29, 95 % ДИ – 0,11–0,78). За весь период наблюдения за больными, получавшими трастузумаб, было отмечено лишь 4 случая осложнений со стороны сердечно-сосудистой системы.
Основываясь на данных применения двух анти-HER2-препаратов при метастатическом РМЖ, стратегия двойной блокады HER2 была применена и в неоадъювантном режиме. В ряде исследований было подтверждено, что использование двух анти-HER2-препаратов (лапатиниб + трастузумаб или пертузумаб + трастузумаб) в комбинации с таксанами позволяет достигать статистически достоверно большей по сравнению с использованием одного из таргетных препаратов частоты полной морфологической ремиссии.
В рандомизированное исследование II фазы NeoSphere [12] включены 417 больных операбельным, местнораспространенным и инфильтративно-отечным РМЖ с гиперэкспрессией HER2 (HER2-статус подтвержден в центральной лаборатории). Все больные были рандомизированы в 4 группы: группа А – трастузумаб + доцетасел, группа B – трастузумаб + пертузумаб + доцетаксел, группа С – трастузумаб + пертузумаб, группа D – пертузумаб + доцетаксел. Трастузумаб назначали в стандартном 3-недельном режиме, нагрузочная доза пертузумаба составила 840 мг, далее – по 420 мг каждые 3 недели, доцетаксел 75 мг/м2 с возможностью последующей эскалации дозы до 100 мг/м2 каждые 3 недели. В адъювантной терапии предусматривалось назначение всем больным 3 курсов FEC (эпирубицин 90 мг/м2 + циклосфан 500 + фторурацил 500 мг/м2), за исключением группы С, которая в адъювантной терапии получала 4 курса доцетаксела + 3 курса FEC. В дальнейшем все больные получали трастузумаб до года. Первичной целью исследования была оценка полного морфологического эффекта в первичной опухоли, который оценивался как отсутствие инвазивного компонента опухоли, при этом допускалось наличие очагов рака in situ. Результаты исследования представлены в табл. 2.
Как и ожидалось, наибольшей частоты полного морфологического регресса опухоли (рСR) удалось добиться в группе В (трастузумаб + пертузумаб + доцетаксел) – 45,8 % по сравнению с группой А (доцетаксел + трастузумаб), которая составила 29 %. Частота рCR в группе D (доцетаксел + пертузумаб) составила 24 % по сравнению с группой С (трастузумаб + пертузумаб, без химиотерапии) – 16,8 %. Следует отметить, что частота полного морфологического регресса опухоли была значительно выше во всех группах с рецепторотрицательными опухолями.
Применение двойной HER2-блокады не сопровождалось усилением кардиологической токсичности. Развитие тяжелой сердечной недостаточности отмечено лишь у одного больной группы С (пертузумаб + трастузумаб) с отягощенным кардиологическим анамнезом.
Говоря о результатах данного исследования, нельзя не обратить внимания на длительность неоадъювантной терапии, которая составила всего 12 недель. Возможно, этим обусловлена такая умеренная эффективность комбинации доцетаксел + трастузумаб, хотя в более ранних исследованиях при использовании последовательной химиотерапии эффективность данного режима была гораздо выше. В то же время при использовании двойной блокады HER2 (трастузумаб + пертузумаб) в комбинации с доцетакселом, несмотря на столь короткий период неоадъювантной терапии, удалось добиться высокой частоты полного морфологического регресса опухоли.
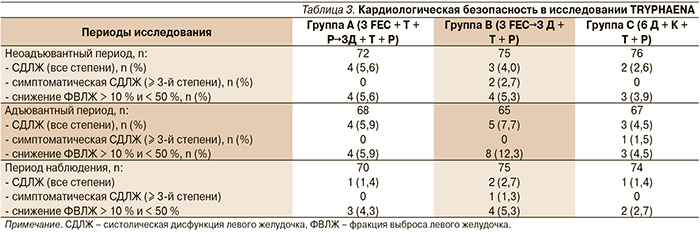
Безопасность и эффективность применения трастузумаба и пертузумаба в неоадъювантной терапии HER2+-РМЖ уже в комбинации с антрациклинами или карбоплатинсодержащей химиотерапией были изучены в рандомизированном исследовании II фазы TRYPHAENA [13]. В исследование были включены 225 больных операбельным, местнораспространенным и отечно-инфильтративным РМЖ HER2+, которые получали лечение в одной из трех групп: группа А – 3 курса FEC + трастузумаб + пертузумаб, далее доцетаксел 3 курса + трастузумаб + пертузумаб; группа В – 3 курса FEC с последующим назначением 3-го курса доцетаксела в комбинации с пертузумабом и трастузумабом; группа С – 6 курсов доцетаксел + карбоплатин + пертузумаб + трастузумаб. Первичной целью исследования была оценка кардиологической безопасности двойной анти-HER2-блокады, вторичные цели исследования включали оценку частоты достижения pCR, которая оценивалась как отсутствие инвазивного компонента в первичной опухоли.

Частота развития симптомной систолической дисфункции левого желудочка (СДЛЖ) и снижения фракции выброса левого желудочка (ФВЛЖ) ≥ 10 % по сравнению с началом лечения и менее 50 % была небольшой среди всех групп. Результаты представлены в табл. 3.
У двух больных группы В было отмечено развитие симптоматической СДЛЖ (одышка при физической нагрузке) в период неоадъювантного лечения, причем у одной больной симптоматика развилась на фоне терапии FEC без двойной анти-HER2-блокады. Таким образом, только у одной (0,4 %) больной из 223, кто получал трастузумаб, пертузумаб в комбинации со стандартной химиотерапией, развилась симптомная СДЛЖ.
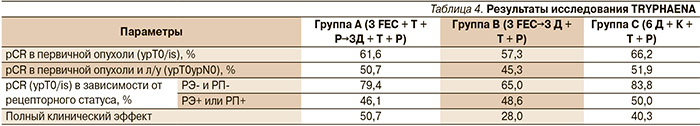
Частота достижения полного морфологического регресса первичной опухоли составила 57,3–66,2 % при использовании двойной анти-HER2-блокады трастузумаб + пертузумаб в комбинации с последовательной и одновременной антрациклинсодержащей химиотерапией либо с химиотерапией на основе карбоплатина. Результаты исследования представлены в табл. 4.
Как и в исследовании NeoShere, более высокая частота pCR была достигнута больными с отрицательным рецепторным статусом опухоли, причем в группе терапии доцетаксел + карбоплатин + пертузумаб + трастузумаб она составила 83,8 %.
На основании проведенных исследований TRYPHAENA и NeoSphere комбинация пертузумаб + трастузумаб была рекомендована FDA в неоадъювантной терапии РМЖ с гиперэкспрессией HER2. В настоящее время проводится изучение эффективности и безопасности применения комбинации пертузумаба и трастузумаба со стандартными режимами химиотерапии в адъювантной терапии (APHINITY).
Другой вариант двойной блокады HER2 (трастузумаб + лапатиниб) был изучен в рандомизированном исследовании III фазы (NeoALTTO). Его целью стала оценка эффективности и безопасности применения трастузумаба, лапатиниба или их комбинации в сочетании с паклитакселом в неоадъювантной терапии больных HER2+-РМЖ.
В исследование были включены 455 больных РМЖ с гиперэкспрессией HER2 с размером опухоли более 2 см. Все больные были рандомизированы в три группы: 1-я группа получала трастузумаб в еженедельном режиме, 2-я – лапатиниб в дозе 1500 мг/сут, 3-я группа – комбинацию трастузумаба в еженедельном режиме и лапатиниба 1000 мг.
В течение первых 6 недель проведена только таргетная терапия, по завершении которой выполнена рентгенологическая оценка эффекта (маммография или магнитно-резонансная томография). Далее все больные получали паклитаксел 80 мг/м2 еженедельно в течение 12 недель в комбинации с таргетной терапией. После хирургического этапа лечения все больные получали адъювантную химиотерапию с включением антрациклинов и продолжали таргетную терапию до 52 недель. Первичной целью исследования была оценка полного морфологического эффекта в первичной опухоли, который рассматривался как отсутствие инвазивного компонента.
Вторичные цели исследования – оценка локорегионарного полного морфологического эффекта (tpCR, отсутствие инвазивного компонента в первичной опухоли и отсутствие вовлечения регионарных лимфатических узлов), объективный эффект после окончания 6 недель таргетной терапии и перед операцией.
Результаты исследования представлены в табл. 5.
Как видно из табл. 5, при использовании комбинации лапатиниб + трастузумаб + паклитаксел полной морфологической ремиссии в первичной опухоли удалось достичь 51,3 % больных по сравнению с 29,5 % в группе трастузумаб + паклитаксел и 24,7 % – в группе лапатиниб + паклитаксел. При этом tpCR отмечена в 46,8 % в группе двойной анти-HER2-блокады по сравнению с 27,6 % в группе трастузумаб + паклитаксел и 20 % в группе лапатиниб + паклитаксел.
Частота объективного клинического эффекта после окончания 6 недель таргетной терапии была значительно выше в группе двойной анти-HER2-блокады – 67,1 %, в группе монотерапии лапатинибом – 52,6 % по сравнению с монотерапией трастузумабом – 30,2 %. Однако при оценке клинического эффекта перед операцией статистически достоверной разницы между группами получено не было.
В зависимости от рецепторного статуса опухоли при оценке pCR исследователями была показана, как и в ранее проведенных исследованиях, более высокая частота pCR у больных с отрицательным рецепторным статусом.
Как и ожидалось, частота диареи 3-й ст. была выше в группе лапатиниба (23,4 %) и в группе лапатиниб + трастузумаб – 21,1 %, в то время как в группе трастузумаба – 2,0 %. Аналогично повышение печеночных ферментов 3-й ст. чаще отмечено в группе лапатиниба – 17,5 %, в группе лапатиниб + трастузумаб – 9,9 % по сравнению с группой трастузумаба – 7,4 %. Значимой кардиологической токсичности отмечено не было.
Заключение
Таким образом, проведенные исследования показывают, что двойная блокада HER2-рецептора безопасна в отношении кардиологической токсичности, позволяет значимо увеличить непосредственную эффективность лечения, что отразилось в увеличении не только выживаемости без прогрессирования, но и в общей выживаемости при метастатическом РМЖ с гиперэкспрессией HER2. Использование двойной блокады HER2 в неоадъювантном режиме достоверно увеличивает частоту достижения полной морфологической ремиссии, что, возможно, приведет и к увеличению выживаемости больных.



