По данным мировой статистики, рак желудка (РЖ) по-прежнему остается одной
из наиболее распространенных злокачественных опухолей, заняв 4-е место по заболеваемости и 2-е место в структуре онкологической смертности. В 2007 г. в мире зарегистрирован почти 1 млн новых случаев РЖ и около 800 тыс. смертельных исходов от него [1]. В России ежегодно регистрируется 40
тыс. новых случаев заболевания и 25 тыс. погибших от него пациентов.
РЖ занимает в России второе ранговое место среди мужчин (после рака легкого) и третье место среди женщин (после рака молочной железы и немеланомных новообразований кожи) в структуре онкологической заболеваемости и второе место как среди мужчин, так и среди женщин в структуре
онкологической смертности. Как и во всем мире, в последние десятилетия прослеживается тенденция к снижению заболеваемости и смертности от РЖ. С 1991 по 2008 г. заболеваемость РЖ снизилась с 43,0 до 27,2 на 100 тыс. мужчин и с 18,5 до 12,0 на 100 тыс. женщин; смертность – с 40,2 до 24,3 и с 17,3 до 10,2 на 100 тыс. соответственно [2].
Несмотря на расширение спектра эффективных лекарственных препаратов, диссеминированный РЖ относится к злокачественным опухолям, умеренно чувствительным к химиотерапии (ХТ). Включение в комбинированные режимы ХТ цитостатиков последнего поколения позволило повысить частоту достижения объективного эффекта, увеличить время до прогрессирования болезни, однако медиана
продолжительности жизни больных по-прежнему не достигала 12 месяцев. Применение цисплатина в комбинации с 5-фторурацилом (5-ФУ) [3, 4], цисплатина – с 5-ФУ и эпирубицином [5], иринотекана – с 5-ФУ [6] позволило обеспечить медиану выживаемости на уровне 7–9 месяцев, а комбинации доцетаксела с цисплатином и 5-ФУ [7], эпирубицина с оксалиплатином и капецитабином [8], оксалиплатина с капецитабином [9] – 9,2–11,2 месяца. При этом частота одногодичной выживаемости, как правило, не превышает 5–15 %.
Неудовлетворенность результатами лечения стимулирует постоянный поиск новых возможностей медикаментозной терапии больных диссеминированным РЖ. Развитие молекулярной биологии позволило выявить ряд молекулярно-генетических характеристик, в соответствии с которыми РЖ
различается по течению и чувствительности к различным таргетным препаратам. В частности, было показано, что в среднем в 15–20 % случаев при РЖ наблюдается гиперэкспрессия рецепторов эпидермального фактора роста 2-го типа (HER2) [10].
Экспериментальные исследования показали, что анти-HER2 моноклональное антитело трастузумаб
(Герцептин) тормозит опухолевый рост клеточных линий и перевиваемых опухолей РЖ с гиперэкспрессией HER2 как самостоятельно, так и в комбинации с цитостатиками (5-ФУ, капецитабином, цисплатином, иринотеканом и паклитакселом) [11]. Экспериментальные данные,
а также опыт успешного клинического применения препарата при HER2-позитивном раке молочной
железы послужили основанием для изучения эффективности и токсичности Герцептина при диссеминированном HER2-позитивном РЖ. С этой целью было организовано многоцентровое рандомизированное клиническое исследование III фазы TOGA, в котором при указанном варианте заболевания оценивали эффективность и токсичность комбинаций цисплатина с капецитабином или 5-ФУ ± Герцептин (трастузумаб). Главной целью исследования стала оценка общей выживаемости
больных; другие параметры оценки эффективности лечения включали: объективный эффект, время до прогрессирования болезни, выживаемость без прогрессирования болезни, продолжительность ответа, переносимость [12].
Образцы опухоли 3665 больных из Европы, Азии и Латинской Америки исследовались иммуногистохимическими и/или FISH-методами на HER2-статус в центральной лаборатории, позитивный статус был выявлен у 810 (22,1 %) пациентов, из которых 594 были рандомизированы в исследование, 584 включены в статистический анализ. Частота гиперэкспрессии HER2/neu была различной при разных гистологических типах опухоли: при интестинальном типе – 32,2 %, при диффузном – 6,1 %, при смешанном – 20,4 %. В опухолях пищеводно-желудочного соустья гиперэкспрессия HER2 была зарегистрирована в 33,2 % случаев, в опухолях желудка – в 20,9 %. Исходные характеристики сравниваемых групп больных были сопоставимыми.
Включение Герцептина (трастузумаб) в режим лечения первой линии привело к статистически достоверному повышению медианы продолжительности жизни больных с 11,1 до 13,8 месяцев (p = 0,0046; отношение рисков [ОР] – 0,74; 95 % доверительный интервал ДИ [ДИ] – 0,60–0,91). При
изучении эффективности ХТ в зависимости от результатов определения статуса HER2-опухоли иммуногистохимическим (ИГХ) методом в совокупности с данными FISH-реакции было установлено, что добавление Герцептина увеличило медиану общей выживаемости больных при ИГХ2+/FISH+ или ИГХ3+ с 11,8 до 16,0 месяцев (ОР = 0,65; 95 % ДИ – 0,51–0,83). Максимального значения медиана
продолжительности жизни больных достигла при ИГХ3+/FISH+-статусе HER2/neu-опухоли – 17,9 месяца (р =0,0048; ОР = 0,58; 95 % ДИ – 0,41–0,81; рис. 1).
Рисунок 1. Изменение медианы общей выживаемости больных в зависимости от результатов определения статуса HTR2-опухоли иммуногистохимическим и FISH-методами.
Объективный эффект и медиана выживаемости без прогрессирования болезни также были достоверно выше у пациентов, получавших трехкомпонентный режим: 47 против 35 % (p = 0,00175) и 6,7 против 5,5 месяцев (p = 0,0002; ОР = 0,71; 95 % ДИ – 0,59–0,85).
Токсичность комбинаций, включая признаки застойной сердечной недостаточности, была практически одинаковой. Бессимптомное снижение фракции выброса левого желудочка (ФВЛЖ) было отмечено среди у 4,6 % больных, получавших Герцептин в комбинации с ХТ, и у 1,1 % пациентов, получавших только ХТ. Таким образом, первое рандомизированное исследование по применению ингибиторов рецепторов HER2/neu в лечении HER2-позитивного РЖ показало, что Герцептин в комбинации с ХТ повышает эффективность терапии без увеличения токсичности.
В качестве примера успешного применения комбинации ХТ и Герцептина с последующей терапией Герцептином при диссеминированном HER2-позитивном РЖ приводим выписку из истории болезни пациента пожилого возраста.
Больной Б. 71 года (дата рождения – 23.12.1934), мужчина, в январе 2006 г. обратился в РОНЦ им. Н.Н. Блохина с жалобами на чувство жжения в эпигастральной области и болезненность в правом подреберье. При обследовании в теле желудка обнаружены опухоль 4 × 4 см с изъязвлениями, метастазы в печени, забрюшинных лимфоузлах.
Гистологическое заключение от 20.02.06: высокодифференцированная аденокарцинома
желудка. HER2/neu ИГХ3+ и FISH+.
Диагноз: рак желудка Т3N2М1 IV ст., метастазы в печень, забрюшинные лимфоузлы. Сопутствующие заболевания: бронхиальная астма с 1990 г., ишемическая болезнь сердца и гипертоническая болезнь с 1998 г. Сопутствующая терапия: эпизодически – фенотерол (Беротек), антигипертензивные препараты при повышении артериального давления.
Эзофагогастродуоденоскопия (ЭГДС) от 10.03.06: в средней трети желудка по большой кривизне с переходом на заднюю стенку заметна изъязвленная опухоль 4 × 4 см.
ФВЛЖ от 17.03.06: 62 %.
Рентгеновская компьютерная томография (РКТ) от 17.03.06: в левой доле печени определяется метастаз 6,5 × 3,8 см, в правой доле – 7,8 × 7,0 см. В забрюшинном пространстве выявляются лимфоузлы до 1,2 см в диаметре (рис. 2, 3).
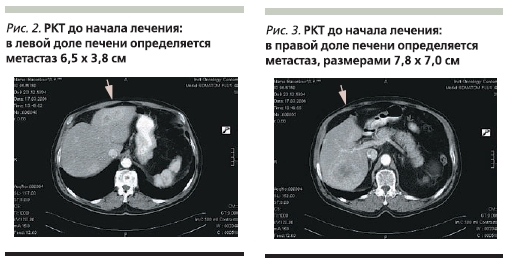
В рамках исследования TOGA больному с 21.03 по 06.07.06 проведено 6 курсов ХТ по схеме: цисплатин 80 мг/м2в 1-й день + капецитабин 2000 мг/м2/сут. Герцептин назначался в 1-й день в дозе 8 мг/кг, далее – по 6 мг/кг 1 раз в 3 недели.
С учетом возможной кардиотоксичности Герцептина на протяжении всего периода лечения проведен мониторинг сократительной функции миокарда путем эхографического определения ФВЛЖ.
Токсичность: нефротоксичность 2-й ст. после 1-го курса, что потребовало редукции дозы цисплатина на 25 %. Других проявлений токсичности не отмечено.
После окончания ХТ с июля 2006 г. проведена поддерживающая терапия Герцептином в дозе 6 мг/кг 1 раз в 3 недели.
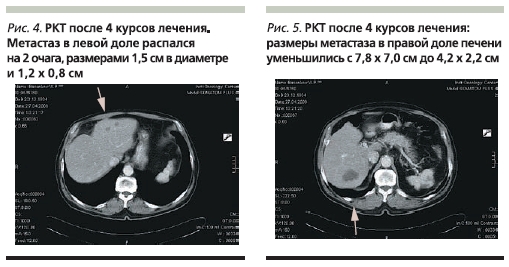
РКТ от 27.04.06 (после 4 курсов; рис. 4, 5) – зарегистрирован частичный регресс опухоли. В левой доле метастаз распался на 2 очага, в правой доле его размер уменьшился до 4,2 × 2,2 см. Забрюшинные лимфоузлы уменьшились до 0,8 см в диаметре.
ЭГДС от 24.04.06: изъязвленная опухоль в средней трети тела желудка представляет собой рубцующийся дефект 1,0 × 1,2 см. ФВЛЖ от 24.04.06: 55 %.
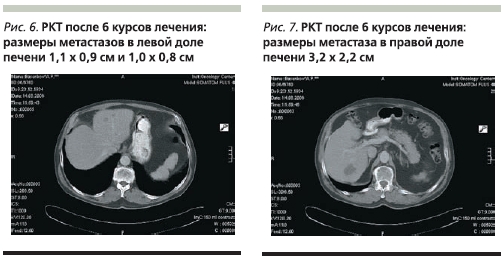
При РКТ от 14.06.06, выполненной после 6-го курса (рис. 6, 7), частичный эффект был подтвержден: размеры метастазов в левой доле печени сократились до 1,1 × 0,9 и 1,0 × 0,8 см, в правой – до 3,2 × 2,2 см. Размеры забрюшинного лимфоузла – 1,2 × 0,7 см. ЭГДС от 15.06.06: в средней трети тела
желудка по большой кривизне отмечен рубцующийся язвенный дефект до 0,8 × 0,4 см. При гистологическом исследовании биоптата клеток рака не получено.
ФВЛЖ от 15.06.06: 67 %.
В последующем на фоне поддерживающей терапии Герцептином отмечено дальнейшее нарастание эффекта.
ЭГДС от 24.11.07: на месте опухоли рубцовые изменения. При цитологическом и гистологическом исследованиях элементов опухоли не найдено. Констатирован полный регресс первичной опухоли.
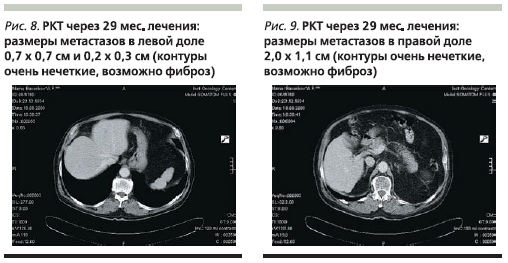
РКТ от 18.08.08 (рис. 8, 9): сохраняется частичный регресс метастазов в печени. Размеры метастаза в правой доле – 2,0 × 1,1 см, контуры нечеткие и тяжистые (возможно, фиброз). Размеры метастазов в левой доле – 0,7 ×0,7 и 0,2 × 0,3 см, контуры очень нечеткие, также возможен фиброз.
20.01.09 у больного развилось острое нарушение мозгового кровообращения на фоне гипертонического криза с образованием субдуральной гематомы, дренирование которой было выполнено 28.01.09 в НИИ РОНЦ им. Н.Н. Блохина. При цитологическом исследовании аспирата клеток рака не найдено. К 04.02.09 состояние пациента улучшилось до удовлетворительного, неврологических нарушений не было. При обследовании: РКТ от 04.02.09 – сохранялась частичная ремиссия. ФВЛЖ – 67 %. Поскольку острое нарушение мозгового кровообращения было связано с отсутствием регулярного приема гипотензивных средств, а не с проводимым противоопухолевым лечением, с 05.02.09 возобновлена поддерживающая терапия Герцептином на фоне постоянной гипотензивной терапии, проводимой и контролируемой участковыми врачами по месту жительства.
26.02.09 выполнена очередная пункционная биопсия очагового образования в печени. При цитологическом исследовании биоптата обнаружены клетки рака, что явилось подтверждением частичной, но неполной ремиссии.
10.06.09 на фоне постоянной поддерживающей терапии Герцептином при плановой РКТ выявлено прогрессирование процесса в виде увеличения суммы наибольших диаметров контрольных очагов в печени на 27 %.
В итоге продолжительность времени до прогрессирования процесса составила 38 месяцев, продолжительность частичной ремиссии – 36.
Терапия Герцептином прекращена. С 13.07.09 начата вторая линия ХТ капецитабином по 2000 мг/м²/сут в течение 14 дней каждые 3 недели. После второго курса, по данным РКТ от 29.06.09, зарегистрирована стабилизация болезни. После проведения третьего курса лечения в связи с развитием выраженной слабости на фоне применения капецитабина больной от дальнейшей ХТ отказался. До настоящего времени находится под динамическим наблюдением.
Данные последнего обследования: ЭГДС от 13.12.10: пищевод визуально не изменен на всем протяжении. Розетка кардии эластичная, смыкается полностью. В желудке определяется небольшое количество слизи, стенки эластичные, слизистая оболочка атрофична. В средней трети тела желудка по
большой кривизне отмечается белесая рубцовая площадка диаметром около 2 см с незначительной конвергенцией складок слизистой оболочки. Складки большой кривизны мягкие, подвижные, при инсуфляции воздуха расправляются полностью. Перистальтика прослеживается во всех отделах. Кольцо пилоруса эластичное. Луковица двенадцатиперстной кишки правильной формы, слизистая оболочка ее бледно-розовая. Постбульбарные отделы не изменены. Заключение: эндоскопическая картина на момент осмотра соответствует рубцовым изменениям в теле желудка, признаков опухолевой инфильтрации не выявлено.
РКТ органов брюшной полости и грудной клетки от 14.07.11: по сравнению с 10.12.10 и 29.06.09 динамики процесса не выявлено: в печени сохраняются 2 очаговых образования прежних размеров и формы (диаметром 0,5 см в левой доле и размерами 2,3 × 0,7 см в правой доле с нечеткими контурами), новых очагов нет. Забрюшинные лимфатические узлы не увеличены. В легких очаговоинфильтративных изменений не выявлено. Лимфатические узлы средостения не увеличены.
На 04.07.12 больной жив, специфического противоопухолевого лечения не получает. Продолжительность жизни составляет 76 + месяцев.
На примере данной истории болезни видно, что пожилые больные способны переносить современные схемы противоопухолевой лекарственной терапии. Достигнутый регресс опухолевых проявлений (у больного Б. был отмечен полный регресс первичной опухоли желудка, частичный регресс метастазов в печени и длительная частичная ремиссия болезни) может сохраняться в течение не только месяцев, но и лет жизни.
Таким образом, онкологическим больным пожилого возраста при отсутствии противопоказаний возможно проведение современного противоопухолевого лекарственного лечения, способного существенно увеличивать продолжительность их жизни и улучшать ее качество. При достижении
стойкой ремиссии онкологического процесса на первое место выходит необходимость адекватной коррекции сопутствующих заболеваний, наиболее значимыми из которых в пожилом возрасте являются сердечно-сосудистые. Адекватная и своевременная коррекция сердечно-сосудистых заболеваний позволяет безопасно применять в лечении онкологических больных наиболее активные лекарственные
комбинации.



