Одной из самых актуальных проблем современной кардиологии является оптимальная тактика лечения пациентов с острым коронарным синдромом (ОКС), представляющих категорию больных с очень высоким риском сердечно-сосудистых осложнений. Назначение статинов в стационаре, когда именно в острый период заболевания пациент психологически наиболее восприимчив к рекомендациям врачей, может увеличить приверженность больных к приему лекарственных препаратов.
Известно, что на протяжении нескольких недель после инфаркта миокарда (ИМ) концентрация липидов в крови несколько ниже их обычного уровня [1], но за первые сутки после возникновения ОКС концентрация липидов еще не успевает измениться и соответствует истинному ее значению у больного.
Согласно Европейским клиническим рекомендациям по лечению больных ОКС [2], применение статинов в ранние сроки госпитализации с целью снижения концентрации холестерина липопротеидов низкой плотности (ЛПНП) менее 1,8 ммоль/л считается обязательным независимо от исходной концентрации, а прием статинов следует начинать с первых часов госпитализации. Безопасность и эффективность статинов для пациентов с ОКС изучалась в значительном количестве исследований.
Исследование MIRACL (Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering) [3] включило 3086 больных 18 лет и старше в первые 24–96 часов после возникновения OKC (нестабильная стенокардия или ИМ без зубца Q), рандомизированных к приему плацебо или аторвастатина в дозе 80 мг/сут в течение 16 недель. Первичными конечными точками были смерть, нефатальный ИМ, остановка сердца с реанимацией, документированная повторная симптоматическая ишемия с необходимостью повторной госпитализации. Средний уровень ЛПНП в группе аторвастатина снизился на 40 % – до 72 мг/дл. Общее число первичных конечных точек в группе аторвастатина оказалось достоверно меньше, чем в группе плацебо, – 14,8 и 17,4 % соответственно (р = 0,048), преимущественно за счет достоверного снижения риска документированной симптоматической ишемии с необходимостью повторной госпитализации: 6,2 % – в группе аторвастатина и 8,4 % – в группе плацебо (р = 0,02). Между двумя изучавшимися группами была выявлена достоверная разница в частоте случаев мозгового инсульта (12 случаев против 14; р =
0,045). Следует отметить, что аторвастатин в высокой дозе (80 мг/сут) хорошо переносился пациентами с ОКС.
В ходе исследования не отмечено тяжелых побочных эффектов с частотой возникновения более 1 %, случаев развития миозита, при этом уровни трансаминаз повышались более трех норм у 38 (2,5 %) пациентов в группе аторвастатина и у 9 (0,6 %) в группе плацебо.
В исследовании PROVE IT-TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy), включившем 4162 пациента с ОКС (из них 36 % – с элевацией сегмента ST), сравнивали высокоинтенсивную терапию статинами (аторвастатин 80 мг/сут) и «стандартный» режим (правастатин 40 мг/сут) [4]. В течение 2 лет оценивали частоту комбинированной конечной точки, включившей смерть от любых причин, приступы возвратной стенокардии, частоту эпизодов нестабильной стенокардии, инсульт и коронарную реваскуляризацию. Средний уровень ЛПНП до включения в исследование составлял в обеих группах 106 мг/дл. На фоне терапии аторвастатином он снизился до 62 мг/дл, в группе правастатина – до 95 мг/дл. Более выраженное снижение уровня ЛПНП привело к достоверному уменьшению частоты комбинированной конечной точки на 16 % по сравнению с правастатином (p < 0,05).
В Z-фазу рандомизированного двойного слепого исследования A to Z (Aggrastat to Zocor) [5] пациенты с OKC рандомизировались либо к приему симвастатина в дозе 40 мг до 5-х суток от развития OKC с увеличением дозы через 30 дней до 80 мг/сут (n = 2265), либо к приему плацебо (n = 2232), через 4 месяца замененного на 20 мг симвастатина. Раннее назначение активной терапии симвастатином не сопровождалось существенным уменьшением частоты основных коронарных событий. Среди возможных причин негативного результата A to Z называют недостаточное число конечных точек, необходимых для адекватной статистической силы полученных данных, более «агрессивную», чем в других аналогичных работах, антитромботическую терапию и частоту инвазивных процедур. Уровень ЛПНП в группе контроля A to Z был существенно ниже, чем в группе правастатина в исследовании PROVE IT; терапия начиналась не с максимальной дозы (в отличие от PROVE IT и MIRACLE). При этом в группах активного гиполипидемического вмешательства в обоих исследованиях достигнутые уровни ЛПНП оказались примерно одинаковыми.
При поступлении пациента с ОКС в стационар существуют различные потенциальные сценарии проведения терапии статинами. Если пациент не принимал статины до развития ОКС, перед кардиологом стоят следующие вопросы: назначить статин в период госпитализации в обычной дозе; использовать максимально возможные дозы статина; применить «ударную дозу» как можно раньше, затем перейти на обычную; использовать большие дозы статина неопределенно долго?
В случае, когда ОКС развился у пациента на фоне лечения статином в обычной дозе, практическому врачу следует решить следующие вопросы:
- продолжить лечение статином в используемой дозе;
- увеличить дозу до максимальной;
- применить «ударную дозу» как можно раньше, затем перейти на обычную?
Исследования последних лет позволяют дать ответ на эти вопросы.
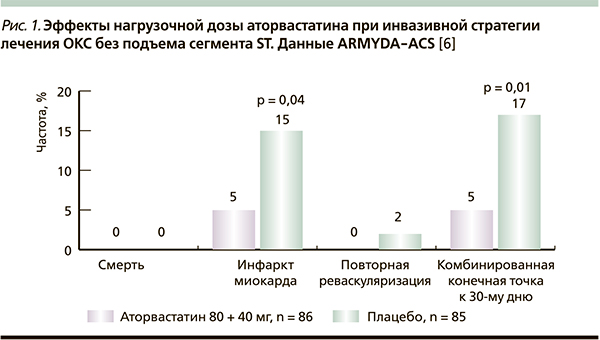
The ARMYDA-ACS (Atorvastatin for Reduction of Myocardial Damage During Angioplasty-Acute Coronary Syndromes) [6] было первым рандомизированным плацебо-контролируемым исследованием высокой нагрузочной дозы аторвастатина для пациентов с ОКС без подъема ST, не принимавших ранее статины, и планируемым инвазивным лечением в первые 48 часов. Среди пациентов 171 был рандомизирован к приему плацебо (n = 85) или лечению аторвастатином в нагрузочной дозе 80 мг с последующим переходом на дозу 40 мг/сут за 12 и 2 часа до коронарной ангиографии (КАГ) соответственно (n = 86). Первичная конечная точка включала случаи смерти, нефатального ИМ и повторной реваскуляризации целевого сосуда к 30-му дню, достоверно чаще отмеченные в группе плацебо (17 % пациентов) по сравнению с группой аторвастатина (5 % пациентов) p = 0,01. Статистическое различие в частоте развития сердечно-сосудистых осложнений в течение месяца было обусловлено преимущественно за счет случаев перипроцедурного ИМ – 15 % в группе плацебо по сравнению с 5 % в группе аторвастатина (p = 0,04; рис. 1). Вторичная конечная точка, учтя число пациентов с постпроцедурным повышением маркеров некроза миокарда, также показала преимущества аторвастатина: уровень МВ-фракции креатинфосфокиназы – 7 % пациентов в группе аторвастатина по сравнению с 27 % в группе плацебо (p = 0,001); тропонин I – 41 против 58 % соответственно (p = 0,039). Многовариантный анализ выявил 88 %-ное снижение риска сердечно-сосудистых осложнений к 30-му дню (отношение рисков [ОР] = 0,12; 95 % доверительный интервал [ДИ] – 0,05–0,50; p = 0,004) и 70 %-ное снижение риска перипроцедурного ИМ в группе аторвастатина, что превосходит данные предыдущих исследований по использованию высокой дозы аторвастатина пациентами с ОКС: в MIRACL [3] – на 16 % снижение риска композитной первичной точки, в A to Z – на 25 % снижение риска [6], в PROVE IT [4] в целом снижение риска составило 28 %, в подгруппе пациентов, которым проведено чрескожное коронарное вмешательство, отмечено снижение риска сердечно-сосудистых осложнений на 22 %.
Следующим шагом в проведении исследований было выявление дополнительной пользы нагрузочной дозы статинов для пациентов с ОКС и планируемым инвазивным вмешательством, принимавших статины постоянно до госпитализации. Исследование ARMYDA RECAPTURE [7] включило пациентов с ОКС без подъема сегмента ST, стабильной стенокардией с планируемым инвазивным вмешательством. Триста восемьдесят три пациента были рандомизированы к приему плацебо (n = 191) или аторвастатина в нагрузочной дозе 80 мг с последующим переходом на дозу 40 мг/сут за 12 и 2 часа до КАГ соответственно (n = 192). Первичная конечная точка включала случаи смерти, нефатального ИМ и повторной реваскуляризации целевого сосуда к 30-му дню, достоверно чаще отмеченные в группе плацебо (9,4 % пациентов) по сравнению с группой аторвастатина (3,7 % пациентов), p = 0,037. Статистическое различие в количестве сердечно-сосудистых осложнений в течение месяца было обусловлено преимущественно за счет случаев перипроцедурного ИМ – 8,9 % в группе плацебо по сравнению с 3,7 % в группе аторвастатина (p < 0,05). Вторичная конечная точка, учтя число пациентов с постпроцедурным повышением маркеров некроза миокарда, также показала преимущества аторвастатина: уровень МВ-фракции креатинфосфокиназы – 13 % пациентов в группе аторвастатина по сравнению с 24 % в группе плацебо, p = 0,017; тропонин I – 37 против 49 % соответственно; p = 0,021. Следует отметить, что субанализ выявил статистически значимую пользу нагрузочной дозы аторвастатина именно в группе пациентов с ОКС (в отличие от больных стабильной стенокардией) – снижение относительного риска сердечно-сосудистых осложнений к 30-му дню на 82 %: 3,3 % пациентов в группе аторвастатина по сравнению с 14,8 % пациентов в группе плацебо (ОР = 0,18, 95 % ДИ – 0,10–0,83; p = 0,027). Таким образом, многовариантный анализ идентифицировал нагрузочную дозу аторвастатина в качестве предиктора снижения риска сердечно-сосудистых осложнений к 30-му дню: ОР = 0,5, 95 % ДИ – 0,2–0,8; снижение ОР сердечно-сосудистых осложнений на 50 %; p = 0,039).
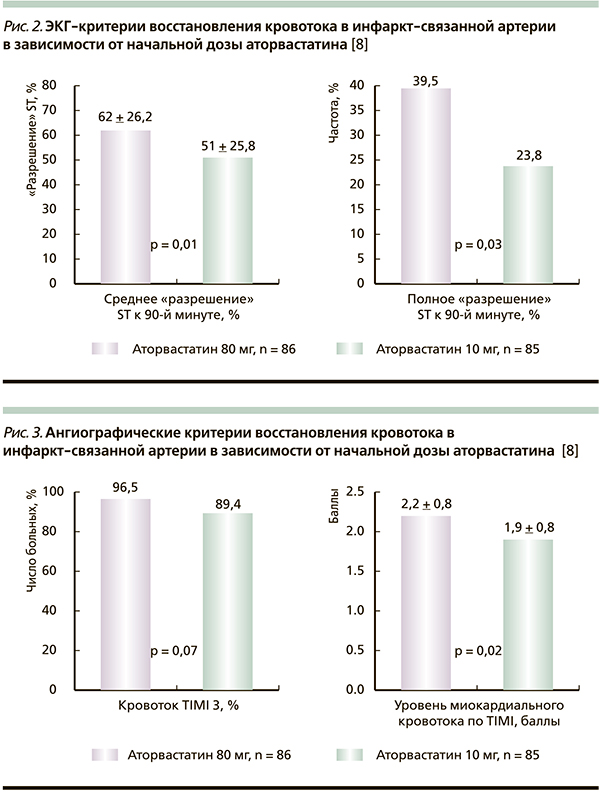
В исследовании The STATIN STEMI Trial [8] 171 пациент с ИМ с подъемом сегмента ST, наличием болевого ангинозного синдрома до 12 часов в возрасте от 18 до 80 лет при госпитализации до проведения первичной ангиопластики были рандомизированы к приему 80 мг аторвастатина (n = 86) или 10 мг аторвастатина (n = 85). Всем пациентам до проведения инвазивного вмешательства назначалась нагрузочная доза клопидогрела (600 мг/сут). После проведения первичной ангиопластики всем пациентам назначили аторвастатин в дозе 10 мг/сут. Первичная конечная точка включала случаи смерти или нефатального ИМ, или повторной реваскуляризации целевого сосуда к 30-му дню. Сердечно-сосудистые осложнения в группе аторвастатина 80 мг/сут отмечены несколько реже по сравнению с группой аторвастатина 10 мг/сут (p = 0,26): соответственно 5 (5,8 %) и 9 (10,6 %) пациентов. Электрокардиографические и ангиографические критерии восстановления кровотока в инфарктсвязанной артерии в группе аторвастатина 80 мг/сут были достоверно лучше по сравнению с группой аторвастатина 10 мг/сут: среднее «разрешение» сегмента ST к 90-й минуте соответственно 62 ± 26,2 против 51 ± 25,8 % (p = 0,01); полное «разрешение» сегмента ST к 90-й минуте соответственно 39,5 против 23,8 % (p = 0,03; рис. 2); уровень миокардиального кровотока по TIMI в баллах соответственно 2,2 ± 0,8 против 1,9 ± 0,8 (p = 0,02; рис. 3). Таким образом, применение аторвастатина в дозе 80 мг/сут перед первичной ангиопластикой не выявило достоверного снижения сердечно-сосудистых осложнений по сравнению с применением аторвастатина 10 мг/сут (возможно, в связи с небольшим количеством больных), но показало достоверное улучшение восстановления коронарного кровотока после первичной ангиопластики. На основании результатов исследования авторы сделали вывод: использование аторвастатина в высокой дозе пациентами с ОКС с подъемом сегмента ST перед первичной ангиопластикой является оптимальной тактикой для улучшения миокардиальной перфузии.
В многоцентровом проспективном рандомизированном открытом исследовании III b-фазы с тремя параллельными группами LUNAR (Limiting Undertreatment of Lipids in Acute Coronary Syndrome with rosuvastatin) [9] сравнивали эффективность влияния приема розувастатина в дозе 20 мг/сут, розувастатина 40 мг/сут и аторвастатина 80 мг/сут на концентрацию ЛПНП у больных ОКС. Больных наблюдали в течение 12 недель. В исследование включили пациентов 18–75 лет, госпитализированных по поводу ОКС в течение 48 часов после развития симптомов ишемии миокарда. В течение 12 часов после развития симптомов концентрация ЛПНП в крови должна была быть более 1,8 ммоль/л, а уровень триглицеридов – менее 5,65 ммоль/л.
Исходно средние концентрации ЛПНП были сопоставимыми во всех трех группах и находились в диапазоне от 3,44 до 3,59 ммоль/л. В различных подгруппах больных нестабильной стенокардией, ИМ без подъема сегмента ST и ИМ с подъемом сегмента ST, с наличием и отсутствием ожирения были получены примерно одинаковые результаты. Снижение концентрации ЛПНП при использовании розувастатина в дозе 40 мг/сут было статистически значимо более выраженным, чем в случае приема аторвастатина в дозе 80 мг/сут через 12 недель терапии (p = 0,02), но не через 2 и 6 недель. Снижение концентрации ЛПНП при приеме розувастатина 20 мг/сут было сопоставимым с таковым при применении аторвастатина 80 мг/сут через 12 недель лечения, но статистически значимо менее выраженным через 2 (p < 0,01) и 6 недель (p = 0,04). Исходно средняя концентрация холестерина липопротеидов высокой плотности (ЛПВП) была схожей во всех трех группах, составив примерно 1,01 ммоль/л. Увеличение концентрации ЛПВП в целом через 6 и 12 недель в группах розувастатина 20 мг/сут (p < 0,01) и розувастатина 40 мг/сут (p < 0,001) было более выраженным, чем в группе аторвастатина 80 мг/сут.
Так, применение розувастатина 40 мг/сут больными ОКС сопровождалось более эффективным снижением концентрации ЛПНП, повышением концентрации ЛПВП по сравнению с приемом аторвастатина в дозе 80 мг/сут.
В качестве ограничения исследования следует отметить отсутствие жестких конечных точек в отношении развития сердечно-сосудистых осложнений.
Таким образом, в последние годы завершено несколько специальных контролируемых исследований, подтвердивших необходимость раннего назначения статинов при OKC.
В настоящее время анализируется несколько возможных механизмов, которые могут обусловливать положительный эффект статинов при ОКС. Действие статинов связывают с процессами стабилизации атеросклеротической бляшки, предотвращением ее повреждения и формирования тромбоза за счет гиполипидемических и т. н. плейотропных (не связанных со снижением уровней холестерина и ЛПНП) эффектов. К этим эффектам относят противовоспалительный, антитромботический, антитромбоцитарный и улучшающий функциональное состояние эндотелия. Обсуждаются такие механизмы действия статинов, как уменьшение выраженности свободно радикального окисления, снижение активности матриксных металлопротеиназ в атеросклеротических бляшках, уменьшение уровня медиаторов воспаления и концентрации С-реактивного белка, а также ряд других эффектов статинов [10].
По мнению исследователей [11], ингибиторы ГМГ-КоА (гидрокси-метилглутарил коэнзим-А)-редуктазы (статины) обладают многосторонними эффектами:
- восстанавливают нарушенную барьерную функцию эндотелия, подавляют оксидативный стресс, ведущий к модификации ЛПНП; последние в свою очередь активируют макрофаги, способствуя усилению захвата и внедрению ЛПНП в подинтимальное пространство, продукции воспалительных протромботических субстанций и металлопротеаз; усиливают обратный захват эфиров холестерина из атеросклеротической бляшки для транспортировки их в печень, способствуя меньшей подверженности атером разрывам;
- подавляют асептическое воспаление артерий;
- подавляют выработку металлопротеаз, вызывающих деградацию фиброзной оболочки бляшки и тем самым предотвращают разрыв покрышки бляшки;
- усиливают вазодилатируюшие свойства венечных артерий, приводя к усилению коронарного кровотока, увеличению коронарного резерва, снижению периферического сопротивления венечных артерий и усилению перфузии миокарда [12].
Противовоспалительные свойства этих препаратов обусловлены как липидными, так и нелипидными механизмами их действия. Снижение содержания ЛПНП на фоне терапии статинами сопровождается снижением проникновения окисленных модифицированных ЛПНП в атеросклеротическую бляшку, что способствует уменьшению выраженности воспаления в стенке сосуда [13–16]. Нелипидные противовоспалительные эффекты статинов могут быть связаны с блокадой ГМГ-КoA-редуктазы и не зависеть от нее. В ряде работ показано, что нестероидные производные мевалоната (изопреноиды – геранилгеранил пирофосфат и фарнезил пирофосфат) обусловливают активацию Rho протеина, инициирующего транскрипцию ядерного фактора κВ, который обладает свойствами универсального мессенджера воспаления, участвует в индуцировании специфических провоспалительных генов, а также в инициации механизмов апоптоза клетки [17–18]. Rho протеин также подавляет синтез оксида азота и необходим для адгезии моноцитов на поверхности клеток эндотелия [19–20]. Подавление активности Rho протеина при применении статинов приводит к увеличению продукции оксида азота клетками эндотелия, подавлению выработки металлопротеиназ макрофагами, угнетению активности Т-лимфоцитов и других клеток воспаления, синтеза хемокинов мононуклеарами периферической крови, а также уменьшает адгезию моноцитов. Описанные эффекты статинов связаны с блокадой ГМГ-КoA-редуктазы и нивелируются в присутствии мевалоната [17–18, 21]. Статины также подавляют связывание лимфоцитов и межклеточных молекул адгезии-1, уменьшают стимулирующее влияние Т-лимфоцитов на лейкоциты путем прямого взаимодействия с соответствующими рецепторами (LFA-1) последних [22–23]. Эти эффекты статинов не были связаны с подавлением активности ГМГ-КoA-редуктазы.
В исследованиях VASCULAR BASIS [24] и PROVE-IT TIMI 22 [4] аторвастатин в дозе 80 мг/сут быстро снижал уровень С-реактивного белка с параллельным снижением сердечно-сосудистых осложнений в течение первых четырех недель.
Статины оказывают влияние на механизмы тромбообразования, что с патогенетической точки зрения обусловливает их назначение при ОКС. Симвастатин, флувастатин и церивастатин уменьшают экспрессию тканевого фактора макрофагами [16, 25, 26]. Применение статинов сопровождается снижением концентрации и активности VII фактора (за счет снижения уровня атерогенных липидов), а также активности V и XIII факторов свертывания крови [27]. Статины подавляют агрегацию тромбоцитов путем уменьшения образования тромбоксана А2, а также снижения содержания холестерина в мембранах тромбоцитов, что уменьшает чувствительность последних к действию веществ, потенцирующих агрегацию [28–29].
Статины уменьшают экспрессию PAR-1 (protease-activated receptor-1) на тромбоцитах, препятствуя их связыванию с α-тромбином. Раннее назначение статинов пациентам с ОКС необходимо для уменьшения степени дисфункции эндотелия. Лечение статинами приводит к увеличению количества циркулирующих эндотелиальных клеток-предшественников уже через неделю [30]. В эксперименте под влиянием статинов увеличивалась скорость реэндотелизации поврежденных баллоном сегментов артерий у крыс, этот эффект реализовался посредством активации Akt-протеинкиназы [31, 32]. Akt-протеинкиназа увеличивает активность NO-синтазы путем увеличения биодоступности оксида азота в месте повреждения [33].
Эффективность статинов в улучшении прогноза пациентов с ОКС позволяет считать их обязательными при лечении данной категории больных высокого риска.
Основные положения Европейских клинических рекомендаций по лечению больных ОКС [2] и Европейских рекомендаций по лечению дислипидемии [34]:
- Статины следует назначать всем больным ИМ независимо от уровня ХС.
- При госпитализации статины следует назначать как можно раньше.
- Следует применять статины в большой дозе с достижением целевого уровня ЛПНП < 1,8 ммоль/л. Предпочтительно применение аторвастатина 80 мг/сут.
- Повторное исследование липидов следует проводить через 4–6 недель лечения статинами.
Следует, однако, отметить неоднозначность мнения, будто целевая концентрация ЛПНП у больных ОКС должна быть менее 1,81 ммоль/л [35–36], что требует проведения дальнейших проспективных рандомизированных исследований. Недавний клинический анализ [37] подтвердил тот факт, что переход с интенсивного на более умеренный режим терапии статинами в течение года после ОКС связан с увеличением сердечно-сосудистых осложнений (ОР = 2,7, 95 % ДИ – 1,7–5,1; p = 0,004).
Таким образом, на сегодняшний день следует подчеркнуть необходимость и обоснованность ранней агрессивной патогенетической терапии статинами большинства пациентов с ОКС.



