В целом по Российской Федерации абсолютное число зарегистрированных больных мочекаменной болезнью (МКБ) с 2002 по 2006 г. увеличилось на 9,2 %, а показатель, рассчитанный на 100 тыс. населения, – на 9,3 %: с 440,5 до 481,6 случая (Лопаткин Н.А., Дзеранов Н.К., 2007).
По разным регионам РФ удельный вес МКБ среди всех урологических заболеваний колеблется от 25,2 % (Уральский регион) до 41,5 % (Восточно-Cибирский регион). Наибольшее число урологических операций и инвазивных вмешательств до сих пор выполняют в связи с МКБ.
Не исключено существование эндемических очагов МКБ, заболеваемость во многом зависит от климатического фактора. Регионы с сухим и жарким климатом, бесспорно, являются эндемичными. Эндемичность МКБ, ее “медицинская география”, подтверждается фактами высокого уровня уратного нефролитиаза у жителей Северного и Южного Кавказа. На проживающих в эндемичных зонах районов Крайнего Севера, несомненно, сказываются влияние климата и качества питьевой воды с избытком кальциевых солей, фактор питания, дефицит инсоляции, недостаток витаминов. Многообразие указанных факторов не исключает роли каждого из них и их сочетаний в генезе мочевых конкрементов, причем определенный этиологический фактор или несколько причин могут быть присущими конкретному больному или группе больных, что свидетельствует о полиэтиологической природе нефролитиаза.
Факторы развития и патогенез уратного нефролитиаза
В структуре заболеваемости МКБ частота встречаемости уратного нефролитиаза (УНЛ) достигает 20–30 %. Заболеваемость УНЛ чаще регистрируется среди мужчин в возрасте 40–60 лет, т. е. в наиболее активный период трудовой деятельности. Число пациентов с УНЛ постоянно увеличивается, что объясняется ростом продолжительности жизни, а также влиянием факторов окружающей среды: гиподинамией, ведущей к нарушению фосфорно-кальциевого пуринового обмена; повышенным потреблением белковых продуктов и алкоголя; применением некоторых лекарственных средств. Чаще всего УНЛ наблюдается среди пациентов с установленным диагнозом подагры (Пытель Ю.А., Золотарев И.И., 1995). Причинами образования уратных камней могут быть и факторы местного характера: инфекция мочевыводящих путей, анатомические и их патологические изменения, приводящие к нарушению адекватного оттока мочи из почек; метаболические нарушения в организме и почке; расстройства микроциркуляции; усиленное выделение литогенных веществ; нарушение баланса между ингибиторами и промоторами кристаллообразования; стойкие сдвиги кислотности мочи.
Благодаря внедрению в диагностику и лечение МКБ современных технологий развитие коралловидной формы УНЛ стало крайне редким, однако отмечена тенденция к увеличению частоты более легких форм. Широкое применение ультразвукового исследования и экскреторной урографии не всегда позволяет точно определять количество и размер рентгеннегативных камней. Внедрение в клиническую практику современных методов компьютерной визуализации (спиральная компьютерная томография с денситометрией, мультиспиральная компьютерная томография с трехмерной визуализацией) позволяет со 100 %-ной достоверностью установить диагноз УНЛ, выработать показания к лечению и оценить эффективность различных его методов.
Ураты являются производными мочевой кислоты (МК) в нерастворимой кетоформе и составляют до 19 % всех мочевых камней, образуясь в резко кислой моче при рН 5,0–5,8; с возрастом они встречаются чаще. Это конкременты, как правило, округлой формы, нередко уплощенные, без отростков, ярко-желтого, оранжевого, иногда буроватого цветов, плотной консистенции. Фактор наследственности при УНЛ имеет место с частотой до 46 % (Джаван-заде С.М. 1999).
Патогенез УНЛ связан с метаболизмом МК (2,6,8-триоксипурин), являющейся продуктом взаимодействия аденина и гуанина, возникающей вследствие превращения гипоксантина в ксантин. В организме человека МК образуется во всех тканях, но главным образом – в печени, в результате распада нуклеотидов, дезаминирования аминопуринов и окисления образовавшихся оксипуринов – гипоксантина и ксантина, при участии ксантиноксидазы (Пытель Ю.А., Золотарев И.И., 1995; Аляев Ю.Г и соавт., 2004). Концентрация МК в сыворотке крови колеблется в пределах 0,12–0,47 ммоль/л. В настоящее время нормой уровня МК в сыворотке принято считать концентрацию 0,16–0,38 ммоль/л. Повышение уровня МК свидетельствует о гиперурикемии. Нормальное содержание МК в суточной моче составляет от 1,4 до 4,2 ммоль/л, увеличение экскреции выше данного порога расценивается как гиперурикурия.
К причинам, приводящим к увеличению концентрации МК в крови, относят увеличение потребления белка на фоне уменьшения двигательной активности. Так, среди лиц умственного труда заболеваемость УНЛ в 3 раза выше, чем среди занятых физическим трудом. Помимо избыточного питания гиперурикемии способствует употребление спиртных напитков, т. к. доказана способность алкоголя блокировать выделение МК почками, вызывая повышение ее содержания в крови. Одной из причин повышения содержания МК в моче являются онкологические и гематологические заболевания, особенно в период проведения цитостатической или лучевой терапии. Это связывают с усиленным нуклеопротеиновым катаболизмом опухолевых клеток, а также с избыточным разрушением тканей и форменных элементов крови в процессе указанного лечения. МК может накапливаться и при приеме некоторых лекарственных средств: мочегонных, антибиотиков, глюкокортикостероидов. В последнее время появились сведения о формировании уратных камней у лиц, длительное время принимавших слабительные.
Механизм образования уратных камней, равно как и камней другого состава, зависит от физико-химических процессов, происходящих в организме в целом и на уровне мочевой системы. Он включает ряд стадий: от насыщения и перенасыщения мочи солями к фазам энуклеации, кристаллизации и роста кристаллов до клинически значащих размеров, когда отсутствуют механизмы ингибирования этого процесса (Тиктинский О.Л., 1980; Пытель Ю.А., Золотарев И.И., 1985; Константинова О.В., 1999). В генезе УНЛ различают общие для камнеобразования причины и причины, связанные с расстройством солевого обмена, однако формирование уратных конкрементов имеет отличия от литогенеза других видов камней, т. к. является следствием нарушений пуринового обмена.
Необходимым условием образования уратного камня является резко-кислая реакция мочи. МК к кетоформе обладает слабокислотными свойствами, растворима только в слабокислой и щелочной средах. При рН > 6,5 МК хорошо диссоциирует и выделяется в енольной (растворимой) форме. При рН мочи > 5,5 происходит ее перенасыщение кристаллами МК, которые выпадают в осадок и служат каркасом для образования камня (Пытель Ю.А., Золотарев И.И., 1985). При снижении рН растворимость МК резко уменьшается и происходит кристаллизация.
Стойкий ацидоз мочи замедляет растворимость МК и способствует образованию уратных конкрементов. Постоянное подкисление мочи объясняется повышенной секрецией ионов аммония почечными канальцами. Установлено, что у больных УНЛ отмечается высокий уровень МК, уменьшение содержания лимонной кислоты и глутамина, а также выделяемых натрия и калия. Содержание аммиака по отношению к натрию и калию увеличено, что связано с постоянным ацидозом мочи (Пытель Ю.А., Золотарев И.И., 1985).
Таким образом, важными процессами, влияющими на рН окончательной мочи, являются ацидо- и аммониогенез. Нарушение регуляции этих процессов может приводить к их активации и резкокислой реакции мочи (Пытель Ю.А., Золотарев И.И., 1985).
Накопление МК возможно, если:
• аммиак быстрее, чем обычно, включается в метаболиты для построения пуринового ядра;
• происходит уменьшение выделения уратов вследствие их усиленной реабсорбции;
• понижается выделение МК вследствие нарушения функции печени и аккумулирования уратов.
В норме организм регулирует процессы образования и выделения МК. При нарушении пуринового обмена данный баланс нарушается и возникает ее гиперпродукция, проявляющаяся гиперурикемией и гиперурикурией. Кристаллурия на эпителии почечного сосочка у больных с гиперурикемией в виде фиксированных микролитов приводит к развитию асептического некроза эпителия, который, отторгаясь, может в условиях гиперурикемии стать ядром будущего конкремента. При подагре, также обусловленной нарушением обмена МК, несмотря на частое поражение почек, образование камней происходит редко.
Для образования уратного конкремента помимо нарушения пуринового метаболизма необходимы и местные почечные факторы, среди которых наряду с нарушениями процессов реабсорбции МК в канальцах и ее выведения из организма большое значение имеют сосудистые изменения, приводящие к развитию интерстициального нефрита и нарушениям энзимной системы почки, транспортирующей и инактивирующей МК.
УНЛ – единственная форма МКБ, при которой ведущим методом лечения является литолитическая (камнерастворяющая) терапия (ЛЛТ). Данный метод используется более 40 лет и связан с применением препаратов, содержащих цитратные смеси (Блемарен, Уралит-У и др.). Споры об их эффективности как в монотерапии, так и на фоне дренированной почки продолжаются до настоящего времени (Раппопорт Л.М. и соавт. 1998; Руденко В.Н., 2004).
Материал и методы
Наше исследование было посвящено оценке эффективности и совершенствованию ЛЛТ при различных вариантах УНЛ.
В исследуемую группу вошли 158 больных УНЛ, находившихся на лечении в НИИ уронефрологии и репродуктивного здоровья человека Первого МГМУ им. И.М. Сеченова. Их демографические характеристики представлены в табл. 1.
На две группы были распределены 100 пациентов: в первую были включены 50 больных, которые получали только ЛЛТ, во вторую вошли 50 пациентов, которым ЛЛТ проводилась на фоне дренирования почки внутренним катетером “стент”. Внутренний стент 28 больным был установлен в плановом порядке, а 22 – экстренно, при камнях мочеточника для восстановления адекватного оттока мочи и проведения ЛЛТ. Оставшимся 58 больным ЛЛТ была назначена после чрескожной, трансуретральной контактной и дистанционной литотрипсии (ДЛТ).
Размер анализируемых камней варьировался в пределах от 7 до 35 мм, средний размер камней в первой группе составил 16,7 ± 5,2, во второй – 16,4 ± 5,3 мм (табл. 2).
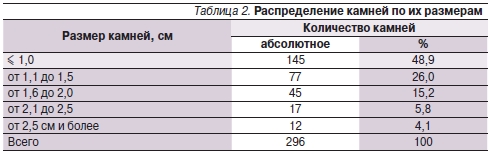
В 63,5 % случаев у больных наблюдалось сочетание гиперурикурии и гиперурикемии, при этом диагноз “подагра” был зарегистрирован в 34,7 % случаев.
Поскольку механизм действия цитратной смеси Блемарен направлен на превращение нерастворимой кетоформы МК в растворимую енольную форму, данный препарат был применен всеми больными.
Методика ЛЛТ
С учетом суточных колебаний состава мочи и неоднозначностью однократного исследования показателя ее рН нами была разработана схема, при которой пациенту перед назначением лечения рекомендовалось в течение 4–5 дней строго в определенные часы (07.00–14.00–19.00) замерять рН мочи, не меняя своего пищевого рациона. По полученным данным вычислялся средний показатель рН в утренние, обеденные и вечерние часы (табл. 3). Вслед за этим пациенту давались рекомендации по изменению диеты и рациона питания: равномерно в течение суток увеличить потребление жидкости до 2,5–3,0 литров, резко ограничить потребление жирных бульонов, мясных продуктов и всех видов алкоголя. Вновь рекомендовалось в течение 5 дней замерять рН мочи в строго обозначенное время для определения средних величин. Только в результате изменения диеты у 28,6 % больных было установлено снижение уровня МК в моче. Несмотря на это, всем пациентам был рекомендован Блемарен, схема назначения которого зависела от среднесуточных показателей рН (табл. 3).
С учетом того факта, что поддержание рН мочи на уровне 6,8 обеспечивает профилактику рецидива, а литолиз эффективен в диапазоне рН 7,0–7,2, из представленного примера, следует, что необходимо повысить дневную и вечернюю рН и, следовательно, дозировку Блемарена следует увеличить до 1,5 таблеток в утреннее и дневное время, тогда как вечернюю оставить прежней. После внесения изменений в схему лечения уровень рН во всех порциях мочи поднялся до 7,0–7,2. Обычный (стандартный) прием препарата на основании результатов одного измерения рН мочи часто не обеспечивает лечебного эффекта, и больной прекращает терапию, не видя ожидаемого результата.
Также ЛЛТ осуществлялась под контролем показателей пуринового обмена с повторным их исследованием через месяц. Десяти больным с гиперурикемией помимо Блемарена в комплексную терапию включался аллопуринол по 300 мг 3 раза в сутки.
Результаты и обсуждение
У 37 (73,3 %) пациентов первой группы и у 40 (80,0 %) больных второй при контрольном обследовании через месяц после начала ЛЛТ было отмечено полное растворение уратных камней. У 5 (10,0 %) пациентов в каждой из групп при контрольном обследовании выявлено уменьшение размера уратных камней, в связи с чем ЛЛТ была продолжена еще на месяц, поскольку у большинства больных размер камней превышал 2,5 см. При очередном контрольном обследовании еще через месяц данных о наличии камней у этих пациентов не было выявлено.
Таким образом, эффективность ЛЛТ в первой и второй группах составила 83,3 и 90,0 % соответственно. Оставшимся 8 (16,7 %) пациентам первой группы и 5 (10,0 %) – второй в связи с отсутствием положительного эффекта от ЛЛТ была выполнена дистанционная литотрипсия, позволившая добиться полной фрагментации камней во всех случаях.
Спектральный состав отошедших или удаленных фрагментов конкрементов (в т. ч. ретроспективно изученных) показал, что в 56,7 % случаев камни состояли из безводной МК, в 26,7 % – из дигидрата МК, в 11,7 % отмечено сочетание дигидрата МК и безводной МК с уратом аммония, а еще в 5,0 % случаев камни состояли из урата аммония. Именно камни, состоявшие из урата аммония, не поддавались ЛЛТ, что потребовало проведения литотрипсии.
Применение препарата Блемарен перед сеансом дробления у 38 больных позволило констатировать существенно значимое сокращение количества и качества импульсов при дроблении камней в сторону снижения энергоемоксти и количества ударноволновых импульсов по сравнению с больными, которым не назначался Блемарен. Тем самым мы еще раз подтверждаем выводы, сделанные Л.М. Раппапортом в 2002 г.
Пациентам с уратными камнями некоторые авторы (Ткачук В.Н. и соавт., 2002; Аляев Ю.Г. и соавт., 2002) рекомендуют в течение 3 недель перед литотрипсией назначать цитратные препараты (Блемарен) для подщелачивания мочи, частичного растворения и разрыхления камня. Блемарен перед ДЛТ назначался не только при уратных, но и при кальций-оксалатных и смешанных уратно-оксалатных камнях.
Авторы своими исследованиями доказали, что прием Блемарена перед ДЛТ позволяет не только уменьшать объем камня, но и снижать его структурную плотность, стабилизировать кристаллизационные процессы в моче за счет нормализации рН, что в свою очередь может быть мерой профилактики повторного камнеобразования.
Выводы
1. Исследование рН мочи у больных МКБ должно стать обязательным методом контроля, лежащим в основе профилактики и метафилактики этого заболевания.
2. Цитратные смеси должны назначаться только после изучения метаболических изменений в крови и моче больного МКБ, под контролем которых должна осуществляться и корректироваться ЛЛТ.
3. При адекватном назначении Блемарена под контролем врача-уролога такое лечение позволяет в 83,3 % случаев добиваться полного растворения мочекислых камней в течение 1,5–2,0 месяцев.
4. Наличие внутреннего стента не является противопоказанием к назначению цитратной смеси в отличие от нефростомического дренажа и повышает эффективность ЛЛТ до 90 %.
5. Назначение цитратных смесей существенно снижает плотность имеющихся в мочевой системе камней, значительно облегчает их последующее дистанционное и контактное разрушение.


