Введение
Мочекаменная болезнь (МКБ) - это хроническое системное заболевание, следствие метаболических нарушений и/или влияния факторов внешней среды, проявляющееся образованием камней в верхних мочевых путях [1].
МКБ является наиболее частой патологией мочевыводящих путей, хорошо известной с самых древних времен: первые описания данного заболевания встречаются за 4000 лет до н.э. [2]. Частота МКБ в развитых странах неуклонно возрастает - от 3,8% в 1970-х гг. до 8,8% в первом десятилетии XXI в. [3]. Более того, в регионах с жарким климатом частота данного заболевания достигает 20% [4]. Увеличение частоты камнеобразования в популяции связано с изменением образа жизни - снижением физической активности, характера питания, растущей частотой ожирения, сахарного диабета 2 типа (СД2), а также с глобальным потеплением [5]. МКБ — рецидивирующее заболевание: в течение 5 лет у 50% пациентов происходит рецидив заболевания [6].
МКБ по сути является системным нарушением наподобие метаболического синдрома, она ассоциирована с увеличением риска развития хронической болезни почек (ХБП), в т.ч. терминальной стадии почечной недостаточности, сердечно-сосудистых заболеваний, в частности артериальной гипертензии (АГ), дислипидемии, а также СД2 [7, 8]. Кроме того, МКБ ассоциирована с остеопорозом и увеличением частоты переломов. Подчеркивает клиническую значимость данного заболевания и тот факт, что почечная колика из-за камнеобразования остается одной из самых частых причин обращения в стационары неотложной помощи [8].
Также необходимо отметить, что в настоящее время отсутствует лекарственная терапия, способная продемонстрировть свою эффективность в лечении и профилактике МКБ [7].
Все вышеуказанное говорит нам о важности профилактики камнеобразования и изучения его модифицируемых этиологических факторов. Одним из таких факторов, действие которого можно элиминировать, тем самым предотвратив развитие МКБ и ее последствия, являются лекарственные средства (ЛС) [9]. Если камнеобразование ассоциировано с приемом какого-либо ЛС, используется термин «лекарственно-индуцированная» (ЛИ) МКБ [10].
Классификация МКБ
Существует несколько классификаций, они основаны на этиологии, составе, локализации, размере и рентгенконтрастности камней [1].
Классификация МКБ по этиологии (причине) камнеобразования:
- Метаболические:
- Кальция оксалат;
- Кальция фосфат;
- Мочевая кислота.
- Инфекционные:
- Магния-аммония фосфат;
- Карбонат апатит;
- Урат аммония.
- Генетически обусловленные:
- Цистин;
- Ксантин;
- 2,8-Дигидроксиаденин.
В Вызванные приемом лекарственных препаратов:
- Аллопуринол;
- Цефтриаксон;
- Хинолоны;
- Триамтерен;
- Индинавир и др. ЛС.
И Идиопатические:
- Классификация МКБ по химическому составу камня:
- Кальция оксалат моногидрат;
- Кальция оксалат дигидрат;
- Мочевая кислота;
- Дигидрат мочевой кислоты;
- Урат аммония;
- Карбонат апатит;
- Кальция гидрогенфосфат;
- Магния-аммония фосфат;
- Цистин.
- Классификация МКБ по локализации камней
- Камни верхней группы чашечек;
- Камни средней группы чашечек;
- Камни нижней группы чашечек;
- Камни лоханки почки;
- Камни верхней /средней / нижней трети мочеточника;
- Камни мочевого пузыря.
- Классификация МКБ по размерам камней в почке:
- Крупные камни — более 2 см в максимальном диаметре;
- Средние камни — от 1 до 2 см в максимальном диаметре;
- Мелкие камни — менее 1 см в максимальном диаметре.
Классификация по рентеноконтрастности камней:
- Рентгеноконтрастные:
- Кальция оксалат моногидрат;
- Кальция оксалат дигидрат;
- Кальция фосфат.
- Слаборентгеноконтрастные:
- Магния аммония фосфат;
- Апатит;
- Цистин.
- Рентгеннеконтрастные:
- Мочевая кислота;
- Урат аммония;
- Ксантин;
- 2,8-Дигидроксиаденин;
- Лекарственно-индуцированные камни.
Стратификация МКБ по группе риска рецидива:
- Пациенты низкой группы риска — без факторов высокого риска;
- Пациенты высокой группы риска при наличии мочекаменной болезни и любого из нижеперечисленных факторов риска.
В свою очередь ЛИ МКБ делятся на две группы в зависимости от механизма, лежащего в основе камнеобразования [11]:
- Камни, содержащие препарат;
- «Метаболические» камни.
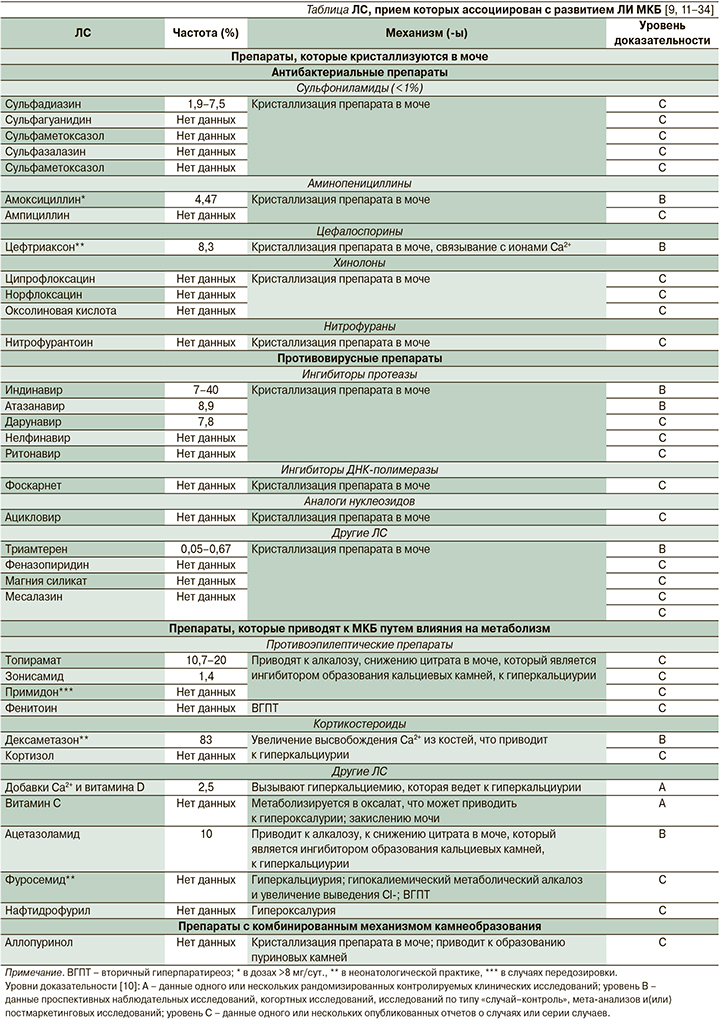
ЛИ МКБ является довольно распространенной нежелательной реакцией (НР) ряда различных ЛС. Группы препаратов и отдельные ЛС, прием которых ассоциирован с развитием ЛИ МКБ, суммированы в таблице [9, 11-34].
Распространенность
Согласно большинству оценок, ЛИ МКБ составляет 1-2% от всех случаев камнеобразования [11]. Однако истинная распространенность камнеобразования на фоне применения различных ЛС может быть недооцененной, т.к. ее диагностика связана с некоторыми трудностями. Большинство камней, содержащих препараты и их метаболиты, являются рентгеннеконтрастными, хотя их можно выявлять при ультразвуковом исследовании (УЗИ) [9]. Кроме того, определение конкретного ЛС как препарата-индуктора может быть затруднено ввиду того, что пациент может принимать одновременно несколько препаратов, способных приводить к камнеобразованию. Наконец, кристаллы, содержащие препарат, могут оставаться в почках в течение длительного времени после завершения терапии: так, описан случай нахождения кристаллов индинавира в почках спустя несколько лет после завершения терапии [35].
Однако существуют данные о распространенности ЛИ МКБ на фоне приема отдельных препаратов. Одной из ведущих и хорошо известных групп препаратов - индукторов данного заболевания являются противовирусные препараты, применяемые в лечении ВИЧ (вирус иммунодефицита человека)-инфекции [11]: на фоне приема ингибитора протеазы атазанавира частота ЛИ МКБ оценивается в 8,9%, при применении индинавира частота камнеобразования может достигать 40% [36]. Другой значимой группой ЛС являются антибактериальные препараты: в педиатрической практике на фоне приема цефтриаксона частота ЛИ МКБ составляет 8,3% [37].
Другой группой ЛС, приводящих к камнеобразованию, являются те, которые влияют на метаболические процессы в почках. Так, на фоне приема ацетазоламида распространенность ЛИ МКБ составляет 10% [37]. Частоту камнеобразования на фоне таких широко используемых средств, как добавки витамина D/кальция, оценить затруднительно, однако, согласно результатам крупных исследований, при применении данных средств риск МКБ увеличивается на 17% [30].
Патофизиологические механизмы
Патофизиологические процессы, которые лежат в основе камнеобразования, сложные и до конца не изученные [38]. В общем в основе образования мочевых камней лежит несколько процессов: нахождение определенных веществ в моче в повышенной концентрации, что приводит к их осаждению; дисбаланс между факторами, провоцирующими и ингибирующими преципитацию. Например, к образованию кальциевых камней, которые составляют около 80% всех камней, приводят такие факторы, как гиперкальцийурия, гиперурикозурия, гипероксалурия и гипоцитратурия [7]. Кроме того, в процессах литогенеза играют роль нарушения уротелия, которые предрасполагают к образованию и последующему росту откладываемых депозитов [39]. Первые два упомянутых процесса и лежат в основе камнеобразования, индуцированного приемом ЛС, следовательно, ЛИ почечные камни делятся на два типа [11]:
1. Камни, состоящие из препарата. В таком случае ЛС и/или его метаболиты — единственный компонент камня либо одна из его составных частей.
Это происходит в связи с осаждением препарата/его метаболитов в почках. Для того чтобы в почках произошла кристаллизация препарата, необходимо несколько факторов. К ним относятся длительная терапия, в т.ч. в высоких дозировках препаратом, который выводится почками. Назначенные ЛС и его метаболиты должны быть плохорастворимыми в воде, соответственно, и в моче. Кроме того, необходимо наличие существовавших со стороны пациента факторов риска (см. раздел «Факторы риска»). Данный механизм камнеобразования характерен для противовирусных, антибактериальных препаратов, триамтерена [11]. Здесь необходимо отметить, что литогенный препарат может влиять на исходно существующие камни, тем самым формируя их смешанный состав. Это требует точного морфологического исследования камня с последовательным анализом его ядра и окружающих слоев [40].
2. Метаболически индуцированные камни. В данном случае препарат индуцирует образование камня путем своего влияние на различные метаболические процессы, влияя на обмен кальция, фосфатов, оксалатов, мочевой кислоты или пуринов, а также на pH мочи [41]. Таков механизм действия ингибиторов карбоангидразы, таких как ацетазоламид, и противоэпилептических препаратов, таких как топирамат [9]. Данные препараты приводят к гипоцитратурии, увеличению рН мочи и гиперкальцийурии. Цитратанион в моче является эндогенным ингибитором литогенеза, приводя к образованию цитрата кальция, более растворимого, чем оксалат и фосфат кальция [42]. В свою очередь увеличение рН мочи >6,7 служит фактором риска для кальциево-фосфатных камней, что связано с увеличением концентрации гидрофосфатаниона, который в итоге связывается с Са2+ в форме гидроксиапатита [42]. Здесь необходимо отметить, что в данном случае ЛИ камни не содержат в своем составе непосредственно препарат, являясь схожими по составу с теми камнями, которые не связаны с назначением ЛС. Следовательно, дифференциальный диагноз ЛИ МКБ в данном случае довольно обширен и требует тщательной оценки [36, 43]. Для установления причинно-следственной связи между назначением препарата и развитием либо ухудшением МКБ возможно воспользоваться сбором фармакологического анамнеза по специальной схеме [44].
Факторы риска
Факторы риска ЛИ МКБ подразделяют на факторы риска, связанные с пациентом и с лекарственной терапией [45].
Факторы риска, связанные с пациентом. Среди таковых необходимо упомянуть МКБ в анамнезе и отягощенный по данному заболеванию семейный анамнез; различные заболевания и аномалии развития мочевыводящих путей, такие как мальформации, гиперплазия предстательной железы, а также сниженный объем мочеиспускания за сутки. Также к факторам риска относят сдвиг рН мочи как в кислую, так и в щелочную сторону, неоднократные рецидивы инфекций мочевыводящих путей, метаболические нарушения, предрасполагающие к литогенезу, такие как гиперкальциурия, гипероксалурия.
Для некоторых препаратов — индукторов МКБ фактором риска является возраст пациента: нефролитиаз на фоне терапии цефтриаксоном, дексаметазоном и фуросемидом наблюдался лишь в неонатологической практике [16, 29, 33]. Низкая масса тела служит фактором риска индинавир-индуцированной МКБ [46]. Для МКБ, индуцированной амоксициллином, фактором риска является женский пол [13].
Также на риск развития ЛИ МКБ оказывают влияние факторы окружающей среды, такие как высокая температура воздуха, которая обусловливает обильное потоотделение [11].
Факторы риска, связанные с лекарственной терапией. К таковым относятся длительная терапия препаратоминдуктором, назначение его в высокой дозировке, а также сочетание данных факторов, что особенно характерно для антиретровирусной терапии ВИЧ-инфекции [47]. Кроме того, важную роль играют такие свойства ЛС, как низкая растворимость в воде тех препаратов и их метаболитов, которые выводятся почками. Важную роль играет фармакокинетика препарата: например, фактором риска индинавир-индуцированной МКБ являются снижение функции почек, печеночная недостаточность, при которой большее значение будет иметь почечный клиренс препарата [46]. Также для литогенеза на фоне приема отдельных ЛС фактором риска служит короткий период полувыведения, обусловливающий колебания концентрации препарата в крови [9].
Фактором риска также является сопутствующая терапия теми препаратами, которые могут приводить к фармакокинетическим взаимодействиям, нарушая экскрецию литогенных веществ и препаратов-индукторов. Риск литогенеза также увеличивается при одновременном назначении нескольких препаратов-индукторов, что встречается, например, при терапии ВИЧ-инфекции: назначение антивирусных ЛС сочетается с терапией оппортунистических инфекций препаратами группы сульфаниламидов [47].
Клиническая картина, диагностика и дифференциальная диагностика
Клиническая картина ЛИ МКБ не отличается от таковой при МКБ, связанной с другими причинами. Приступ почечной колики начинается внезапно, длится от 15 до 45 минут. Боль стойкая, подчас невыносимая, часто сопровождается тошнотой и рвотой. Вместе с продвижением камня по мочеточнику боль перемещается из боковой области в паховую. Могут присоединяться дизурические явления, иногда встречается макрогематурия. Когда камень перемещается в мочевой пузырь или уретру, боль стихает [8].
Иногда МКБ может проявляться тупой болью в пояснице, симптомами со стороны желудочно-кишечного тракта, такими как диарея, а также изолированной микрогематурией, бессимптомной обструкцией мочевых путей с формированием почечной недостаточности.
МКБ также может быть случайной находкой при проведении инструментальных методов исследования брюшной полости [8]. В случае лекарственно-обусловленной этиологии нефролитиаз также может быть бессимптомным — это характерно, например, для цефтриаксон-индуцированной МКБ [16].
Диагностика. Абсолютное большинство камней, содержащих препарат, рентгеннеконтрастные, однако данный тип камней диагностируется с помощью УЗИ или компьютерной томографии (КТ) без контрастирования.
Для определения именно лекарственно-индуцированной характера МКБ необходимо определить причинно-следственную связь между назначением препарата-индуктора и развитием заболевания. Возникновение типичной почечной колики вскоре после назначения препарата, прием которого ассоциирован с развитием ЛИ МКБ, у пациента без МКБ в анамнезе, особенно в случае рецидивов, должно насторожить врача в отношении ЛИ МКБ [11]. Однако диагностика может быть затруднена в связи с тем, что пациент может принимать одновременно несколько потенциально литогенных препаратов. Кроме того, нефролитиаз может проявляться спустя несколько лет терапии препаратом-индуктором либо спустя несколько лет после его отмены [11].
Для идентификации камней, состоящих из препаратов или их метаболитов, необходим тщательный анализ химического состава камня с помощью методов распознавания его компонентов, таких как осмотр через микроскоп, дифракции рентгеновских лучей и масс-спектрометрии [40].
В случае, если выполняется биопсия почки, информативна инфракрасная микроскопия, при которой обнаруживаются кристаллы в канальцах или внутри клеток [11].
Дифференциальная диагностика. Образование камней — сложный многофакторный процесс, который включает как внутренние (пол, возраст, наследственность), так и внешние (регион проживания, диета, объем потребления воды) факторы [42]. Для дифференциальной диагностики ЛИ МКБ необходимо оценить не только вклад ЛС в процесс литогенеза, но и влияние данных факторов.
К основным факторам, приводящим к МКБ, относятся жаркий климат; диета с увеличенным потреблением животных белков, соли и дефицитом волокон и щелочных продуктов питания; метаболические нарушения — гиперкальциурия, гипероксалурия, гипоцитратурия, гиперурикемия, гиперкальциемия различной этиологии; дегидратация и выделение перенасыщенной мочи; рецидивирующие инфекции мочевыводящих путей; семейный анамнез МКБ; анатомические нарушения мочевыводящих путей; АГ и ожирение; воспалительные заболевания кишечника [7].
Лечение
Основой лечения ЛИ МКБ служит отмена препарата-индуктора [11]. Чтобы произошло спонтанное отхождение камней, обычно небольшого размера и гладких, либо растворение кристаллов, возможно использование нескольких мер. К ним относятся увеличение потребления жидкости, коррекция диеты и изменение рН мочи.
Увеличение объема мочи, связанное с увеличением потребления жидкости, приводит к разбавлению литогенных веществ и снижению их концентрации [48]. Если это возможно в связи с сопутствующими заболеваниями, рекомендуется употребление жидкости в объеме 2,5-3,0 л/сут [48].
Низкосолевая диета снижает концентрацию Са2+ в моче и частоту рецидивов МКБ [7]. Следовательно, для лиц, страдающих МКБ, рекомендуется прием <5,9 г соли/сут [49]. Также рекомендуется ограничение потребления животного белка до 0,8-1,0 г/кг веса/ сут. Снижение кальция в рационе не связано со снижением риска МКБ, даже, наоборот, может его увеличивать. Следовательно, рекомендуется диета с нормальным содержанием кальция в количестве 1,0-1,2 г/сут [49]. Также рекомендуется диета, богатая овощами (кроме зеленых листьев, содержащих большое количество оксалатов) и фруктами, что ведет к снижению избыточных концентраций оксалата кальция и мочевой кислоты [50].
В случае обструкции камнем мочевыводящих путей с формированием острого почечного повреждения необходимы хирургические методы лечения, такие как уретральное стентирование, т.к. большинство ЛИ камней не поддаются экстракорпоральной ударно-волновой литотрипсии [11].
Профилактика
Меры профилактики ЛИ МКБ основаны на поддержании больших объемов мочеиспускания при терапии препаратами-индукторами, особенно в случаях длительного лечения. Необходимо тщательно подходить к назначению возможных препаратов-индукторов пациентам, имеющим факторы риска развития ЛИ МКБ, особенно в случае назначения нескольких потенциально литогенных ЛС [9]. Кроме того, для профилактики данной патологии возможна коррекция модифицируемых факторов риска ЛИ МКБ, связанных с пациентом, таких как гиперплазия предстательной железы, инфекции мочевыводящих путей [11]. Методы коррекции диеты, перечисленные в разделе «Лечение», а также достаточный уровень физической активности также служат значимыми факторами профилактики ЛИ МКБ [48-50].
Заключение
Таким образом, проблема ЛИ МКБ весьма актуальна в клинической практике. Препараты-индукторы приводят к литогенезу путем двух различных механизмов: кристаллизации в моче и влияния на различные метаболические процессы. Среди значимых препаратов - индукторов ЛИ МКБ необходимо упомянуть антиретровирусные препараты, триамтерен, противоэпилептические ЛС и витамины D и C. Важная роль в лечении и профилактике принадлежит потреблению больших объемов жидкости, модификации диеты. Осведомленность специалистов практического здравоохранения о проблеме литогенеза, обусловленного действием ЛС, считается важной составляющей в профилактике и лечении МКБ.



