У больных циррозом печени (ЦП) вирусной этиологии частота развития портальной гастропатии (ПГ) составляет около 50–70 % [9]. Клинически ПГ протекает чаще бессимптомно, но может проявлять себя как острое или хроническое желудочное кровотечение с признаками железодефицитной анемии (ЖДА). Геморрагические проявления на слизистой оболочке желудка и формирование анемии у больных хроническими вирусными заболеваниями печени являются неблагоприятными прогностическими признаками, существенно влияющими на качество жизни пациентов. С учетом вышеизложенного ранняя диагностика и своевременная профилактика ПГ в сочетании с правильной этиотропной и патогенетической терапией может существенно улучшить прогноз заболевания у больных хроническим вирусным гепатитом (ХВГ).
Этиология и патогенез
Патогенез синдрома ПГ на сегодняшний день остается малоизученным. Предполагается, что ведущую роль в развитии ПГ играет повышение давления в портальной системе с шунтированием крови в портокавальных анастомозах. В нормальных условиях давление крови в системе воротной вены составляет 4–6 мм рт. ст., при ЦП оно может подниматься до 25–30 мм рт. ст. с развитием коллатеральной циркуляции, при этом портальная гипертензия поддерживается за счет гипердинамического типа кровообращения. Отмечена прямая зависимость между тяжестью ПГ, величиной портопеченочного давления, индексом портального полнокровия и степенью дисфункции печени (согласно критериям Child–Pugh) [1, 4]. Увеличение притока венозной крови к слизистой оболочке желудка вызывает расширение ее капилляров, способствует застойным явлениям и гипоксии [1, 7]. Это приводит к гипертрофии эндотелия сосудов и делает его более чувствительным к повреждающим агентам [14]. Кроме того, данные изменения гемодинамики способствуют увеличению выработки фактора некроза опухоли α и простагландинов, которые активируют содержащуюся в слизистой оболочке желудка эндотелиальную NO-синтазу и эндотелин-1 [7, 15]. Повышенная продукция NO, эндотелина-1, а также сосудистого эндотелиального фактора роста индуцирует образование тромбов, разрыв венул и внутрислизистые кровоизлияния. Развившаяся гипоксия тканей и усиление перекисного окисления липидов определяют ишемический компонент в повреждении железистых клеток, что усугубляет проявления ПГ [1, 2].
В развитии ПГ существенное значение может играть повышенное содержание гастрина в крови при снижении инактивации его в печени из-за печеночно-клеточной недостаточности, что может приводить к снижению секреции гидрокарбонатов и расстройствам желудочного слизеобразования. Уменьшение продукции слизи происходит в результате нарушения функции мукоцитов и является дополнительным фактором, снижающим резистентность слизистой оболочки желудка [1, 6].
Вероятность развития кровотечения из слизистой оболочки желудка при ПГ возрастает при полипрогмазии (одновременном применении более 4 лекарственных препаратов), применении нестероидных противовоспалительных средств, лечении гепатопротекторами [3].
На стадии изучения находится вопрос о связи ПГ с Helicobacter рylori. Имеются работы, доказывающие отрицательное влияние Н. рylori на ПГ. При этом ряд исследователей не находят связи между степенью колонизации Н. рylori и тяжестью ПГ [6].
Склерозирование варикозно расширенных вен пищевода значительно усиливает сосудистую эктазию слизистой оболочки желудка при ПГ, что может способствовать кровотечению [1, 3, 11].
Факторы, способствующие развитию ПГ:
• повышение давления в портальной системе;
• повышенная продукция NO, эндотелина-1, сосудистого эндотелиального фактора роста;
• повреждение железистых клеток желудка и уменьшение продукции слизи;
• повышенное содержание гастрина в крови при снижении инактивации его в печени из-за печеночно-клеточной недостаточности;
• полипрогмазия, лечение гепатопротекторами, НПВС;
• возможно, течение ПГ усугубляется наличием Н. рylori;
• лигирование и склерозирование вен пищевода.
Морфологически ПГ проявляется увеличением количества артериовенозных шунтов между подслизистым слоем и слизистой оболочкой желудка, расширением прекапилляров и венул подслизистого слоя, т. е. сосудистой эктазией. При ПГ биопсия слизистой оболочки из кардиального отдела желудка позволяет обнаруживать расширение прекапилляров, фиброзно-мышечную гиперплазию и периваскулярный фиброз [1, 3, 6, 7].
Клинические проявления
ПГ может протекать в различных клинических вариантах, чаще всего бессимптомно или с минимальными проявлениями (жалобы на дискомфорт в эпигастрии, изжогу, отрыжку, незначительную слабость). В отсутствие патогенетического лечения ПГ прогрессирует до развития кровотечения непосредственно из слизистой оболочки желудка и проявляется клинически гипохромной ЖДА, которая при ЦП усугубляется нарушением свертываемости [1, 3]. Патология системы крови – частое осложнение ХВГ и наблюдается более чем у половины больных [3].
Об остром кровотечении у больных ПГ свидетельствуют жалобы на рвоту с кровью (кофейной гущей) или черный стул (мелену) при обязательном лабораторном подтверждении (снижении содержания гемоглобина в периферической крови, железа – в сыворотке крови). Окончательный диагноз устанавливается после исключения кровотечения из варикозно расширенных вен пищевода или других источников кровопотери. Хроническое кровотечение, ассоциированное с ПГ, чаще всего выявляют при плановом обследовании по поводу ЖДА. После чего больной направляется к гастроэнтерологу, от квалификации которого зависит правильная интерпретация патологии желудка. Часто проходят годы до установления диагноза ХВГ и, соответственно, начала правильного этиотропного и патогенетического лечения [2, 3, 5]. Однако в большинстве случаев диагноз ПГ и как следствие – гипохромная ЖДА ставятся уже на фоне известного ХВГ [6, 15].
Ведение больных ХВГ предусматривает лечение основного заболевания и профилактику осложнений, в т. ч. ПГ и ЖДА, для чего обязательно соблюдение стандартов обследования. Всем пациентам с впервые диагностированным ЦП или подозрением на него необходимо выполнять эзофагогастродуоденоскопию (ЭГДС) с целью выявления ПГ. Дальнейшая частота ЭГДС зависит от эндоскопической картины и степени поражения печени по критериям Child–Pugh [1] (табл. 1).
Оптимальные результаты профилактики и лечения ПГ достигаются на стадии ЦП, соответствующей классу А.
Ключевым методом в диагностике ПГ является эндоскопическое исследование желудка. На согласительной конференции по вопросам эндоскопии желудка при портальной гипертензии (Милан, Италия, 19 сентября 1992 г.) ПГ определена как изменение слизистой оболочки желудка в виде небольших полигональных участков розового цвета, слегка выступающих к центру по типу “мозаики”.
Определены три основных эндоскопических признака:
1 – мелкие красные точки на слизистой оболочке желудка диаметром менее 1 мм;
2 – красные пятна диаметром более 2 мм;
3 – черно-коричневые пятна, являющиеся следствием внутрислизистых геморрагий [6, 9, 14].
K. Tanoue и соавт. классифицировали ПГ по трем степеням тяжести:
• 1-я ст. – небольшая гиперемия отдельных участков слизистой оболочки желудка, слизистая оболочка имеет “застойный” вид.
• 2-я ст. – выраженное покраснение с участками возвышающейся отечной слизистой оболочки желудка, разделенными тонкой белой сетью, – изменения по типу “мозаики”.
• 3-я ст. – точечные геморрагии на фоне макроскопических изменений, характерных для 2-й ст. [7].
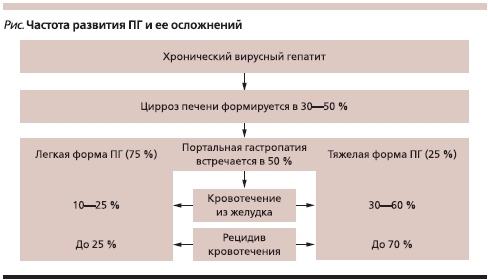
Наиболее простая классификация (T.T. McCormack и соавт.) предполагает две степени поражения слизистой оболочки желудка. При ПГ легкой степени эндоскопически выявляют мозаичный рисунок слизистой оболочки, при тяжелой – в дополнение к мозаичному рисунку появляются диффузные темно-красные пятна, подслизистые геморрагии. Эта классификация удобна для прогнозирования вероятности развития кровотечения. Так, при легкой степени ПГ, которая выявляется в 75 % случаев у всех больных ПГ, риск кровотечения составляет до 25 %. При тяжелой степени ПГ, встречающейся в 25 % случаев, частота кровотечений увеличивается до 60 %, которые могут оказаться фатальными (см. рисунок) [9].
Лечение и профилактика
При наличии клинических признаков ПГ при ХВГ рекомендуется применение комбинированного лечения противовирусными препаратами и средствами, направленными на нормализацию состояния слизистой оболочки желудка и предотвращение кровотечений (табл. 2).
Для профилактики осложнений ПГ наиболее оправданным остается применение неселективных β-адреноблокаторов, эффективных при лечении пациентов с гипердинамическими нарушениями кровообращения, наблюдающимися при ЦП, и способствующих снижению давления в воротной вене, уменьшая риск кровотечения [1, 10, 11]. С этой целью используют пропранолол, который назначают в дозе от 10 до 120 мг 2 раза в сутки [13].
Важным направлением терапии ПГ является применение ингибиторов протонового насоса желудка, оказывающих антисекреторное действие, ингибируя АТФазу париетальных клеток слизистой оболочки желудка, что приводит к уменьшению секреции соляной кислоты. Представители этой группы – омепразол, эзомепразол, пантопразол. Пантопразол назначают внутрь 40–80 мг/сут в 2 приема. Для защиты слизистой оболочки желудка применяются Н2-блокаторы – ранитидин, фамотидин, участвующие в регуляции секреторной деятельности желудка. Ранитидин назначают по 0,3 г 1 раз вечером в течение 4–8 недель [1, 4, 5, 10].
При ПГ оправданно применение обволакивающих средств, обладающих и антацидными свойствами, – Альмагель (по 1 дозированной ложке 3 раза в сутки за 30 минут до еды и перед сном); алюминия фосфат (по 1–2 пакетика 50 %-ного геля 2–3 раза в сутки); висмута трикалия дицитрат (0,12 г 4 раза в сутки за 30 минут до еды и перед сном, спустя 2 часа после еды, курс лечения – 6–8 недель) [4, 5].
Если у пациентов с ПГ выявляется Н. рylori, необходимо проведение антибактериальной терапии [6, 10]. При острых кровотечениях наибольшую эффективность за счет снижения полнокровия слизистой оболочки желудка показал октреотид – синтетический аналог гормона соматостатина, способный редуцировать портальное давление с умеренным уменьшением печеночной перфузии [12]. Для лечения гипохромной ЖДА применяют препараты железа (железа (III)-гидроксид полиизомальтоза для внутримышечных введений), для коррекции выраженной анемии используются внутривенные формы железа (железа (III)-гидроксид декстрана комплекс, железа (III)-гидроксид сахарозный комплекс) [3, 15]. Консервативная эндоскопическая терапия кровотечений при ПГ применяется редко и заключается в использовании эндоскопической (аргоноплазменной) коагуляции [8, 10].
Результаты собственных наблюдений
Мы проанализировали 507 историй болезни пациентов с хроническим гепатитом С (ХГС) и ХГВ, наблюдавшихся в стационарах и поликлиниках общетерапевтического профиля Москвы. ХГС был диагностирован 323 (63,2 %) больным, ХГВ – 184 (36,8 %). Среди обследованных пациентов было 216 (42,3 %) женщин и 295 (57,7 %) мужчин.
Диагноз ПГ обследованным пациентам ставился в период от первичного обращения к терапевту до начала проведения противовирусной терапии. Все пациенты, включенные в исследование, прошли необходимые обследования, включившие серологическое исследование, ПЦР (полимеразную цепную реакцию)-диагностику, общий анализ крови и мочи, биохимическое исследование крови, ультразвуковое исследование брюшной полости, ЭГДС, в отдельных случаях компьютерную томографию, пункционную биопсию печени, ФиброМакс и эластографию.
В нашем исследовании клинические проявления ЦП имели место у 150 (29,6 %) больных, в т. ч. у 90 (17,8 %) больных – ХГС, у 60 (11,8 %) – ХГВ. Среди них признаки ПГ выявлены у 59 (36,8 %) пациентов, из них 33 (22 %) больны ХГС, 26 (17,3 %) – ХГВ.
ЖДА (снижение среднего объема эритроцитов, низкий уровень сывороточного железа и повышение общей железосвязывающей способности сыворотки) как следствие кровотечения при ПГ имела место в 22 (37,3 %) случаях, включая 12 (20,4 %) пациентов с ХГС, 10 (16,9 %) – с ХГВ.
Кровотечения легкой степени зарегистрированы у 32 (54,3 %) человек, которым проведена терапия в соответствии с установленными стандартами. Повторные кровотечения развились при тяжелой степени ПГ в 11 % случаев.
Таким образом, ПГ – это распространенное осложнение хронических вирусных заболеваний печени на стадии формирования ЦП, которое часто сопровождается кровотечением и ЖДА. Многие звенья этиологии и патогенеза ПГ на сегодняшний день до конца не изучены и нуждаются в углубленном исследовании. Правильное и своевременное соблюдение утвержденных стандартов обследования и лечения позволит сократить риск развития ПГ. В лечении ПГ, проводимом на фоне противовирусной терапии, оправданным остается применение β-адреноблокаторов, антацидов, блокаторов протонной помпы; лечение наиболее эффективно на ранних стадиях ЦП.


