Распространенность и феноменология запора
С незапамятных времен регулярная дефекация является одним из главных показателей здоровья человека, его хорошего самочувствия и настроения. Своевременный и оформленный стул – это интегральная оценка функционирования важнейшей системы организма (системы пищеварения) и его деятельности в целом.
Эпидемиология запора характеризуется следующими основными моментами:
• высокой распространенностью заболевания – от 4 до 20 % в популяции;
• среди женщин запор встречается чаще, чем среди мужчин;
• распространенность запоров растет с возрастом;
• заболевание чаще выявляется в неблагоприятных социально-экономических условиях.
Оценивая распространенность заболевания, необходимо учитывать, что существует диссонанс между восприятием запора больными и диагностированием данной патологии врачами с учетом современных диагностических критериев. Больные в большинстве случаев под запором понимают любой абдоминальный или ректальный дискомфорт, связанный с трудностью или задержкой дефекации вне зависимости от частоты его возникновения. Так, в международном исследовании при опросе около 14 тыс. человек из США, Великобритании, Германии, Италии, Бразилии и Южной Кореи 39–67 % из них сообщили, что страдают запором более 3 лет, 30–71 % испытывали симптомы запора чаще, чем 1 раз в неделю. При этом симптомы запора сохранялись независимо от того, принимает пациент слабительные или нет [30]. В Москве в 2011 г. на запор пожаловались 34,3 % респондентов [1].
Более частое выявление запора среди женщин обусловлено выраженными месячными и возрастными гормональными модуляциями. При повышении уровня прогестерона снижается активность простагландинсинтетазы и повышается активность 15-гидроксипростагландиндегидрогеназы, превращающей простагландины в неактивные метаболиты. Вследствие высокой чувствительности миоцитов к циркулирующим простагландинам это приводит к замедлению кишечного транзита.
Женщинам свойственна большая озабоченность по поводу гигиены, они чаще испытывают смущение из-за запаха и шума в общественном туалете, неудобства при пользовании туалетом и ванной комнатой вне дома. Кроме того, беременности часто приводят к появлению внутреннего геморроя, после родов происходят изменения мышц тазового дна, что затрудняет процесс дефекации.
Запор более распространен, чем мигрень, астма, сахарный диабет и ишемическая болезнь сердца. При этом важно, что наиболее частыми жалобами подобных больных, значительно отягощающими их повседневную активность, являются не редкие акты дефекации, а вздутие живота, натуживание при дефекации и твердый стул [16]. В то же время врачи в повседневной клинической практике нередко не уделяют должного внимания выявлению и купированию всех симптомов запора, ограничиваясь лишь коррекцией ритма дефекации.
Запор в некоторых случаях характеризует появление таких серьезных осложнений, как хронический геморрой, дивертикулез, дивертикулит, анальная трещина, язвы, кровотечения, перфорации, выпадение прямой кишки и недержание кала.
Согласно Римским критериям-III, к функциональному запору относят следующий симптомокомплекс:
• появление симптомов за 6 месяцев до установления диагноза;
• 2 и более из следующих симптомов, отмеченных за последние 3 месяца и сопровождаемых 25 % и более актов дефекации:
• натуживание;
• комковатый или твердый стул;
• ощущение неполного опорожнения;
• ощущение аноректальной обструкции/блокады;
• необходимость ручного вспоможения;
• менее 3 актов дефекации в неделю;
• стул редко возникает без слабительных;
• отсутствуют критерии синдрома раздраженного кишечника (СРК).
При этом к диагностическим критериям СРК с запором относят периодические боли в животе или дискомфорт (неприятное ощущение, не описываемое как боль) не менее 3 дней в месяц в течение последних 3 месяцев, имеющих не менее двух из трех следующих характеристик:
• улучшение после дефекации;
• начало связано с изменением частоты стула;
• возникновение связано с изменением формы стула.
Данные симптомы должны продолжаться не менее 6 месяцев, из них 3 месяца – непрерывно [11].
Таким образом, основное отличие функционального запора от СРК с запором – это наличие абдоминальной боли или дискомфорта в животе, связанных с процессом дефекации. При этом надо учитывать, что в некоторых случаях это трудноразличимо на практике, т. к. иногда при функциональном запоре длительное отсутствие дефекации приводит к неприятным ощущениям в животе за счет значительного растяжения кишки содержимым и газами. В то же время при СРК с запором боль обусловлена спастическим сокращением стенки кишки, ее гиперчувствительностью [12].
Причины запора
Запор подразделяют на первичный (функциональный или идиопатический) и вторичный, когда выявляется его причина. Согласно практике автора, частота первичного запора составляет около 90 %. Вторичный запор, соответственно, намного менее распространен и его причинами могут служить:
• Метаболические или эндокринные нарушения:
• гиперкальциемия;
• гиперпаратиреоз;
• сахарный диабет;
• гипотиреоз;
• гипокалиемия;
• уремия;
• болезнь Аддисона–Бирмера;
• порфирии.
• Неврологическая патология:
• болезнь Паркинсона;
• рассеянный склероз;
• автономная нейропатия;
• аганглиоз (болезнь Гиршпрунга);
• болезнь Шагаса;
• поражения спинного мозга;
• цереброваскулярные болезни.
• Системная патология:
• амилоидоз;
• склеродермия;
• полимиозит.
• Беременность.
• Психологические расстройства:
• депрессия;
• расстройства пищевого поведения.
• Прием медикаментов:
• опиаты;
• антидепрессанты;
• антихолинергические препараты;
• нейролептики;
• антациды (содержащие соли алюминия, кальция);
• блокаторы кальциевых каналов;
• препараты железа.
• Последствия хирургических вмешательств и спаечная болезнь.
• Гастроэнтерологические заболевания:
• колоректальные образования;
• ишемия кишки;
• дивертикулит;
• другие.
Первичный запор может быть обусловлен удлинением времени кишечного транзита, расстройствами дефекации или характеризоваться нормальным временем кишечного транзита.
Запор с замедленным транзитом характеризуется увеличением времени кишечного транзита, обусловленным дисрегуляцией энтеральной нервной системы, снижением выработки оксида азота, нарушением гастроколитического рефлекса, снижением количества интерстициальных клеток Кахала в толстой кишке и другими причинами. Наблюдаются редкие дефекации, сниженная частота позывов и натуживание при дефекации [13].
Тип запора с нормальным кишечным транзитом – самый частый. При этом время кишечного транзита и частота стула у пациента в норме. Несмотря на это, они испытывают трудности при дефекации. Эта группа часто совпадает с больными СРК с преобладанием запоров. Основным различием является преобладание болей в последней группе [13].
Расстройства дефекации обусловлены диссинергией тазовых мышц и чаще встречаются среди пожилых женщин, после родов, травм. У таких пациентов наблюдается нарушенная координация мышц тазового дна и анальных сфинктеров во время дефекации. Характерны жалобы на натуживание и чувство неполного опорожнения. Также может требоваться надавливание в области промежности для осуществления дефекации. Диссинергия мышц тазового дна сочетается с замедленным транзитом [13]. К факторам, способствующим ее развитию, относят анальные трещины, геморрой, ректоцеле, выпадение прямой кишки.
Диагностика запора
Диагностика запора основывается преимущественно на клинических данных. Необходимо уточнять у пациента частоту стула, наличие натуживания при дефекации, ощущения неполного опорожнения, комковатого или твердого стула, ощущения аноректальной обструкции, необходимости ручного вспоможения и приема слабительных. Характер стула оценивается по Бристольской шкале, типы стула которой коррелируют со временем кишечного транзита.
Не рекомендуется проводить инструментальные диагностические тесты пациентам без симптомов или признаков тревоги, к которым относят:
• Жалобы больного:
• на немотивированную потерю массы тела;
• на ночную симптоматику;
• на постоянные интенсивные боли в животе как единственный ведущий симптом поражения желудочно-кишечного тракта (ЖКТ);
• появившиеся в пожилом возрасте.
• Наличие в анамнезе рака толстой кишки у родственников.
• Обнаружение при физикальном обследовании лихорадки.
• Изменения в объективном статусе (гепатомегалия, спленомегалия).
• Изменения в лабораторных показателях:
• кровь в кале;
• лейкоцитоз;
• анемия;
• увеличение СОЭ;
• изменения в биохимии крови.
В то же время рутинный скрининг рака толстой кишки с использованием колоноскопии рекомендуется всем пациентам в возрасте старше 50 лет. Для исключения вторичной природы заболевания пациентам с запором показаны ультразвуковое исследование, оценка функции щитовидной железы, а также исследование кальция и электролитов в сыворотке крови [2, 3].
При длительных запорах, резистентных к лечению, проводят специфические диагностические тесты, к которым относятся:
• Аноректальная манометрия, позволяющая оценивать функцию внутреннего и наружного анального сфинктера, мышц тазового дна и их иннервацию. Это скрининг-тест при расстройствах дефекации.
• Баллонная экспульсия (введение баллончика в прямую кишку, его раздувание и последующая оценка его эвакуации). Простое, недорогое, “прикроватное” исследование по оценке эвакуаторной способности кишки, идентифицирующее диссинергию дефекации.
• Дефекография (введение контрастного вещества в прямую кишку и последующая рентгенологическая оценка процесса дефекации). Обнаруживает структурные аномалии прямой кишки. Характеризуется низкой надежностью и воспроизводимостью, результат зависит от опыта оператора.
• Изучение кишечного транзита методом радионуклидной сцинтиграфии или с помощью рентгеноконтрастных маркеров. Позволяет оценивать скорость движения фекальных масс.
• Беспроводная Motility-капсула (Smart Pill). Измеряет давление, рН и температуру в кишке. Глотают капсулу после еды. Работа приемника данных до 5 дней. Экскретируется с калом через 24–48 часов.
Моторика толстой кишки при запоре
Толстокишечная и аноректальная моторики – это важнейшие процессы, обеспечивающие основные функции толстой кишки, такие как хранение, абсорбция, пропульсия и дефекация. Ее нарушения рассматриваются как основа хронического функционального запора [31].
Моторику толстой кишки человека характеризуют ритмичные фазные, тонические и высокоамплитудные пропульсивные сокращения (гигантские мигрирующие сокращения). Ритмичные фазные и периодические тонические сокращения способствуют сильному перемешиванию содержимого и обеспечивают его слабое дистальное продвижение. Высокоамплитудные пропульсивные сокращения возникают в проксимальной части кишки и распространяются дистально со скоростью приблизительно 1 см/с, с частотой 6–10 раз в день у здорового человека. Достигая прямой кишки, они вызывают акт дефекации.
Нарушение регуляции гигантских мигрирующих сокращений – один из важнейших факторов, определяющих дисмоторику толстой кишки. Среди пациентов с запорами чаще, чем у здоровых лиц, выявляются меньшие скорость и амплитуда пропульсивных сокращений толстой кишки, чаще наблюдается прерывание ее сокращений. При функциональном запоре определяются редкие высокоамплитудные пропульсивные сокращения кишки (2–3 раза в сутки) или их отсутствие. Снижение частоты и амплитуды этих сокращений наблюдается и при СРК с преобладанием запора.
Толстокишечная двигательная активность неравномерна в течение дня. Она минимальна ночью у здоровых людей и повышается после пробуждения. Прием пищи посредством гастроколитического рефлекса вызывает повышение моторной активности толстой кишки, наиболее выраженное после завтрака.
Гигантские моторные сокращения вызывают сильную компрессию стенки кишки, стимулирующую интернейроны, связанные с мотонейронами, вызывающими нисходящее расслабление гладкой мускулатуры кишки, что обеспечивает продвижение кишечного содержимого. Данные сокращения также вызывают расслабление внутреннего анального сфинктера. Сильное давление на стенку толстой кишки создает афферентный импульс, который не достигает болевого порога у здоровых лиц [26]. Данный сложный автономный моторный акт опосредован многими медиаторами, среди которых наибольшее значение имеет серотонин, более 90 % которого в организме локализуется в энтерохромаффинных клетках. Серотонин является главным регулятором функций кишечника: моторики, секреции и чувствительности, реализует свои эффекты через различные типы рецепторов, среди которых выделяют 14 подтипов. 5-HT4-рецепторы играют ключевую роль в моторике кишки, обнаруживаются в клетках гладкой мускулатуры, энтерохромаффинных клетках, миоэнтерических сплетениях и первичных афферентных нейронах кишки. Воздействие на 5-HT4- и другие 5-HT-рецепторы усиливает перистальтику и секрецию посредством влияния на иные нейротрансмиттеры, прямо вовлеченные в моторику кишки (например, ацетилхолин).
Содержимое кишки оказывает давление на ее стенку, в результате чего инициируется выделение серотонина из энтерохромаффинных клеток слизистой оболочки. Действуя на 5-HT4-рецепторы, он активирует чувствительный нейрон, находящийся в подслизистой оболочке. Возбуждение по энтеральной нервной системе распространяется в проксимальном и дистальном от пищевого комка направлениях, вызывая разнонаправленные моторные эффекты. Воздействие на 5-HT4-рецепторы проксимальнее кишечного содержимого приводит к выделению возбуждающих медиаторов (в основном ацетилхолина), которые вызывают сокращение кишки, в то время как дистальнее кишечного болюса в нервно-мышечных синапсах выделяются медиаторы (оксид азота, вазоинтестинальный пептид и др.), расслабляющие стенку кишки. Эти различия в эффектах приводят к координации проксимального сокращения, дистального расслабления гладкой мускулатуры и, соответственно, эффективной перистальтике [8].
Лечение хронического запора
Продуктивное повышение моторной активности толстой кишки, приводящее к устранению ее гипокинезии без тахифилаксии и побочных эффектов, всегда было заветной целью лечения запора. В экспериментах in vitro установлено, что применение 5-HT4-агонистов вызывает перистальтический рефлекс [15]. К сожалению, большинство использующихся в настоящее время лекарственных средств, напрямую действующих на моторику ЖКТ, не удовлетворяет данным требованиям (табл. 1). Представители класса слабительных средств не оказывают прямого влияния на моторную функцию толстой кишки, действуя на местном уровне, опосредованно через ее стенку. Большинство (до 68 %) пациентов не довольны эффективностью слабительных препаратов в улучшении их качества жизни. Не полностью удовлетворены предсказуемостью действия нерецептурных препаратов 71 % пациентов. Проблему запора слабительными средствами 44 % больных полностью решить не удается [16].
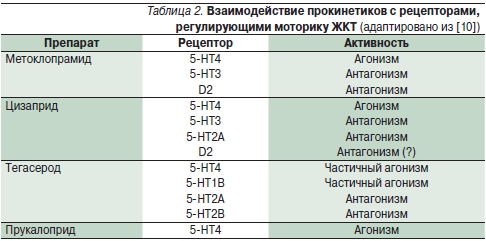
Определенные перспективы лечения запоров связаны с появлением в клинической практике нового кишечного прокинетика/энтерокинетика – прукалоприда (Резолор). Экспериментальные данные и появившийся клинический опыт свидетельствуют о том, что прукалоприд в отличие от метоклопрамида, цизаприда и тегасерода обладает высокой селективностью в отношении активации 5-HT4-рецепторов холинергических нейронов, тем самым обеспечивая минимизацию побочных эффектов (табл. 2). Препарат действует на естественное звено регуляции моторики – 5-HT4-рецепторы, представленные в кишечных нейронах, гладкой мускулатуре, клетках Кахала, энтероцитах и ECL-клетках. Так обеспечивается хороший прокинетический эффект во всех отделах толстой кишки, проявляющийся стимуляцией высокоамплитудных пропульсивных сокращений, усилением перистальтического рефлекса, ускорением проксимального кишечного опорожнения и кишечного транзита.
Клиническая эффективность и безопасность прукалоприда подтверждены тремя крупными рандомизированными контролируемыми исследованиями, включившими 1974 пациента с хроническим запором, проведенными по одному дизайну [4, 5, 21, 27].
В исследованиях участвовали пациенты с длительным анамнезом запора (в среднем 20 лет) и неэффективностью терапии слабительными для большинства из них. Клинически значимый эффект, которым считалось увеличение количества дефекаций на 1 или более в неделю, был достигнут 73 % пациентов [4, 25]. Прием прукалоприда характеризовался более эффективным, чем при приеме плацебо, купированием таких симптомов запора, как натуживание, твердый стул, чувство неполного опорожнения, а также сопутствующих вздутия, абдоминальной боли и дискомфорта.
Известно, что симптомы запора весьма существенно влияют на самочувствие, работоспособность и качество жизни пациентов, которое снижаются при запоре что сопоставимо с такими заболеваниями, как депрессия, сахарный диабет, артериальная гипертензия и бронхиальная астма [20, 32]. Поэтому особенно важно, что оценка влияния препарата на качество жизни по специальному опроснику показала значительное улучшение по сравнению с группой плацебо.
Не было выявлено клинических преимуществ дозы прукалоприда 4 мг перед 2 мг, поэтому максимальная рекомендуемая доза составляет 2 мг.
Поскольку большинство обследованных пациентов (более 85 %) были женщинами, препарат утвержден к применению ими. Хотя это не должно подразумевать, что прукалоприд не эффективен для мужчин.
Доказано, что длительная терапия прукалопридом не теряет своей эффективности. В открытом исследовании, включившем 1455 человек, улучшение сохранялось в течение 18 месяцев терапии прукалопридом [7].
В основных исследованиях наиболее распространенными, связанными с лечением нежелательными явлениями были головная боль, тошнота, боли или спазмы в животе и диарея. В большинстве своем нежелательные явления наблюдались в течение первых 24 часов лечения и были непродолжительными. Чаще всего они были легкой или умеренной степени. Частота серьезных нежелательных явлений была одинаковой для плацебо и прукалоприда [5, 6, 21, 27, 28].
Запор является особой проблемой пожилых людей и встречается у них с частотой до 50 %. Основа высокой распространенности запора у пожилых не изучена полностью, однако существуют доказательства нейродегенерации толстой кишки, ведущей к сниженной моторной функции [19]. Поэтому очень важно и то, что прукалоприд оказался эффективным и безопасным для пожилых пациентов (в возрасте более 65 лет) с хроническим запором [19].
Выводы
Таким образом, хронический запор и СРК с запором – заболевания, отличающиеся патогенезом, особенности которого необходимо учитывать при лечении. Хронический запор – заболевание, проявляющееся не только урежением частоты стула, но и другими симптомами, существенно влияющими на качество жизни пациентов и требующими медикаментозной коррекции.
Ключевое значение в развитии запора имеет нарушение моторной функции кишечника, характеризующееся неэффективным продвижением содержимого по толстой кишке.
Фармакологическое воздействие на 5НТ4-серотониновые рецепторы пациентов с запорами является наиболее физиологическим путем восстановления моторики толстой кишки, сохраняющим суточные ритмы дефекации, инициирующим ее высокоамплитудные пропульсивные сокращения без существенных побочных эффектов, свойственных некоторым энтерокинетикам и слабительным препаратам. Методом такого воздействия является применение прукалоприда. Препарат эффективен при хроническом запоре и обеспечивает новые терапевтические альтернативы пациентам, у которых симптомы запора не были полностью устранены слабительными средствами.



