На сегодняшний день можно без преувеличения сказать, что хронический запор (син.: обстипация, констипация) является важнейшей глобальной медико-социальной проблемой. По статистическим данным, данная патология поражает до четверти всей популяции экономически развитых стран в мире [1, 2]. При этом женщины примерно в 2 раза чаще, чем мужчины, страдают хроническим запором (ХЗ) [2–4]. С возрастом частота заболевания увеличивается, чему способствует малоподвижный образ жизни, а также прием массы лекарств [1, 5]. Немаловажно, что констипация является важным фактором снижения качества жизни пациентов, четко коррелируя с тяжестью клинической симптоматики [6–8]. Кроме того, актуальность проблемы обусловлена экономической составляющей, включающей прямые издержки медицинского характера (обследование и лечение), а также проблемой самолечения [2, 7]. На сегодняшний день доказательная база для большинства широко используемых слабительных препаратов невелика. Поэтому неудивительно, что многие пациенты остаются неудовлетворенными качеством терапии как из-за недостаточной эффективности препаратов, так и в результате развития побочных эффектов [2, 4, 8, 9].
Единого клинически общепринятого определения термина “запор” не существует, к тому же часто понимание сути этого термина пациентами и врачами различно. В определении запора врачи часто используют критерий урежения частоты актов дефекации (например, менее 3 раз в неделю). В то время как пациенты обычно характеризуют запор по наличию ряда симптомов (вздутие, натуживание, твердый стул, ощущение неполного опорожнения и др.) [3, 4, 10].
Согласно Римским критериям III (2006), ХЗ – это функциональное расстройство кишечника, которое проявляется стойкими нарушениями дефекации в виде затрудненного или редкого стула или чувства неполного опорожнения кишечника и которое не соответствует критериям синдрома раздраженного кишечника – СРК [11, 12].
По нашему мнению, в клинической практике целесообразно использовать Римские критерии III, модифицированные Американской коллегией гастроэнтерологов (ACG – The American College of Gastroenterology), которые позволяют более детализированно и объективно подходить к постановке диагноза каждому конкретному пациенту (табл. 1) [13, 14].
В основе патогенеза ХЗ лежит нарушение моторной активности желудочно-кишечного тракта (ЖКТ) в целом и толстой кишки в частности, которое может быть обусловлено полиэтиологическими факторами. Так, моторика ЖКТ, в частности тонус, пропульсивные движения и их координация, могут нарушаться при различных патологиях всех систем человека как структурного, так и функционального характера [2–4, 15, 16].
Таким образом, согласно этиологическим факторам, принято выделять следующие группы ХЗ:
• запоры, обусловленные замедлением кишечного транзита (алиментарный, функциональный запор);
• запоры с нарушениями структуры и функции анального сфинктера и толстой кишки;
• вторичный запор, обусловленный внекишечными заболеваниями;
• запоры, ассоциированные с побочным действием ряда лекарственных средств;
• запоры психогенной этиологии;
• эпизодический обстипационный синдром [3, 15–20].
В основе запоров с медленным кишечным транзитом, как правило, лежат алиментарный фактор (недостаточный прием жидкости, пищевых волокон, избыточный прием чая, алкоголя) или особенности поведения пациента (привычное подавление позывов к дефекации, гиподинамия). При этом не стоит забывать, что к супрессии кишечного транзита могут приводить прием ряда лекарственных средств и сопутствующая патология эндокринологического профиля [3, 15, 16].
Нарушения структуры и функции анального сфинктера и толстой кишки, приводящие к запорам, обусловлены такими патологическими состояниями, как анальная невралгия (в результате операций на заднем проходе или после травм, при повреждении срамного нерва), заболевания аноректальной зоны (стриктуры, пролапс слизистой оболочки, трещины, ректоцеле), аганглиоз (болезнь Гиршпрунга, болезнь Чагаса), геморрой и др. Отдельно выделяют состояния, вызывающие органическую или функциональную обструкцию: вне- и внутрипросветные опухоли, инвагинации, дивертикулы кишки, инородные тела, эндометриоз, воспалительные заболевания толстой кишки, хронический амебиаз, венерические лимфогранулемы, туберкулез, псевдообструкция толстой кишки (синдром Огильви), идиопатический мегаколон и мегаректум. Выделяются и ректоперинеальная обстипация, в основе которой лежит патология мышц тазового дна женщин, а также функциональные расстройства дефекации: диссинергическая дефекация и неадекватная дефекационная пропульсия [15–18].
Отдельно выделяют запоры, обусловленные внекишечными заболеваниями (вторичный обстипационный синдром), которые, как правило, в клинической практике ассоциированы с серьезными диагностическими ошибками. К этой группе относятся сердечная недостаточность, гипокалиемия, гиперкальциемия, гипо- и гипермагниемия, гипотиреоз, сахарный диабет, ожирение, беременность, климактерические изменения, уремия, феохромоцитома, глюкагонома, порфирия; склеродермия, висцеровисцеральные рефлекторные, атонические запоры при остром холецистите, панкреатите, аппендиците, язвенной болезни, хроническом дуодените, дуоденостазах различной этиологии, холестатических состояниях. К той же группе относят болезни центральной нервной системы: детский церебральный паралич, рассеянный склероз, спинную сухотку, опухоли, болезнь Паркинсона, нарушение мозгового кровообращения, болезнь Альцгеймера; болезни периферической нервной системы: синдром поражения конского хвоста, срамного нерва [15, 16, 20].
Актуальной проблемой являются запоры, связанные с побочным действием ряда лекарственных средств, что безусловно продиктовано нерациональным использованием таковых в совокупности с низкой медицинской образованностью граждан. К препаратам, способствующим развитию запора, относят антихолинергические/спазмолитические препараты, наркотические анальгетики, антидепрессанты, противосудорожные средства, антипаркинсонические и антигистаминные препараты, нестероидные противовоспалительные средства, антигипертензивные препараты (особенно блокаторы кальциевых каналов), диуретики, препараты, содержащие висмут, железо, углекислый кальций, гидроокись алюминия, ганглиоблокаторы, опиаты [4, 15, 16, 18].
Причиной хронического обстипационного синдрома могут быть явления психологической природы (психогенный запор). Чаще всего это ипохондрические и депрессивные состояния, шизофрения и др. [15, 21]. Отдельно можно выделить и эпизодический обстипационный синдром при беременности, длительном постельном режиме и т. н. запор путешественников, обусловленный изменением условий быта, характера пищи, дискомфортными условиями дефекации [16, 22].
Современный диагностический алгоритм ХЗ складывается из нескольких этапов. На первом этапе необходимо идентифицировать признаки запора, согласно критериям Рим III, модифицированным ACG, рассмотренные выше [13, 14].
При расспросе пациента для объективизации консистенции и формы кала практикующему врачу целесообразно пользоваться бристольской шкалой стула (рис. 1). При запоре процентное содержание воды в кале снижается и составляет менее 60 %, что обусловливает изменение формы, характерное для 1–2-го типов, в то время как нормальному стулу соответствует 3–4-й [23, 24].

Следующим этапом является диагностика СРК, ассоциированного с запором (СРК-З), а также выявление т. н. симптомов красных флагов, указывающих на наличие органической, в частности опухолевой, патологии [1, 4, 25]. Основным критерием дифференциальной диагностики ХЗ с СРК-З является наличие болевого абдоминального синдрома, достаточно специфичного для СРК [3, 4]. Однако не стоит забывать, что болевой абдоминальный синдром может наблюдаться и при органической патологии, способствующей развитию запора [4, 19, 20, 26].
Для их выявления предложен скрининг на “красные флаги”, такие как:
• гематохезис (наличие неизмененной крови в стуле);
• анемия;
• лихорадка;
• анорексия;
• потеря массы тела;
• появление симптомов в возрасте старше 50 лет;
• усиление запоров в возрасте старше 50 лет;
• патологические изменения объективного статуса, лабораторных показателей, инструментальных исследований;
• положительный тест на скрытую кровь;
• колоректальный рак и рак другой локализации у родственников;
• воспалительные заболевания кишечника у родственников;
• целиакия у родственников [3, 4, 19, 20, 25–27].
Отсутствие всех вышеперечисленных симптомов “красных флагов” должно позиционировать врача на дальнейший диагностический поиск для идентификации генеза ХЗ. Так, для исключения вторичного генеза обстипационного синдрома целесообразно проведение тщательного лабораторно-инструментального исследования: клинического и биохимического анализов крови, мочи, копрологического исследования или анализа кала на скрытую кровь, пальцевого исследования прямой кишки, ректороманоскопии, колоноскопии; полипозиционной ирригоскопии с двойным контрастированием [4, 25, 28]. В случае выявления вторичного генеза ХЗ помимо симптоматической терапии лечение должно быть направлено на разрешение основного заболевания, при этом нередко необходимы консультации с узкоспециализированными специалистами для выбора адекватной тактики лечения. Так, при функциональном запоре у лиц с психоневрологическими расстройствами по рекомендации психотерапевта возможно применение антидепрессантов. При обстипации, сочетающейся с патологией билиарной системы, хороший эффект приносит применение комбинации прокинетиков с желчегонными средствами или препаратами, содержащими урсодезоксихолевую кислоту.
В случае отсутствия вторичных причин обстипационного синдрома необходимо начинать эмпирическую терапию. Пациентам рекомендуют изменить отношение к своему здоровью: в первую очередь целесообразно начать с изменения характера питания, образа жизни, увеличения физических нагрузок; следует рекомендовать упражнения на укрепление мышц тазового и брюшного пресса, “тренировку туалета”, отказ от систематического употребления слабительных раздражающего характера и клизм; важен также психологический комфорт во время дефекации.
Рекомендуется увеличить потребление жидкости до 1,5–2,0 литров в сутки и доли в рационе питания пищевых продуктов, содержащих большое количество пищевых волокон. В том случае если в ответ на вышеперечисленные меры, удается устранить весь комплекс симптомов запора, никакие дальнейшие действия могут не потребоваться. Тем не менее крайне важно, чтобы пациент объективно контролировал симптоматику и динамику эффективности текущего лечения. При недостаточной эффективности или сложности соблюдения диеты и приема средств, увеличивающих объем кишечного содержимого, возможен переход к пребиотикам и одновременно к средствам, повышающим осмотическое давление, – препаратам лактулозы. В случае преобладания затрудненной дефекации возможно использование суппозиториев с глицерином [1, 3, 4, 15, 19, 27, 29].
Если несмотря на вышеперечисленные терапевтические меры, симптомы запора сохраняются, необходимо проводить переоценку жалоб пациента, а также дополнительную консультацию специалистов с использованием дополнительных методов исследования: радиоизотопного исследования времени кишечного транзита, сфинктероманомерии, анометрии, теста на эвакуацию баллона, дефекографии, электромиографии мышц тазового дна [4, 25]. Смена терапевтической тактики с назначением полиэтиленгликоля, стимулирующих слабительных или комбинированных препаратов, может быть оправданна, однако должна базироваться на индивидуальном подходе к пациенту и в ряде случаев бывает невозможной [27]. При выявлении функциональной аноректальной обструкции рекомендуется использование метода biofeedback-терапии в специализированных проктологических отделениях.
Актуальным, как и говорилось выше, является недостаточный эффект терапии ХЗ и, соответственно, множество пациентов, неудовлетворенных терапией слабительными препаратами [2, 4, 8, 9]. Так, в США, по данным проведенного интернет-опроса, 47 % больных не устраивает проведенная терапия не только из-за недостаточной ее эффективности (82 %) и развития побочных эффектов (16 %), но и по причине отсутствия предсказуемости действия слабительных ( до 80 %) и их неспособности устранить комплекс симптомов (до 66 %) [8]. В европейской популяции, по данным J. Tack и соавт. (2009), лишь 27 % пациентов удовлетворены существующей терапией [9]. Безусловно, такие данные нельзя назвать соответствующим параметрам медицины XXI в., когда для лекарственных средств выдвигаются требования не только высокой эффективности с минимальным риском развития побочных эффектов, но и наличия достаточной доказательной базы. Поэтому фармакотерапия ХЗ постоянно совершенствуется. В настоящий момент большой интерес представляют препараты, принципиально отличные от существующих классов слабительных, оказывающие влияние на серотонинергическую систему регуляции моторики толстой кишки.
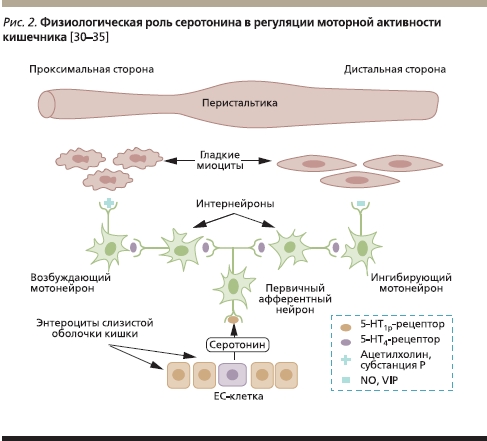
Роль серотонина в регуляции моторики ЖКТ, в частности кишечника, достаточно давно является поводом для широких исследований в области физиологии. Многие авторы признают серотонин главным регулятором моторики, секреции и чувствительности кишечника [10]. На сегодняшний день известно, что более 80 % серотонина синтезируется энтерохромаффинными (ЕС) клетками слизистой оболочки кишечника. В ответ на внешние стимулы, такие как растяжение кишки, стимуляция элементами пищи, ЕС-клетки высвобождают серотонин. Молекулы серотонина активируют 5-НТ1р-рецепторы, локализующиеся в первичных афферентных нейронах подслизистого слоя, вызывая дальнейшую цепную реакцию с передачей импульса на возбуждающие холинергические и ингибирующие мотонейроны. Передача импульса опосредуется активацией 5-НТ4-рецепторов на интер- и мотонейронах. Возбуждающие мотонейроны в ответ на активацию высвобождают ацетилхолин и субстанцию Р, которые инициируют сокращение гладких миоцитов, а ингибирующие мотонейроны вырабатывают оксид азота (NO) и вазоактивный интестинальный пептид (VIP), инициируя процесс их расслабления. Таким образом, конечным результатом этих взаимодействий является релаксация гладких мышц дистальнее места воздействия с их одновременным сокращением проксимальнее его (рис. 2) [30–35].
Именно эта физиологическая концепция в конце 1980-х гг. и легла в основу разработки принципиально нового класса препаратов, усиливающих моторику ЖКТ, – агонистов серотониновых 5-НТ4-рецепторов. Первые представители агонистов серотониновых 5-НТ4-рецепторов (цизаприд, тегасерод) показали свою достаточную эффективность для пациентов с ХЗ. Однако их широкое внедрение в клиническую практику ограничивала возможность развития неблагоприятных побочных эффектов со стороны сердечно-сосудистой системы [2, 30, 36, 37].
Прукалоприд (Резолор; Янссен-Силаг С.п.А., Италия) представляет собой передовую генерацию агонистов серотониновых 5-НТ4-рецепторов. Это продиктовано более высокой (минимум в 150 раз) аффинностью именно к 5-НТ4-рецептору по сравнению с предыдущими поколениями препаратов данного класса [38]. Как известно, серотониновые 5-НТ4-рецепторы являются звеном естественной регуляции моторики кишечника. Прукалоприд при применении в терапевтических дозировках не взаимодействует с другими субклассами серотониновых рецепторов, а также с hERG-калиевыми каналами, что выгодно отличает его от цизаприда и тегасерода (табл. 2) [2, 36, 37].
В трех крупных клинических исследованиях в результате 12-недельного курса лечения прукалопридом в дозе 2 мг/сут значительно больше пациентов достигли первичной конечной точки (минимум трех произвольных удовлетворительных дефекаций в неделю) и значимого увеличения числа произвольных дефекаций в неделю по сравнению с плацебо. Так, клинически значимого эффекта достигли 73 % пациентов, у которых было отмечено увеличение на одну и более произвольную дефекацию в неделю, а 23,6 % пациентов достигли нормализации частоты стула (3 и более произвольных удовлетворительных актов дефекации в неделю) [46]. При этом превалирующее число пациентов составляли женщины (86,6–90,8 %). Пациенты с вторичным генезом страдания исключались из данных исследований [40–42].
Для правильного понимания показателей эффективности терапии препаратом важно учитывать характеристику пациентов, включенных в исследование [48]. Средняя продолжительность анамнеза запора у них составляла 20 лет. При этом 83 % пациентов сочли предшествующую терапию недостаточно эффективной, а у 57 % больных во время вводного периода (2 недели) не было произвольного полного акта дефекации. Кроме того, в этих исследованиях оценивалось влияние прукалоприда на ассоциированные с запором симптомы: вздутие живота, абдоминальные дискомфорт и боль, спазмы, чувство неполного опорожнения, твердый стул, натуживание. Препарат демонстрировал достоверно значимый эффект в устранении комплекса симптомов у пациентов с хроническим запором [49].
В терапевтических дозах прукалоприд имеет низкий потенциал межлекарственных взаимодействий в связи с отсутствием ингибирования значимых изоферментов системы цитохрома P450, а также низким уровнем связывания с белками плазмы крови [37, 43].
Прукалоприд, как правило, хорошо переносился больными. Наиболее частыми (более 10 %) побочными эффектами были головная боль, тошнота, боли в животе и диарея. Причем большинство побочных эффектов были транзиторными, возникали в основном в первый день применения и не требовали отмены препарата. Так, без учета первого дня, переносимость прукалоприда была сравнимой с плацебо [47]. Прекращение лечения из-за нежелательных явлений составило 5,9 % в группе прукалоприда 2 мг и 3,6 % в группе плацебо [37, 40–42, 47].
Было установлено, что препарат не вызывает синдром “рикошета” при отмене и не теряет эффективности при применении после перерыва [49].
На сегодняшний день прукалоприд зарегистрирован в России для симптоматической терапии ХЗ у женщин, у которых слабительные препараты не оказывают достаточного эффекта в устранении симптомов. Препарат принимают внутрь независимо от приема пищи в любое время суток. Время до дефекации после первого приема прукалоприда составляет в среднем 2,5 часа. В дальнейшем на фоне приема вырабатывается определенный ритм произвольных дефекаций в неделю в зависимости от тяжести состояния пациента [52]. Рекомендуемая доза для взрослых составляет 2 мг 1 раз/сут, для лиц старше 65 лет терапию следует начинать с 1 мг 1 раз/сут с возможной перспективой увеличения дозы до 2 мг [37, 45]. Препарат предназначен для постоянного, а не курсового приема. Имеются данные о длительном применении прукалоприда (до 2 лет), что сопровождалось хорошей переносимостью и стабильным повышением показателей качества жизни пациентов, страдающих запором [51].
В настоящее время прукалоприд уже входит в рекомендации Всемирной гастроэнтерологической организации по лечению запора, в схемы лечения запора гастроэнтерологов Европы и Канады и одобрен Национальным институтом клинического мастерства (NICE – National Institute for Health and Clinical Excellence) Великобритании [53–56].
Таким образом, современные подходы к алгоритмам диагностики и лечения ХЗ имеют четкую этапность и последовательность. Наиболее важной задачей на этапе обследования пациента является исключение органической патологии, дифференциальная диагностика СРК-З и вторичного генеза страдания, что обусловливает дальнейший адекватный выбор терапевтической тактики. При этом последующее включение фармакологических средств должно быть последовательным и показано в случае неэффективности коррекции образа жизни. Появление в арсенале лекарственных средств нового передового представителя группы агонистов серотониновых 5-НТ4-рецепторов – прукалоприда, обладающего более высоким профилем безопасности по сравнению с предыдущими поколениями этого класса препаратов, значительно расширяет терапевтический потенциал практикующего врача в рамках рассматриваемой патологии.



