Вопросы рациональной терапии хронического запора (ХЗ) безусловно затрагивают одни из самых актуальных тем в современной гастроэнтерологии. Ведь от своевременного и адекватного лечения пациента зависит качество жизни больного – важный интегральный и независимый показатель высокой эффективности терапии.
Актуальность вопроса подчеркивается статистическими данными, свидетельствующими, что ХЗ поражает до четверти всей популяции экономически развитых стран в мире [1, 2]. При этом женщины примерно в два раза чаще, чем мужчины, страдают данной патологией [2, 3]. С возрастом частота заболевания увеличивается, чему способствует малоподвижный образ жизни, а также прием большего количества лекарств [1, 4]. Среди причин, приводящих пациентов к врачу общей практики, гастроэнтерологу и проктологу, ХЗ остается на одном из первых мест, уступая лишь геморрою [5].
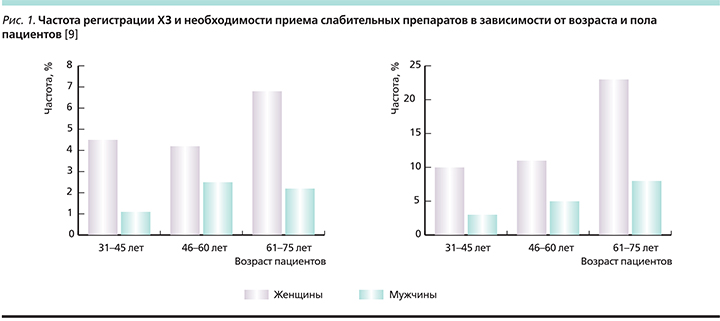
Стоит отметить, что если раньше считалось, что ХЗ страдают преимущественно пожилые люди, то в настоящее время число молодых пациентов, в т.ч. детей раннего возраста, значительно возросло и имеет дальнейшую тенденцию к росту [6, 7]. Вместе с тем после 65 лет частота регистрации ХЗ заметно увеличивается, достигая среди населения старше 70 лет 10–12% [8]. Эти данные согласуются с результатами популяционного исследования, проведенного шведскими врачами (рис. 1) [9].
Вместе с тем из-за деликатности патологии больные могут долго не обращаться за медицинской помощью, запускают болезнь, злоупотребляют клизмами, слабительными средствами, принимая их без совета врача, борются подчас не с причиной, а со следствием той или иной скрыто протекающей патологии, вызывающей синдром запора. В связи с этим очень важной стороной столь распространенной патологии является массовый неконтролируемый прием слабительных средств, подчас даже людьми, не имеющими на то достаточных оснований. Подтверждением тому служат большие затраты населения развитых стран на слабительные препараты с тенденцией к увеличению данного показателя [10].
Однако стоит понимать, что такая нерациональная терапия запора может не только вызывать тяжелые осложнения, в т.ч. и т.н. лаксативную болезнь – синдром, характеризующийся как местными (кишечными расстройствами), так и общими, связанными с нарушением водного, электролитного и витаминного балансов [11, 12]. При этом безусловно главной причиной развития лаксативной болезни остается злоупотребление слабительными препаратами, причем не всегда в целях разрешения ХЗ. Стоит отметить, что большинство случаев лаксатвиной болезни связано с применением группы стимулирующих слабительных средств группы антрагликозидов [12, 13].
В целом в популяции можно выделить четыре категории лиц, злоупотребляющих слабительными средствами [13]. Первую группу составляют пациенты с расстройствами пищевого поведения (нервная булимия и нервная анорексия) – это наиболее большая группа лиц, злоупотребляющих слабительными препаратами [13, 14]. Часть больных данной категории изначально начинают принимать слабительные средства с целью разрешить возникший у них синдром ХЗ, в частности пациенты с нервной анорексией, которые из-за низкого потребления пищи и обезвоживания часто имеют проблемы в виде запоров [15]. Однако большинство пациентов с расстройствами пищевого поведения принимают слабительные средства, чтобы целенаправленно вызвать диарею, мотивируя это попыткой избавиться от «ненужных» калорий и тем самым снизить массу тела [16].
Вторую группу составляют лица среднего и пожилого возраста, которые целенаправленно продолжают длительный прием слабительных средств после разрешения запора. Как правило, это пациенты, впервые «столкнувшиеся» с запором, у которых возникает страх перед повторным возникновением симптоматики, за счет чего они пытаются профилактировать запор продолжительным курсом терапии слабительными. При этом многие пациенты этой группы требуют не терапии слабительными, а лишь корректировки образа жизни, питания, отмены приема препаратов, вызывающих запор [13, 17].
В третью группу входят спортсмены, принимающие слабительные в рамках поддержания массы тела в регламентированных для их вида спорта пределах, в частности лица, занимающиеся боевыми видами спорта [13, 18].
И наконец, четвертую группу представляют лица, скрыто злоупотребляющие слабительными средствами, провоцируя т.н. искусственно вызванную диарею. Как правило, эти лица специально имитируют заболевание [19, 20].
Исследования по выявлению истинной распространенности лаксативной болезни крайне затруднительны ввиду полиморфности клинической картины и низкой осведомленности специалистов. В целом в общей популяции злоупотребление слабительными средствами достигает 4,18% [21]. При этом наиболее высокий процент злоупотребления (10–60%) отмечается у лиц с расстройствами пищевого поведения [13, 22]. Практически 90% лиц, злоупотребляющих слабительными средствами, женщины [12]. У мужчин описываются лишь редкие случаи подобного злоупотребления.
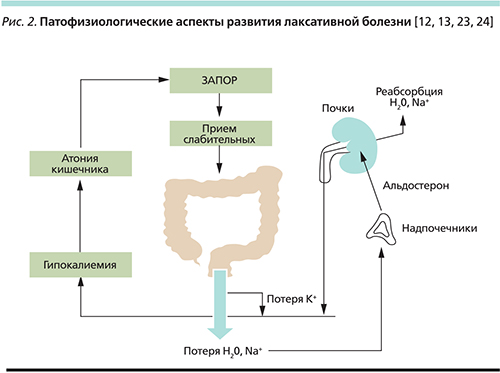
Клиническая картина лаксативной болезни опосредуется рядом патофизиологических компонентов, вызывающих образование «порочного» круга (рис. 2). В результате приема слабительных средств нарушается транспорт воды и электролитов по кишечнику и начинается хроническая диарея, сопровождающаяся увеличением потерь воды, натрия и калия с калом. В целях компенсации потерь воды и натрия организм стимулирует секрецию альдостерона корой надпочечников. Одними из главных органов-мишеней данного гормона являются почки, где альдостерон вызывает усиленную реабсорбцию натрия в дистальных канальцах с его задержкой в организме и, соответственно, задержкой воды. Помимо этого альдостерон опосредует повышение экскреции калия с мочой, усугубляя гипокалиемию, вызванную диареей. Гипокалиемия проявляется нарушением сигнальной трансдукции по нервно-мышечным волокнам, что приводит к атонии кишечника («инертной кишке»). Пациент опять сталкивается с запором и принимает слабительное – «порочный» круг замыкается [12, 13, 23, 24].
Стоит отметить, что персистирующая гипокалиемия может вызывать повреждение почечных канальцев с потерей концентрационной способности почек. Это в свою очередь может приводить к еще более значительному выведению калия с мочой [25, 26].

Все клинические симптомокомплексы лаксативной болезни складываются из перечисленных механизмов патогенеза. Более четверти пациентов испытывают клинические признаки дисбаланса обменных процессов (гипокалиемия, гипонатриемия, повышение уровня альдостерона, нарушение функции почек) [12]. К основным симптомам относятся диарея, тошнота, рвота и боли в животе неопределенного характера (боли могут носить как постоянный характер, так и в виде колик и часто сопровождаются урчанием в кишечнике) [11]. Длительное нарушение процессов обмена веществ приводит к развитию анорексии, снижению массы тела. Также у пациентов могут отмечаться вздутие живота, анальный зуд, неприятный запах изо рта. К серьезным последствиям гипокалиемии относятся чувство жажды, мышечная слабость (при гипокалиемическом алкалозе), полиурия, паралитическая кишечная непроходимость, почечная тубулярная недостаточность и др. [12, 13, 27]. Вышеперечисленные клинические признаки лаксативной болезни суммированы в табл. 1.
При обследовании пациента определенное значение имеют анамнестические данные. Часто в анамнезе заболевания имеются указания на застарелый запор, берущий начало еще в юношеские годы. Однако надо помнить, что бóльшая часть пациентов старательно скрывают свое пристрастие к слабительным, поэтому, как правило, необходим более ориентированный сбор анамнеза [13].
При рентгенологическом исследовании кишечника с бариевой взвесью у 10–20% пациентов может обнаруживаться т.н. катартическая кишка (colon cathartic) [12]. Чаще всего это признак достаточно длительного хронического злоупотребления слабительными препаратами. Данный рентгенологический феномен характеризуется исчезновением гаустраций в сочетании с изменениями структуры слизистой оболочки с участками псевдостриктур в восходящей ободочной кишке. На более поздних стадиях эти изменения распространяются на всю толстую кишку. В подвздошной кишке может нарушаться гаустральный рельеф, стенки становятся гладкими, илеоцекальный сфинктер открыт. На последней стадии преобладает сужение в сочетании с резким укорочением кишки, что в ряде случаев требует дифференциальной диагностики с язвенным колитом [12, 28, 29].
При эндоскопическом исследовании у 70% пациентов, злоупотребляющих слабительными препаратами группы антрагликозидов, может обнаруживаться псевдомеланоз толстой кишки (pseudomelanosis coli) – обратимая буро-черная пигментация (дисколорация) слизистой оболочки толстой кишки (рис. 3) [12, 30]. Этот процесс регрессирует через 4–12 месяцев после отмены приема вышеназванных медикаментов [31, 32].
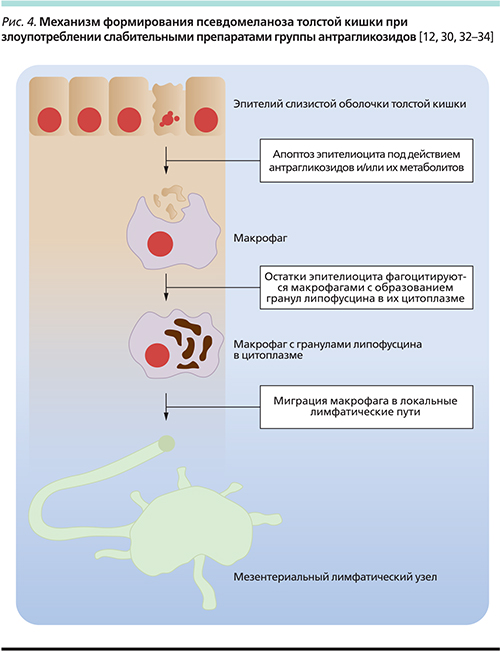
Механизм формирования псевдомеланоза и роли антрагликозидов в нем до сих пор остается темой для дискуссий. По наиболее распространенной гипотезе антрагликозиды и/или их метаболиты оказывают повреждающее действие на органеллы эпителиоцитов слизистой оболочки толстой кишки. Эпителиоциты гибнут или подвергаются апоптозу. Клеточные «останки» фагоцитируются макрофагами собственной пластинки слизистой оболочки толстой кишки с образованием в их цитоплазме гранул липофусцина – коричневого пигмента, содержащего липидные продукты лизосомного переваривания (рис. 4). Впоследствии макрофаги мигрируют в локальные лимфатические пути, что и обусловливает обратимость псевдомеланоза толстой кишки после отмены антрагликозидов [30–35].
Сегодня предложены некоторые методы лабораторной диагностики в целях верификации лаксативной болезни. Так, выявление гипокалиемии в сыворотке крови может играть основополагающую роль при постановке диагноза, особенно для пациентов с расстройствами пищевого поведения, отрицающих злоупотребление слабительными средствами [36].
Возможно, проведение электролитного анализа кала, включающего анализ осмолярности, электролитного состава, уровня рН с расчетом осмотического «провала». Осмолярность кала определяется по следующей формуле: 2×(Na++K+). Осмотический «провал» рассчитывается путем измерения разницы между полученной осмолярностью кала и нормальной осмолярностью кала (290–300 мОсм/кг) [13, 37]. У пациентов, злоупотребляющих стимулирующими слабительными препаратами (бисакодил, препараты сенны и каскары), осмотический «провал» обычно менее 30–40 мОсм/кг [38].
Рациональная терапия ХЗ безусловно должна начинаться с корректной постановки диагноза. В настоящее время совершенно очевидно, что один только факт отсутствия ежедневной дефекации не может быть основанием для постановки диагноза запора и назначения слабительных средств, т.к. только у 2/3 лиц, проживающих в районах с умеренным климатом, наблюдается ежедневное опорожнение кишечника [3]. По нашему мнению, в клинической практике для корректной постановки диагноза «хронический запор» целесообразно использовать Римские критерии-IV (2016), которые позволяют детализированно и объективно подходить к постановке диагноза каждому конкретному пациенту (табл. 2) [39, 40].

Терапевтические подходы к лечению ХЗ должны быть стадийными. Пациентам рекомендуют изменить отношение к своему здоровью, в первую очередь целесообразно начать с изменения характера питания, образа жизни, увеличения физических нагрузок, следует рекомендовать упражнения на укрепление мышц тазового и брюшного прессов, «тренировка туалета», отказ от систематического употребления слабительных средств раздражающего характера и клизм, также важно иметь психологический комфорт в туалете. Рекомендуется увеличение потребления жидкости до 1,5–2,0 литров в сутки и увеличение в рационе питания пищевых продуктов, содержащих большое количество пищевых волокон. В том случае, если у пациентов имеется хороший терапевтический ответ на вышеперечисленные меры, никакие дальнейшие действия могут не потребоваться. Тем не менее крайне важно, чтобы пациент объективно контролировал симптоматику и динамику эффективности текущего лечения. При недостаточной эффективности диеты необходимо назначение средств, увеличивающих объем кишечного содержимого за счет пищевых волокон (псиллиум, мукофальк), или переход к пребиотикам и одновременно средствам, повышающим осмотическое давление, – препаратам лактулозы [4, 5, 41–44].
Развитие лаксативной болезни требует комплексного подхода к терапии пациента. Необходимо изменить отношение пациента к слабительным средствам. Зачастую больные нуждаются в помощи психотерапевта, позволяющего убедить пациента в том, что наибольшая опасность проистекает от приема слабительных, а не от запора [12, 13].
Для восстановления нормальной функции кишечника необходимы базовые мероприятия по изменению образа жизни и характера питания, описанные выше.
Отдельным этапом необходима своевременная и адекватная диагностика и коррекция электролитных нарушений, ввиду того что К+ и Na+ служат константой жесткой регуляции. Невосполнение электролитных нарушений будет способствовать сохранению или прогрессированию клинической симптоматики [11–13].

Большому числу пациентов необходимо временно продолжить лечение слабительными препаратами из-за существующей психологической зависимости и сохраняющихся признаков толстокишечной интоксикации, а также в случае приема препаратов, способствующих развитию запора (нейролептики, антидепрессанты). На этом этапе необходимо подобрать альтернативный препарат для лечения ХЗ, обеспечив постепенный переход на него. Естественно, предпочтение должно отдаваться препаратам с хорошей доказательной базой и безопасностью, в частности лактулозе [12].
Механизм действия лактулозы основан на ее распаде под влиянием лактатпродуцирующих бактерий толстой кишки на органические кислоты, обладающие низкой молекулярной массой (молочную, уксусную, масляную и пропионовую). В результате возникает, с одной стороны, подкисление содержимого кишечника, с другой – повышение осмотического давления в толстой кишке, задержка воды и увеличение объема содержимого.
Применение лактулозы основано на том, что в норме на главные физиологические механизмы, которые обеспечивают деятельность желудочно-кишечного тракта, его моторную активность, влияет не только характер принимаемой пищи. Большое значение в поддержании кишечного транзита имеют вещества, образующиеся в процессе пищеварения (пищевые волокна, жиры, желчные кислоты, вещества, образующиеся в результате ферментации, газы), а также состояние бактериальной флоры толстой кишки – соотношение между амилолитической и протеолитической микрофлорой, рН среды.
На сегодняшний день известно, что амилолитическая (сахаролитическая) кишечная микрофлора (бифидо- и лактобактерии, Streptococcus faecalis и др.), гидролизирующие неперевариваемые в тонкой кишке углеводы (полисахариды пищевых волокон, резистентные формы крахмала, неперевариваемые олигосахариды и др.), играет значительную положительную роль в осуществлении транзита кишечного содержимого. Это достигается за счет образования в процессе микробной ферментации амилолитической флорой невсасываемых пищевых субстратов, короткоцепочечных карбоновых кислот алифатического ряда. Данные кислоты обладают уникальным многокомпонентным действием:
а) снижают рН содержимого толстой кишки (в т.ч. угнетая протеолитическую микрофлору, защелачивающую кишечный субстрат), что стимулирует кишечную моторику;
б) увеличивают объем за счет повышения осмотического давления (в 4 раза) и задержки жидкости в содержимом кишки (само по себе присутствие в кале воды на уровне 50% и более обеспечивает беспрепятственное его продвижение по кишечнику);
в) обеспечивают эпителий толстой кишки энергией для функционирования и регенерации.
Лактулоза, являясь средством, обладающим умеренным осмотическим действием, ограничивающим всасывание воды в толстой кишке, увеличивает объем кишечного содержимого. Одновременно лактулоза благоприятно влияет на микрофлору в качестве пребиотика – средства, обладающего действием подобно неперевариваемым ингредиентам пищи, избирательно стимулирующим рост и метаболическую активность амилолитической микрофлоры толстой кишки. Протеолитическая флора, соответственно, угнетается. Увеличение биомассы бактерий также способствует росту объема содержимого кишки и стимуляции перистальтики.
Особо ценно то, что применение лактулозы безопасно для поддержания нормального стула на длительный срок. Важно, что применение препарата лактулозы возможно в отношении грудных детей с первых дней жизни, а также беременных и кормящих женщин.
Если пациент длительно принимал стимулянтные слабительные и у него присутствуют признаки развития лаксативной болезни, одним из вариантов выведения больного из данного патологического состояния является схема, предложенная G. Creytens (табл. 3) и успешно апробированная на 50 больных, длительно злоупотреблявших стимулянтными слабительными. Схема предполагает поэтапную отмену стимулянтного слабительного и перевод пациента на препарат лактулозы. Все лечение предложено разбить на четыре периода, каждый продолжительностью 2 недели. В течение первого периода пациенты принимают слабительные препараты, которые ранее использовались больными без каких-либо изменений терапии. В течение второго периода половина дозы обычного препарата заменяется на 30 мл лактулозы. В течение третьего периода обычные слабительные средства полностью заменяются на 60 мл лактулозы, и в течение четвертого периода доза лактулозы снижается вдвое – до 30 мл [12].
Анализ результатов лечения ХЗ по предложенной схеме продемонстрировал хороший эффект. Так, к концу четвертого этапа лечения частота стула за 14 дней составила 9,8 раза (1 раз в 1,4 дня или 4,8 раза в неделю), что с медицинской точки зрения является вполне удовлетворительным показателем, при этом оформленный стул отмечен у 75,8% пациентов. Полностью был купирован абдоминальный болевой синдром, в 70% случаев купирована спастичность толстой кишки, полностью исчезла отечность и значительно уменьшилось слизеобразование, у 40% обследованных пациентов улучшилась функция почек, у всех больных нормализовался уровень калия в плазме, увеличилась масса тела. Возврата к прежним препаратам не наблюдалось [12].
Таким образом, проблема лаксативной болезни во многом определяется массовым неконтролируемым приемом слабительных препаратов, что в свою очередь опосредуется низкой медицинской грамотностью населения, обширным доступом безрецептурных слабительных препаратов в аптеках и высокой маркетинговой активностью фармакологических компаний в этом сегменте рынка. Информированность специалистов о клинических, биохимических, рентгенологических, эндоскопических и патологоанатомических характеристиках лаксативной болезни может способствовать ее более ранней диагностике и, следовательно, своевременному и адекватному лечению.



