Сахарный диабет (СД) представляет собой серьезную медико-социальную проблему для большинства стран мира, актуальность которой определяют “эпидемический” масштаб распространения,
нередко неудовлетворительный контроль заболевания, высокая частота поздних осложнений и как следствие – инвалидизация и снижение качества жизни пациентов, значительные экономические затраты. Однако развитие научно-технического прогресса, лечебно-диагностических возможно-
стей, фарминдустрии на современном этапе позволяет минимизировать вероятность неблагоприятных исходов, обеспечить стойкое достижение терапевтических целей и высокое качество жизни пациентов. Данные большинства современных клинических исследований убедительно демонстрируют
важность достижения долгосрочной компенсации углеводного обмена у пациентов с СД [1, 2]. Именно поддержание клинико-метаболических показателей, максимально приближенных к нормальным значениям, является основой профилактики развития поздних осложнений СД как макро-, так и
микрососудистых.
Сегодня мало у кого вызывает сомнения тот факт, что без активного участия в лечебном процессе самого пациента стойкая компенсация углеводного обмена практически невозможна. В связи с этим возникает потребность в обучении пациентов основным принципам приема и изменения доз сахароснижающих препаратов, принятию грамотных терапевтических решений по коррекции образа жизни, плана питания, режима физических нагрузок – другими словами, самостоятельному успешному управлению своим заболеванием. С учетом хронического и неизлечимого характера СД можно смело говорить о необходимости пожизненного терапевтического обучения больных как важнейшего интегрального подхода в комплексном лечении нарушений углеводного обмена. Но, даже несмотря
на сложившуюся организационную и методологическую структуру, доказанную клинико-экономическую выгоду, структурированные обучающие про-граммы имеют ограниченную эффективность [3–7]. Пациенты, прошедшие курс обучения, могут не усвоить весь теоретический материал, не суметь “индивидуализировать” и применить полученные навыки и знания, не следовать рекомендациям врача вследствие недостаточного уровня мотивации, самодисциплины и самоорганизации. Таким образом, сегодня мы нуждаемся в разработке, внедрении и оценке эффективности и содержания новых форм структурированных обучающих программ с целью повышения качества оказываемой диабетологической помощи, достижения стойкой и длительной
компенсации обменных процессов, нарушенных при СД.
Другим не менее важным вопросом современной диабетологии остается разработка и внедрение в клиническую практику эффективных и безопасных методов лечения. Одним из перспективных с этой точки зрения направлений является помповая инсулинотерапия, которую, по мнению боль-
шинства специалистов в этой области, можно считать наиболее физиологичным способом “доставки” инсулина в организм, максимально имитирующим работу здоровой поджелудочной железы человека. На сегодняшний день уже существует немало данных, подтверждающих клинико-экономическую
эффективность применения дозаторов инсулина [8–12].
Однако, несмотря на очевидные преимущества этого вида терапии, внедрение его в клиническую практику встречает ряд трудностей. Дозатор инсулина (помпа, насос) – это сложное техническое устройство с большим количеством возможностей, режимов, функций, от успешности освоения которых
зависит степень оптимизации и компенсации углеводного обмена, удовлетворенность пациента и его врача проводимым лечением, возможность ведения больным более “свободного” и “демократичного” образа жизни. Следовательно, возникает необходимость обучения этих пациентов принципам помповой инсулинотерапии, алгоритмам изменения настроек и режимов введения инсулина в зависимости от конкретных обстоятельств жизни, принятию грамотных терапевтических решений, а также обеспечения адекватного долгосрочного амбулаторного наблюдения и мониторинга. Однако большинство современных обучающих программ не включает в свой курс занятий для пациентов, планирующих переход или находящихся на помповой инсулинотерапии, а врачи поликлинической службы физически не могут уделить достаточно времени таким больным за 20 минут амбулаторного приема. Таким образом, для успешного применения инсулиновых насосов в широкой клинической практике требуются повышение информированности пациентов об этом методе лечения, разработка и внедрение в курс структурированных обучающих программ занятий для больных на помповой инсулинотерапии, обеспечение эффективного долгосрочного амбулаторного наблюдения за ними.
Цель исследования: повышение клинической эффективности специальных структурированных программ по обучению и амбулаторному наблюдению за больными СД 1 типа (СД1), находящихся на помповой и базис-болюсной инсулинотерапии.
Материал и методы
В исследование были включены 69 пациентов (35 женщин и 34 мужчины) с СД1. Средний возраст больных составил 38,4 ± 15,23 года, стаж СД – 11,39 ± 6,39 года, масса тела – 65,97 ± 13,3 кг, индекс массы тела (ИМТ) – 22,99 ± 2,0 кг/м2 (табл. 1).
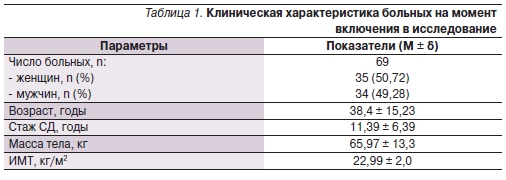
На момент включения в исследование 7 пациентов уже находились на помповой инсулинотерапии, а у
20 она была инициирована впервые. Остальные 42 пациента получали инсулин в виде многократных инъекций (базис-болюсная схема инсулинотерапии). Для всех пациентов был проведен курс терапевтического обучения основным принципам “гибкой” инсулинотерапии и самоконтроля, рационального питания, физической нагрузки, профилактики и лечения острых и поздних осложнений СД. Для пациентов на помповой инсулинотерапии был проведен дополнительный курс обучения, посвященный техническим характеристикам, возможностям и функциям дозаторов. Далее все больные были разделены на четыре группы. В группу 1 вошли пациенты (20 человек) на базис-болюсной инсулинотерапии, продолжившие традиционное амбулаторное наблюдение у эндокринолога после прохождения курса обучения. Группу 2 составили больные (10 человек) на помповой инсулинотерапии, также прошедшие курс обучения с дальнейшим посещением лечащего врача не чаще 1 раза в месяц. В группу 3 были включены больные (22 человека), получавшие инсулин в виде многократных инъекций, которым после обучения оказывалась дистанционная поддержка – специально разработанная и внедренная система обучения и амбулаторного мониторинга. В группу 4 вошли 17 пациентов на помповой инсулинотерапии, в отношении которых также применяли практику дистанционной поддержки больных.
Суть данного подхода заключалась в дистанционном обучении пациентов в условиях реальной жизни с учетом их общего соматического статуса, количества и степени развития поздних осложнений, психологических и интеллектуальных особенностей, а также бытовых, профессиональных, социальных и других условий. Основные цели дистанционной поддержки: помощь в индивидуализации “усредненных” рекомендаций, знаний и навыков, полученных в процессе курса традиционного обучения, а также “гармонизация” терапевтических воздействий и персональных особенностей образа жизни конкретного пациента. Кроме того, дистанционная поддержка пациентов из групп 3 и 4 осуществлялась с учетом психотипа каждого больного. После прохождения курса терапевтического обучения пациенты должны были на протяжении двух недель ежедневно связываться с врачом (посредством телефона, электронной почты, факса, скайпа) для обсуждения последних данных самоконтроля, плана питания, действий пациента в разных ситуациях, коррекции доз инсулина. На протяжении этого времени врач оценивал следующие параметры: наличие дневника самоконтроля, регулярность и правильность его заполнения, частоту контактов с врачом и проведения самоконтроля, действий пациента в зависимости от сложившейся ситуации, уровень знаний и представлений о СД. После анализа этих данных больные групп 3 и 4 были разделены на 4 разных психотипа:
• Психотип 1 – пациенты, не способные в полной мере усвоить (а следовательно, и применить) знания
и навыки, полученные в процессе обучения, но при этом демонстрирующие высокий уровень мотива-
ции к выполнению рекомендаций ипредписаний врача. Роль дистанционной поддержки в отношении таких больных сводилась к максимальной “стандартизации” образа жизни, плана питания, разработке готовых алгоритмов и шаблонов действий в разных ситуациях.
• Психотип 2 – пациенты с недостаточным уровнем самоорганизации, самодисциплины и силы воли, при этом показывающие высокий уровень знаний и представлений о СД, способные самостоятельно принимать грамотные терапевтические решения. Основной направленностью в ведении этих пациентов были контроль выполнения и применения полученных знаний и рекомендаций, поддержание мотивации и дисциплины больного посредством частых регулярных контактов (телефонных, через электронную почту) врача с пациентом (причем нередко инициируемые врачом, а не больным).
• Психотип 3 – пациенты, сочетающие особенности больных из первых двух групп. В данном случае применялся комбинированный подход –“стандартизация” образа жизни и последующий контроль выполнения рекомендаций и предписаний врача.
• Психотип 4 – пациенты, способные усвоить в процессе терапевтического обучения все навыки и знания, готовые аккуратно и исполнительно следовать получаемым рекомендациям. Основной задачей дистанционной поддержки таких больных являлась помощь в овладении и применении знаний и навыков, необходимых для самостоятельного эффективного долгосрочного управления своим заболеванием. При достижении пациентами терапевтических целей (с учетом их индивидуальных обстоятельств жизни), им назначались периодические визиты в клинику для контроля клинико-
метаболических показателей (в первую очередь гликированного гемоглобина).
После выявления психотипа пациента определялась окончательная тактика его ведения и дистанционная поддержка осуществлялась с учетом персональных психологических, волевых и интеллектуальных особенностей данного больного.
Период наблюдений за всеми 4 группами составил 12 месяцев. Степень компенсации углеводного обмена оценивали по уровню гликированного гемоглобина (НbА1с): исходно, через 3, 6, 9 и 12 месяцев. Кроме того, исходно и в конце исследования у части больных было проведено суточное непрерывное мониторирование глюкозы (CGM – Continuous glucose monitoring). Сравнивали также частоту острых осложнений СД (тяжелых гипогликемических состояний и кетоацидоза).
Результаты и обсуждение
Для оценки углеводного обмена использовался НbА1с как “золотой стандарт” оценки долгосрочной компенсации СД. Все четыре группы были однородны по его среднему исходному уровню. Динамика этого показателя за весь период наблюдения представлена в табл. 2, из которой видно, что во всех
4 группах отмечена стойкая тенденция к снижению уровня НbА1с относительно исходных данных. Однако выраженность этой динамики в разных группах была различной. Средний НbА1с через 12 месяцев наблюдения составил: в группе 1 – 8,27 ± 1,58 % (р < 0,05), в группе 2 – 7,84 ± 2,04 %
(р < 0,05), в группе 3 – 7,44 ± 1,53 % (р < 0,05), в группе 4 – 6,74 ± 0,97 % (р < 0,05). Примечательно также, что наибольшее снижение уровня НbА1с отмечено у пациентов, имевших исходно более высокие его значения.
Таблица 2. Динамика уровня НbА1с за 12 месяцев в исследуемых группах (М ± δ).
Таблица 3. Результаты суточного CGM исследуемых групп до включения в исследование (М ± δ).
Кроме того, для более детального изучения состояния углеводного обмена до включения в исследование у части пациентов из всех четырех групп проводили CGM, результаты которого представлены в табл. 3. Анализ этих данных показал неудовлетворительную компенсацию углеводного обмена во всех четырех группах больных: отмечена выраженная вариабельность гликемии с высоким средним уровнем и частотой эпизодов гипергликемии, низким процентом периодов нормогликемии. Во всех группах также регистрировались гипогликемические состояния, причем в группах 1 и 4 их
процент был наиболее высоким.
Результаты повторного суточного CGM тех же больных через 12 месяцев наблюдения свидетельствовали об уменьшении вариабельности гликемии (положительная динамика максимальных и минимальных значений уровня глюкозы), эпизодов гипер- и гипогликемии при увеличении длительности периодов нормогликемии у большинства пациентов. Однако положительная динамика исследуемых показателей была более выраженной в группах 3 и 4. Те же параметры у больных из групп 1 и 2 имели менее стойкую тенденцию к улучшению.
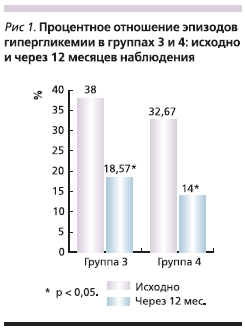
Так, процентное отношение эпизодов гипергликемии через 12 месяцев исследования в группе 3 составило 18,57 ± 20 % (р < 0,05), а в группе 4 – 14 ± 12,46 % (р < 0,05) (рис. 1). В обеих группах, получавших также дистанционную поддержку, отмечено увеличение периодов нормогликемии
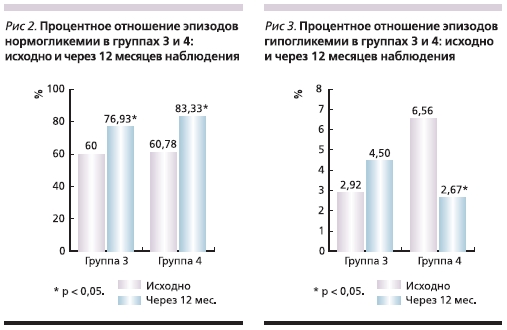
по данным CGM (рис. 2). В группе 3 их число возросло до 76,93 ± 23,75 % (р < 0,05), а в группе 4 – до 83,33 ± 14,49 % (р < 0,05). Анализ числа эпизодов гипогликемии продемонстрировал неоднозначные результаты. В группе 3 их частота выросла до 4,5 ± 10, 97 % (р > 0,05), однако это увеличение оказалось статистически недостоверным. А в группе 4 тот же показатель, наоборот, достоверно снизился до 2,67 ± 4,3 % (р < 0,05) (рис. 3).
Нами была также проанализирована частота острых осложнений СД –кетоацидозов, кетоацидотических ком, тяжелых гипогликемических состояний. У пациентов групп 3 и 4, получавших дистанционную поддержку, развития острых осложнений за весь период наблюдения зафиксировано не было. У больных групп 1 и 2, находившихся на традиционном амбулаторном наблюдении, за 12 месяцев исследования в сумме было отмечено 7 случаев кетоацидоза, одна кетоацидотическая кома, 2 случая тяжелой гипогликемии и 1 погликемическая кома, 1 летальный исход вследствие ишемического стволового инсульта.
Полученные результаты в целом позволяют говорить о высокой клинической эффективности такого подхода, как дистанционная поддержка больных. Обучение больного в режиме “реального времени” с учетом его индивидуальных волевых, интеллектуальных, социально-бытовых и профессиональных особенностей, обстоятельств и образа жизни, возможность “обратной связи” для пациента и врача
способны обеспечить эффективное и безопасное управление СД на долгосрочной основе. Кроме того, оптимизация гликемического контроля (снижение уровня НbА1с, уменьшение вариабельности гликемии и частоты гипо- и гипергликемических состояний, процентное повышение эпизодов нормогликемии) является основой профилактики и лечения как острых, так и поздних осложнений СД. Таким образом, дистанционная поддержка больных может стать перспективным направлением в области терапевтического обучения больных СД, обеспечивающим долгосрочное достижение терапевтических целей, повышающее качество жизни пациентов и экономические выгоды проводимого лечения.
Выводы
1. Структурированное терапевтическое обучение больных СД1 на помповой и базис-болюсной инсулинотерапии, несмотря на свою ограниченную клиническую эффективность, улучшает компенсацию углеводного обмена, стойко снижая уровни НbА1с, уменьшая вариабельность гликемии, частоту эпизодов гипо- и гипергликемии, увеличивая при этом продолжительность периодов нормогликемии.
2. Применение современных схем “гибкой” (в т. ч. помповой) инсулинотерапии нуждается в дальнейшей разработке новых подходов в области терапевтического обучения больных с целью оптимизации долгосрочного, эффективного и безопасного управления СД.
3. Применение практики дистанционной поддержки больных показало высокую клиническую эффективность для пациентов как на помповой, так и на базис-болюсной инсулинотерапии. Следовательно, данный подход может быть успешным дополнением к традиционным структурированным обучающим программам больных как с СД, так и с другими хроническими
заболеваниями, позволяющим добиваться устойчивого и долгосрочного достижения терапевтических целей.


