Инфекции мочевых путей (ИМП) относят к распространенным амбулаторным и стационарным заболеваниям. Каждый год в мире регистрируют около 150 млн случаев ИМП, развивающихся у мужчин и женщин любого возраста. Проблемы, связанные с ИМП, в США обусловливают необходимость более чем 8 млн первичных обращений к врачу ежегодно, причем более 75 % из них приходится на женщин.
Распространенность ИМП варьируется с возрастом и полом. Известно, что около 50 % женщин могут сообщить о том, что в течение жизни у них был по крайней мере один эпизод ИМП.
Наиболее частым проявлением инфекции нижних мочевых путей является острый цистит. Частота воз-
никновения острого цистита в России, по расчетным данным, составляет 26–36 млн случаев в год [1].
По состоянию мочевых путей и наличию сопутствующих заболеваний инфекции делят на неосложненные и осложненные [2]. Неосложненные ИМП возникают в отсутствие обструктивных уропатий и структурных изменений в почках и мочевых путях, а также у пациентов без серьезных
сопутствующих заболеваний.
Этиология и патогенез, диагностика
Наиболее распространенным возбудителем острого неосложненного цистита (ОНЦ) являются грамотрицательные бактерии семейства Enterobacteriaceae. Чаще это штаммы Escherichia coli, которые выявляют в 75–90 % случаев инфекций. Другие представители семейства Enterobacteriaceae (Proteus spp., Klebsiella spp., Enterobacter spp. и др.), а также коагулазонегативные стафилококки (Staphylococcus saprophyticus) обнаруживают у оставшихся 10 % пациентов [3–5]. Региональные данные о доминирующих возбудителях ИМП и их антибиотикорезистентности представляют особый интерес и должны учитываться при выборе антимикробного препарата для терапии ОНЦ. Так, по данным недавно проведенного многоцентрового исследования динамики антибиотикорезистентности возбудителей внебольничных ИМП ДАРМИС (2010–2011), в котором было проанализировано 987 внебольничных штаммов уропатогенов из 20 городов России, Беларуси и Казахстана, на долю E. coli в этиологической структуре внебольничных неосложненных ИМП приходится только 64,6 % случая [6]. Этиологическая структура внебольничных неосложненных ИМП, по данным исследования ДАРМИС,
представлена в табл. 1.
![Этиологическая структура внебольничных неосложненных ИМП по данным исследования ДАРМИС (n = 294) [6]](https://lib.medvestnik.ru/apps/lib/assets/uploads/pharmateca/2012/10/pharm-10-2012-pic-11.jpg)
В настоящее время общепризнанно, что основным источником ИМП является микрофлора, колонизи-
рующая периуретральную область. Наиболее вирулентным ее представителем являются E. coli, проис-
ходящие из желудочно-кишечного тракта. К факторам вирулентности уропатогенных штаммов E. coli,
определяющим повреждение эпителия мочевых путей, относят цитотоксический некротизирующий
фактор-1, гемолизин и аэробактин. У штаммов E. coli, выделяемых при циститах, наблюдается выраженная взаимосвязь между продукцией факторов, опосредующих адгезию (первый этап инфекционного процесса) и вызывающих повреждение эпителия мочевых путей. Феномен ассоциации продукции факторов адгезии и повреждения эпителия объясняется тем, что кодирующие их гены локализуются на плазмидах. Штаммы E. coli, продуцирующие наибольшее количество факторов вирулентности и пролиферирующие в моче, обладают потенциальной способностью восходящему распространению по мочевым путям. Неполное опорожнение мочевого пузыря, обструктивные уропатии, инородные тела, пузырно-мочеточниковый рефлюкс, половая активность, применение местных контрацептивов способствуют восходящему развитию ИМП [7]. Микробиологические аспекты
патогенеза ИМП, описанные для E. coli, в полной мере справедливы и для других представителей семейства Enterobacteriaceae, прежде всего для Proteus spp., Klebsiella spp. Несмотря на тот факт, что на сегодняшний день документировано этиологическое значение Staphylococcus saprophyticus в развитии ОНЦ у молодых женщин, роль других грамположительных бактерий как причинных факторов ИМП продолжает оставаться предметом дискуссий.
Диагностику ОНЦ проводят на основании оценки клинических симптомов, физикального обследования и анализа лабораторных данных. Симптомами данного заболевания являются учащенное и болезненное мочеиспускание, императивные позывы к мочеиспусканию, болевые ощущения над лоном, а в ряде случаев и наличие примеси крови в моче.
Ведущее место в лабораторной диагностике ОНЦ принадлежит клиническому анализу мочи, исследова-
нию с помощью простого гемацитометра нецентрифугированной средней порции мочи, собранной после туалета наружных половых органов и доставленной в лабораторию в течение часа.
Несмотря на дорогую стоимость бактериологического исследования мочи с определением титра КОЕ в 1 мл, этот метод обладает высокой чувствительностью (≥ 10² КОЕ/мл), обеспечивает возможность идентификации возбудителя и определения его чувствительности к антимикробным препаратам.
Микробиологическим критерием диагностики ОНЦ является 10³ КОЕ/мл и более в средней порции мочи.
Антимикробная терапия
Основные цели антимикробной терапии ОНЦ:
• быстрое купирование симптомов;
• восстановление трудоспособности и социальной активности;
• предупреждение осложнений и профилактика рецидивов.
Выбор антимикробного средства лечения острого цистита в большинстве случаев проводится эмпирически на основе данных о доминирующих возбудителях и их региональной резистентности. При выборе препарата предпочтительным является пероральный путь введения, необходимо также учитывать возможный риск развития нежелательных реакций.
Критерии выбора антимикробного препарата:
• спектр антимикробной активности в отношении возбудителей острого цистита;
• фармакокинетика антимикробного препарата, позволяющая обеспечить его высокие концентрации в моче при приеме 1–2 раза в сутки;
• высокий профиль безопасности;
• приемлемая стоимость [1].
Многочисленной серией исследований было показано, что монодозная терапия или лечение короткими курсами ОНЦ является достаточной, а более длительное лечение не имеет преимуществ. К преимуществам короткого курса терапии следует отнести хорошее соблюдение его больным, низкую
стоимость лечения, низкую частоту нежелательных явлений и уменьшение влияния на периуретральную, вагинальную и ректальную флору в отношении селекции резистентных штаммов. Кроме того, в некоторых исследованиях показано, что персистирующая бактериурия после лечения (в течение 2–3 дней) свидетельствует о возможной инфекции почек, наличии осложняющих факторов в мочевых путях (например, рака мочевого пузыря) или наличии патогенов с Р-фимбриями. В связи с тем что частота неэффективности лечения, по данным значительного числа исследований, не ревышает 10–20 %, краткосрочную терапию можно также использовать в качестве своеобразного инструмента
диагностики и проводить дальнейшее урологическое обследование только больным с сохраняющимися клиническими и лабораторными признаками цистита [8].
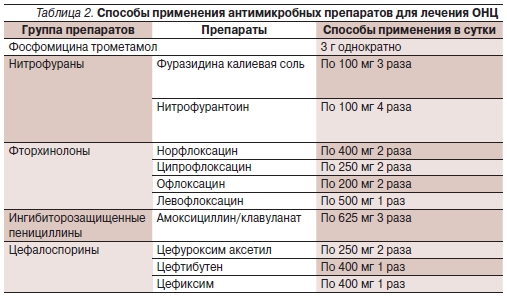
В отсутствие таких факторов риска, как беременность, возраст старше 65 лет, длительность сохранения симптомов более 7 суток, рецидив инфекции, использование в качестве контрацептивных средств диафрагм и спермицидов, сахарный диабет, длительность антимикробной терапии ОНЦ составляет 3–5 суток. Согласно Российским национальным рекомендациям по антимикробной терапии и профилактике инфекций почек, мочевыводящих путей и мужских половых органов, опубликованным в 2012 г., препаратами выбора лечения ОНЦ у взрослыхявляются фосфомицина трометамол и
фуразидина калиевая соль. В настоящее время уровень чувствительности уропатогенных штаммов кишечной палочки к вышеуказанным препаратам, по данным ряда международных и российских исследований, составляет 98–99 %. По данным многоцентрового исследования ДАРМИС, чувствительность E. coli при неосложненных ИМП к фосфомицину – препарату длямонодозной терапии, обеспечивающему высокие, в 1000 раз превышающие минимально ингибирующие концентрации в моче, составила 98,9 % [6]. Данный препарат оказывает бактерицидное действие, связанное с нарушением начальных этапов образования клеточной стенки, а также препятствует адгезии бактерий к эпителию мочевых путей. Следует отметить, что из всех пероральных препаратов только фосфомицина трометамол обладал антимикробной активностью выше 90 % ко всем грамотрицательным бактериям семейства Enterobacteriaceae – уропатогенам при ОНЦ.
По результатам исследования ДАРМИС к фуразидину оказались чувствительными 96,8 % штаммов
кишечной палочки, а к нитрофурантоину – 94,7 % при неосложненной ИМП. При ОНЦ фосфомицина трометамол назначают по 3 г однократно, а фуразидина калиевую соль следует принимать по 100 мг 3 раза в день в течение 5 суток.
В настоящее время регистрируется увеличение уровня резистентности основных возбудителей ОНЦ к ряду антимикробных препаратов: фторхинолонам, амоксициллину/клавуланату и пероральным цефалоспоринам II и III поколений. По результатам исследования ДАРМИС, при неосложненной ИМП к ципрофлоксацину были чувствительны 90 %, к левофлоксацину – 90,5 % штаммов кишечной
палочки, а к амоксициллиуну/клавуланату – 72,6 %. В связи с этим при данном заболевании указанные препараты рекомендуются в качестве альтернативного лекарственного средства. Кроме того, согласно Российским национальным рекомендациям, целесообразно резервировать фторхинолоны как препараты лечения инфекций паренхиматозных органов, создающие высокие концентрации в тканях [6]. Длительность терапии антимикробным препаратом группы фторхинолонов должна составлять 3 суток, в то время как пероральные цефалоспорины II и III поколений или амоксициллин/клавуланат следует принимать в течение 5 суток. Необходимо отметить, что нефторированные хинолоны в настоящее время не рекомендованы к применению при ОНЦ вследствие их низкой антимикробной активности и возможности индуцирования резистентности к препаратам фторхинолонового ряда.
Антимикробные препараты лечения ОНЦ, а также способы их применения представлены в табл. 2.
На сегодняшний день особый интерес представляют результаты исследований роли высоких концентраций антимикробного препарата не только в моче, но и в слизистой оболочке мочевого
пузыря для эрадикации уропатогенов при остром цистите. Эти исследования продемонстрировали особое значение внутритканевого и внутриклеточного расположения уропатогенных штаммов кишечной палочки в развитии цистита. В течение продолжительного времени
основной моделью, описывающей развитие инфекции при остром цистите, была концепция размножения бактерий в просвете мочевого пузыря и формирования пристеночного воспаления.
В последнее время накоплена информация о существенном значении в развитии острого цистита уропатогенных штаммов кишечной палочки, локализующихся в межклеточном пространстве слизистой оболочки мочевого пузыря и (возможно) внутри уротелия [9]. В настоящее время продолжаются
исследования по определению эффективности различных антибактериальных препаратов в отношении таких внутритканевых форм уропатогенов, результаты которых могут приводить к переоценке и изменению подходов к антимикробной терапии острого цистита.


