Воспалительные заболевания послеродового периода играют важную роль в структуре материнской заболеваемости и смертности, несмотря на достигнутые успехи в борьбе с инфекцией [1, 2]. Одной из наиболее распространенных клинических форм бактериальной инфекции в акушерстве является послеродовый эндометрит (ПРЭ). Отечественные и зарубежные авторы отмечают, что его частота после самопроизвольных физиологических родов составляет 3–10%, после патологически протекающих родов – 10–20%, после операции кесарева сечения – 6–30% [3–5].
Установлена полимикробная этиология ПРЭ, ведущее место в которой принадлежит условно-патогенным микроорганизмам, находящимся в большинстве случаев в виде аэробно-анаэробных ассоциаций. Среди аэробной микрофлоры преобладает грамположительная кокковая флора – энтерококки, энтеробактерии; из неспорообразующих анаэробов – грамположительные кокки (пептострептококки) и грамотрицательные палочки (бактероиды) [6–8].
Антибактериальная терапия служит основным компонентом лечения ПРЭ, и она должна отвечать следующим принципам рациональной антибиотикотерапии [4, 9, 10]: антибиотики должны назначаться с учетом чувствительности выделенного возбудителя; доза антибиотика должна обеспечивать необходимую концентрацию в очаге инфекции; при назначении антибиотика необходимо учитывать возможность грудного вскармливания.
Процесс принятия решения по выбору антибактериальной терапии ПРЭ сложен и включает анализ как фармакологической, так и клинической ее эффективности с учетом токсичности препарата для матери и новорожденного, а также его стоимости. Оценка фармакокинетики и фармакодинамики позволяет проводить сравнительный анализ антимикробных препаратов (АМП).
Аннотирование фармакокинетических особенностей АМП служит основой, позволяющей предположить характер действия конкретного антибиотика в очагах инфекции с учетом возбудителя. Фармакокинетический и фармакодинамический анализы играют ведущую роль в выборе рациональной терапии ПРЭ.
Целью настоящей работы стало обобщение имеющихся литературных данных о фармакокинетике и фармакодинамике антибиотиков, наиболее часто использующихся для лечения ПРЭ.
Традиционные факторы прогноза эффективности АМП
Активность лекарственного средства в отношении определенного микробного агента – один из факторов, определяющих выбор антибиотика. К основным АМП для эмпирической терапии ПРЭ, рекомендованным ВОЗ и Национальным руководством по акушерству, относятся β-лактамы, аминогликозиды, фторхинолоны и макролиды [4, 11].
Бактериологические исследования позволяют определить минимальную ингибирующую концентрацию (МИК) для различных микроорганизмов, что можно использовать для прогноза активности антибиотика. Однако величина МИК описывает эффект антибиотика в определенной концентрации в определенный момент времени in vitro, поэтому возможности использования этого показателя с целью прогнозирования терапевтического эффекта in vivo достаточно ограничены. МИК не позволяет оценить антимикробный эффект разных концентраций антибиотика в очаге инфекции и понять, насколько стойким он является. Ответить на этот вопрос позволяют данные о фармакокинетике и фармакодинамике АМП.
Фармакокинетика и фармакодинамика
Фармакокинетика изучает всасывание, распределение, метаболизм и выведение препарата, фармакодинамика устанавливает связь между его фармакокинетикой, необходимой длительностью применения, клинической эффективностью и токсичностью. Для антибиотиков она описывает взаимосвязь концентрации препарата и степени его воздействия на микробное начало в очагах инфекции [12, 13].
Для прогнозирования результатов лечения используют следующие фармакодинамические и фармакокинетические характеристики АМП:
- коэффициент отношения максимальной концентрации (Cmax) АМП в сыворотке крови к его МИК (Cmax/МИК);
- коэффициент отношения области под кривой концентрация–время (AUC) к МИК;
- время воздействия АМП на микроорганизм в концентрации, превышающей МИК (%Т >МИК).
 Схематично вышеперечисленные параметры отображены на рисунке.
Схематично вышеперечисленные параметры отображены на рисунке.
Фармакодинамический анализ
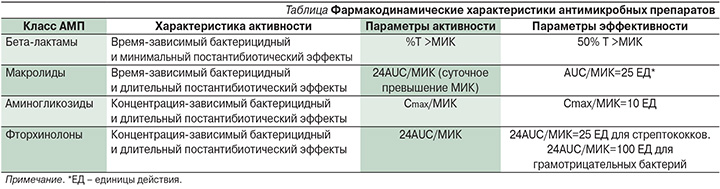
Все АМП классифицируются на основании фармакодинамических параметров, которые описывают принцип их бактерицидной активности in vivo. В таблице представлены основные фармакодинамические характеристики групп антибиотиков, наиболее часто применяемых для лечения ПРЭ.
Эффективность АМП определяется концентрацией препарата и длительностью его действия в очаге инфекции. Для усиления бактерицидного эффекта одних антибиотиков требуется увеличение концентрации, других – длительности применения [11, 14, 15]. Важным фармакодинамическим параметром АМП является постантибиотический эффект (ПАЭ). B. Vogelman и S. Gudmundsson под ПАЭ подразумевают продолжающееся после окончания воздействия антибиотика подавление роста микроорганизмов. Этот эффект изучается in vitro для определения степени и/или длительности замедления роста микроорганизмов при прекращении действия АМП. ПАЭ также может быть описан на примере систем in vivo, когда препарат постепенно выводится из организма или концентрация его находится ниже МИК (суб-MИК-концентрация).
На основании различий по этим характеристикам АМП может быть отнесен к одной из трех групп.
Первая группа включает АМП с бактерицидным эффектом, зависящим от концентрации, и ПАЭ от умеренного до стойкого. К их числу относятся аминогликозиды, фторхинолоны, метронидазол и кетолиды, а также противогрибковые препараты – полиены и эхинокандины [11, 15–17]. Целью режима дозирования препарата с такими фармакодинамическими характеристиками служит достижение с использованием высоких доз максимальных концентраций. Для АМП первой группы фармакологически обоснованным является введение высоких разовых доз с длительными интервалами между введениями из-за стойкого ПАЭ. Достаточным будет прием антибиотика один раз в сутки. Фармакодинамическими параметрами, лучше всего характеризующими данный принцип антимикробного действия, являются Cmax/МИК и 24AUC/MИК.
Пенициллины, цефалоспорины и карбапенемы относятся ко второй группе. Они обладают бактерицидным действием, минимально зависящим от концентрации, и обеспечивают слабый ПАЭ [18]. Высокие их концентрации не считаются преимуществом, т.к. микроорганизмы возобновляют свой рост вскоре после выведения препарата из организма. Для этих антибиотиков максимальное уничтожение микроорганизмов происходит, когда их уровни в сыворотке превышают MИК в отношении инфицирующих бактерий как минимум в 4 раза. Цель дозирования этих антибиотиков – максимальное продление временного интервала, в течение которого концентрация препарата остается выше MИК для конкретного микроорганизма. Частота применения и дозировка этих препаратов служат важным фактором их противомикробного действия. Для АМП этой группы рекомендовано частое, дробное введение необходимой дозы или непрерывная инфузия. Лучше всего описывает их эффективность интервал времени, в течение которого уровень АМП в сыворотке превышает значение MИК (%Т >MИК).
Бактерицидный эффект препаратов третьей группы также не зависит от их концентрации. Они отличаются от второй группы более стойким ПАЭ. В эту группу входят линкозамиды, тетрациклины, гликопептиды и макролиды, а также стрептограмин и триазол [12, 16, 17, 19–21]. Для этих АМП наиболее важно общее количество вводимого препарата. Частота применения не служит основным фактором эффективности этих препаратов. Поэтому рекомендуется избирать нечастое применение высоких доз. Коэффициент 24AUC/МИК наиболее четко характеризует эффективность препаратов третьей группы.
Фармакокинетические и фармакодинамические характеристики АМП, применяемых в терапии ПРЭ
Бета-лактамы – это АМП, бактерицидная эффективнось которых напрямую зависит от времени их воздействия. Их способность к уничтожению инфекционных агентов не увеличивается с повышением концентрации, если речь идет о концентрации, превышающей MИК в 2–4 раза [15]. Повышение концентрации препарата выше этого значения не ведет к увеличению бактерицидного действия. Наилучшим предиктором клинического результата является показатель %Т >MИК. Антибиотик должен оставаться в достаточно высокой концентрации в течение длительного времени в очаге инфекции. Многочисленные данные, полученные в ряде исследований in vitro и на экспериментальных моделях, а также клинические исследования показали, что оптимальный бактерицидный эффект (80–85%) достигается при Т >MИК, превышающем 40–50% интервала дозирования [12, 14, 22]. Зависимость между %Т >MИК β-лактамных антибиотиков и их эффективностью анализировали у пациентов с раневой послеродовой инфекцией, вызванной Staphylococcus аureus и Escherichia coli [13, 23]. У родильниц с ПРЭ, получавших цефуроксин в качестве непрерывной инфузии в дозе 1500 мг/сут (%Т >MИК=100%), не наблюдалось различий в клиническом результате по сравнению с пациентками, получавшими этот антибиотик по 750 мг трижды в сутки (оценочное %Т >MИК=от 50 до 60%), что позволяет сделать вывод, что целевоеТ >МИК 50% оказалось достаточным.
Бактерицидный эффект аминогликозидов зависит от концентрации и дополняется стойким ПАЭ. Соотношение Cmax/МИК – это фармакокинетико-фармакодинамический параметр, позволяющий прогнозировать эффективность аминогликозидов, что подтверждено широкомасштабными исследованиями in vitro, in vivo и клиническими работами. В качестве оптимальной стратегии дозирования для достижения максимальной концентрации большинство исследователей предлагают введение антибиотиков этой группы один раз в сутки [13, 14]. Поскольку самые высокие уровни аминогликозидов, достигаемые при введении один раз в сутки, приводят к меньшим неблагоприятным токсическим явлениям, чем меньшие дозы, вводимые чаще, данная стратегия позволяет достигать стойкой концентрации антибиотика на уровне, безопасном с точки зрения токсичности для матери и плода.
Антимикробный эффект фторхинолонов наиболее выражен, когда их концентрация намного превышает MИК для соответствующего микроорганизма. Соотношения AUC/MИК) и Cmax/МИК служат основным параметром, определяющим их эффективность [12, 17, 24]. В исследованиях, посвященных фармакокинетике фторхинолонов, соотношение AUC/MИК в большей степени коррелирует с эффективностью, чем отношение Cmax/МИК. Данные, полученные из нескольких источников, включая исследования на экспериментальных моделях сепсиса, фармакодинамические эксперименты in vitro и ряд клинических исследований, показали одинаковую прогностическую способность соотношения AUC/MИК в отношении антимикробной эффективности фторхинолонов [24, 25]. W.A. Craig и соавт. в ряде исследований описали случаи применения фторхинолонов у инфицированных животных с целью эрадикации грамотрицательных бактерий, показавшие, что соотношение AUC/MИК=100 ассоциируется с максимальной выживаемостью [12, 26].
Применительно к грамположительным бактериям эффективное соотношение AUC/MИК может быть значительно ниже [12, 14, 26]. Например, P.D. Lister и C.C. Sanders обнаружили, что для левофлоксацина и ципрофлоксацина соотношение AUC/MИК от 32 до 44 ассоциируется с максимальной эрадикацией стрептококков in vitro [24].
Макролиды и азалиды (например, азитромицин), как правило, применяются в случаях ПРЭ, вызванного хламидийной инфекцией. Как сообщают W.A. Сraig, S. Kiem и D. Andes, данные АМП, чья бактерицидная активность находится в зависимости от времени, продуцируют длительный ПОЭ [12, 17]. Наиболее значимым фармакодинамическим параметром для этих препаратов, характеризующим их эффективность, является скорее соотношение AUC/MИК, чем %Т >MИК. Те же авторы сообщают, что соотношение AUC/MИК лекарственного вещества, не связывающегося с белками плазмы крови, демонстрирующее эффективность макролидов и азалидов в моделях с инфицированными животными, составляет приблизительно 25 ЕД. Бактериологические исследования подтверждают большую эффективность лечения азитромицином хламидийного ПРЭ, когда соотношение AUC/MИК превышает 25–35 ЕД. Однако при лечении инфекции, обусловленной менее восприимчивыми к лечению штаммами, соотношение AUC/MИК оказывается намного ниже этого целевого значения, что нередко сопровождается отсутствием эрадикации патогенного микроорганизма.
Значение фармакокинетического-фармакодинамического анализа в моделировании лечения послеродового эндометрита
Фармакодинамика лекарственного препарата важна для его эффективного применения, а также для разработки новых АМП и терапевтических стратегий при развитии резистентности.
Многочисленные исследования демонстрируют эффективность применения фармакокинетических и фармакодинамических знаний при прогнозировании результата лечения инфекции, вызванной S. аreus, с множественной лекарственной устойчивостью [18, 22, 27, 28]. В случае с резистентными стафилококками фармакодинамический анализ помогает прогнозировать слабый бактерицидный эффект для многих β-лактамов, разрешенных в амбулаторном лечении пуэрперальных инфекций в послеродовом периоде. Увеличение MИК для всех пероральных цефалоспоринов снижает такой параметр, как %Т >MИК. Он становится намного ниже 40%, и при таком его значении вероятной становится низкая эффективность или безрезультатность терапии. [27, 28]. В тех же работах приводятся рекомендации по эффективному использованию информации о фармакодинамике АМП для разработки новых принципов лечения послеродовых гнойно-воспалительных заболеваний.
Важным фактором, влияющим на эффективность того или иного режима антибиотикотерапии, является индивидуальное время воздействия антибиотика, определяемое его фармакокинетикой. Как сообщают P.G. Ambrose и M.N. Dudley, в силу естественной вариации биологических систем определенные фармакокинетические параметры могут в значительной мере меняться [25, 29]. У некоторых родильниц препарат абсорбируется, метаболизируется, распределяется и выводится намного быстрее или медленнее, чем в основной выборке. В результате этих вариаций эффективность АМП in vivo может существенно отличаться от показателей, полученных in vitro. Чтобы определить для каждой родильницы истинную эффективность АМП в отношении микроорганизма, вызвавшего инфекционный процесс, необходимо установить его MИК в сыворотке. В рутинной клинической практике это физически невозможно по очевидным экономическим и техническим причинам. Такого рода определения выполняются в ограниченном масштабе в рамках научных исследований.
Еще одним источником вариабельности антибактериальной эффективности является сам инфекционный агент, чувствительность которого к АМП может существенно различаться [30, 31]. Фармакокинетико-фармакодинамический анализ особенно полезен при разработке принципов лечения инфекций, резистентных к АМК.
Определение допустимых уровней МИК для антибиотиков группы β-лактамов проводится при помощи фармакокинетического моделирования по методу Монте-Карло с применением приемов популяционной фармакокинетики с целью установления концентрации препарата, соответствующей 40–50% интервала дозирования. Такая концентрация препарата определяется как ее фармакокинетический и фармакодинамический пределы. При достижении концентрации на данном уровне или выше можно ожидать успешных результатов лечения.
Заключение
Применение фармакокинетического и фармакодинамического анализов при подборе АМП в качестве лучшего при сравнении альтернативных вариантов позволяет добиваться повышения эффективности лечения ПРЭ, т.к. не все классы АМП и препараты одного класса имеют одинаковую эффективность в отношении основных возбудителей послеродовой инфекции.
Национальное руководство по акушерству и гинекологии с учетом фармакологических характеристик рекомендует для этиотропной терапии ПРЭ полусинтетические пенициллины, цефалоспорины II–III поколений, аминогликозиды и линкозамиды, а также метронидазол:
- для аминогликозидов (гентамицин) и метронидазола, относящихся к первому классу АМП, рекомендуется введение больших разовых доз с соблюдением достаточно больших интервалов, вплоть до приема один раз в сутки с учетом их стойкого ПАЭ;
- для цефалоспоринов и пенициллинов, относящихся ко второму классу АМП, важным моментом является поддержание концентрации на уровне выше МИК, поэтому рекомендуется более частое введение или даже непрерывная инфузия препарата;
- для третьего класса АМП – линкозамидов, принципиальна общая доза препарата, необходимая для достижения пиковой концентрации. Частота приема служит второстепенной фармакодинамической характеристикой. Поэтому целесообразно избирать нечастый прием высоких доз препарата.
Таким образом, чрезвычайно важным фактором снижения частоты формирования резистентности микроорганизмов в акушерских стационарах является выбор антибиотиков с учетом их фармакокинетических и фармакодинамических показателей.



