Клинические аспекты эффективности применения ингибиторов ДПП-4 в моно- и комбинированной терапии
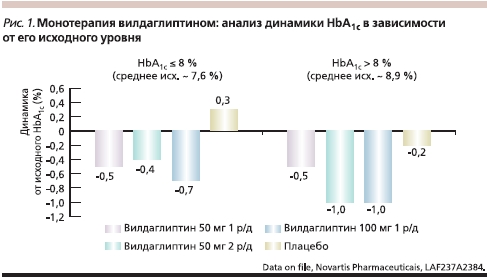
Одним из представителей ингибиторов дипептидилпептидазы-4 (и-ДПП-4) являются препарат вилдаглиптин (Галвус) и его комбинация с метформином (Галвус Мет). Его эффективность в терапии сахарного диабета 2 типа (СД2) начиная со старта лечения была подтверждена многочисленными данными клинических исследований. Анализ эффективности и безопасности вилдаглиптина по сравнению с традиционными пероральными сахароснижающими препаратами – ПССП (метформином, сульфонилмочевиной, тиазолидиндионами) не выявил больших различий по сахароснижающему действию. При этом показано, что терапия вилдаглиптином хорошо переносится, сопровождается низким риском развития гипогликемий и не влечет за собой повышения массы тела. Это является существенным преимуществом по сравнению с другими ПССП. Эффективность монотерапии вилдаглиптином у пациентов с СД2, ранее не получавших терапии, изучалась S. Dejager и соавт. [1] в ходе плацебоконтролируемого исследования длительностью 24 недели. Результаты показали высокую сахароснижающую активность вилдаглиптина в дозе 50 мг 1 раз в сутки и 50 мг 2 раза в сутки. Степень снижения гликированного гемоглобина (HbA1c) составила 0,5 и 1,0 % соответственно по сравнению с плацебо. Дополнительно было показано, что вилдаглиптин оказывает сахароснижающее действие независимо от исходного уровня гликемического контроля.
Сравнение терапии вилдаглиптина с метформином на старте терапии, проведенное A. Shweizer и соавт. [2], показало, что вилдаглиптин обеспечивает достоверное, сравнимое с терапией метформином снижение уровня HbA1c через 1 и 2 года наблюдения (1,0 и 1,4 % соответственно). Число пациентов, отметивших нежелательные явления со стороны желудочно-кишечного тракта, оказалось в два раза больше в группе терапии метформином по сравнению с вилдаглиптином. Частота развития гипогликемий была одинаково низкой в обеих группах (< 1 %). На рис. 1 представлены обобщенные данные динамики HbA1c в исследованиях с использованием вилдаглиптина в качестве монотерапии.
Кроме того, многие исследования показали эффективность и безопасность комбинированной терапии вилдаглиптином + метформин, в т. ч. и на старте терапии СД2. Комбинация и-ДПП-4 с метформином является физиологически обоснованной, оказывает синергическое влияние на активность глюкагоноподобного полипептида-1 (ГПП-1), обеспечивает эффективный гликемический контроль без риска развития гипогликемий и повышения массы тела [6]. Так, пациентам с СД2, не получавшим ранее терапии (исходный HbA1c – 7,5–11 %), применение фиксированной комбинации вилдаглиптин + метформин (Галвус Мет) в дозе 50/1000 мг 2 раза в сутки обеспечило снижение HbA1c на 1,8 % по сравнению с монотерапией каждым из препаратов в отдельности. При очень высоких исходных значениях HbA1c (> 11 %) было показано еще более выраженное снижение его уровня (на 3,7 %) на фоне терапии препаратами вилдаглиптин + метформин [7].
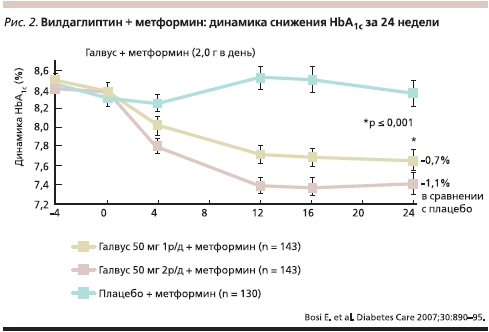
Была подтверждена эффективность и безопасность добавления вилдаглиптина к терапии метформином для пациентов с СД2, не достигших контроля на монотерапии метформином. Так, исследование с участием пациентов, получавших метформин в дозе свыше 1500 мг/сут и не достигших компенсации (HbA1c 7,5–11 %), показало, что добавление к терапии вилдаглиптина в дозе 50 мг 1 раз в сутки или 50 мг 2 раза в сутки обеспечивало дозозависимое снижение уровня HbA1c на 0,7 и 1,1 %, а показателя гликемии натощак – на 0,8 и 1,7 ммоль/л соответственно (рис. 2) [8].
С учетом широкой распространенности совместного применения пациентами с СД2 производных сульфонилмочевины (ПСМ) с метформином особый интерес представляют сравнения данной комбинации с комбинацией метформин + вилдаглиптин. В одном из таких исследований наблюдались пациенты с неудовлетворительным контролем СД, которым к терапии метформином добавляли ПСМ (глимепирид до 6 мг/сут) или и-ДПП-4 (вилдаглиптин 50 мг 2 раза в сутки). Длительность периода наблюдения за пациентами составила 2 года. Результаты показали, что в обеих группах снижение HbA1c оказалось сопоставимым. При этом в группе терапии вилдаглиптином бoльшее число пациентов достигли цели HbA1c < 7 % с 14-кратной разницей по числу эпизодов гипогликемии (59 по сравнению с 838). Терапия вилдаглиптином также не была связана с увеличением массы тела в отличие от терапии глимепиридом с межгрупповой разницей в 1,5 кг. Таким образом, терапия вилдаглиптином в течение двух лет сопровождалась снижением гликемии, сопоставимым с эффектом глимепирида, но без увеличения массы тела и значительно меньшим риском гипогликемий [9].
Проблемы выбора терапии для пациентов групп риска. Добавление и-ДПП-4 к терапии инсулином
Широкомасштабная программа клинических исследований вилдаглиптина предусматривала оценку его применения для пациентов с СД2 старше 65 и 75 лет. Все пациенты исходно имели факторы сердечно-сосудистого риска и многочисленные сопутствующие заболевания, по поводу которых проводилась соответствующая медикаментозная терапия. Старшая возрастная подгруппа пациентов отличалась более низкими значениями HbA1c, уровнем глюкозы крови натощак (ГКН) и массой тела по сравнению с более молодыми пациентами. Терапия вилдаглиптином (50 мг 2 раза в сутки) в течение 24 недель привела к снижению уровней HbA1c и ГКН как у больных старше 75 лет (1,2 % и 1,5 ммоль/л соответственно), так и у более молодых пациентов (0,9 % и 1,1 ммоль/л) [10].
Данные о минимальном риске гипогликемий среди больных старшего возраста, получавших терапию вилдаглиптином, подтвердились в исследовании, в котором участвовали пациенты старше 65 лет с небольшой длительностью СД2 (исходный уровень HbA1c – 6,7 %). В течение двух лет терапии ни один пациент из группы вилдаглиптина не отметил эпизодов гипогликемии, несмотря на улучшение гликемического контроля, по сравнению с плацебо (разница в уровне HbA1c через 2 года составила 0,5 %) [12].
Кроме того, преимущества добавления вилдаглиптина к инсулину были продемонстрированы в ряде работ с пациентами с СД2, получавшими исходно разные режимы инсулинотерапии, в т. ч. и инсулиновыми аналогами. Все работы показали, что при небольшом дополнительном сахароснижающем действии добавление вилдаглиптина связано со значительным снижением частоты гипогликемий и меньшим повышением массы тела по сравнению с добавлением к инсулину плацебо [13].
Насколько важны дополнительные эффекты и-ДПП-4 в отношении массы тела, уровня липидов, артериального давления?
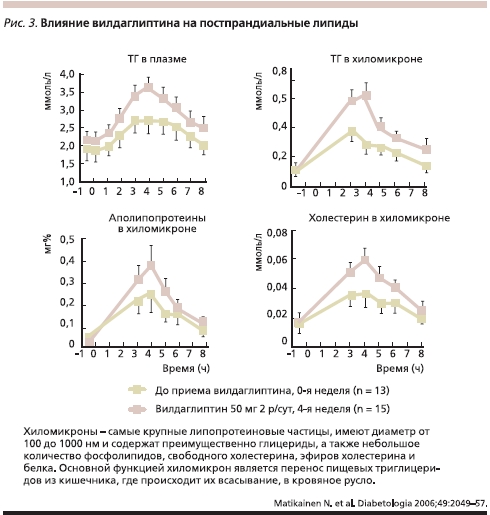
Известно, что вилдаглиптин обладает нейтральным свойством по отношению к массе тела либо способствует ее незначительному снижению. Попытки объяснить такие эффекты терапии и-ДПП-4 в первую очередь сводились к тому, что в результате выраженного снижения риска гипогликемий пациенты перестают дополнительно перекусывать и потребляют меньше калорий. Изучением этого вопроса занимались многочисленные авторы. Так, Boschmann и соавт. выдвинули гипотезу о влиянии и-ДПП-4 на жировую ткань и скелетные мышцы. Пациентам назначали вилдаглиптин или плацебо на 7 дней. Результаты показали, что вилдаглиптин увеличивал постпрандиальный уровень норадреналина плазмы, глицерола и лактата в жировой ткани, одновременно подавляя концентрацию лактата и пирувата в скелетных мышцах. Полученные данные показывают, что и-ДПП-4 увеличивают постпрандиальную мобилизацию и окисление жиров (рис. 3) [14].
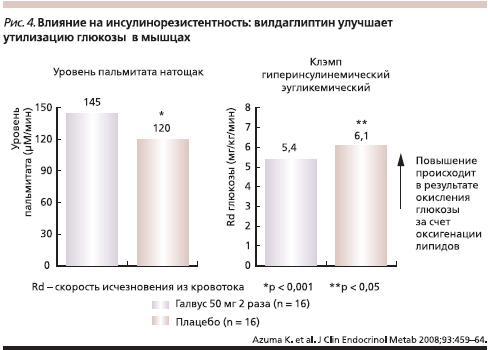
Показано влияние вилдаглиптина на инсулинорезистентность, которую оценивали по уровню пальмитата в крови (маркер скорости утилизации глюкозы периферическими тканями). В условиях эугликемического клэмпа вилдаглиптин улучшал чувствительность к инсулину и клиренс глюкозы (рис. 4) [15].
Сердечно-сосудистые аспекты терапии и-ДПП-4
К основным факторам сердечно-сосудистого риска относятся предшествующие сердечно-сосудистые заболевания, артериальная гипертензия (АГ), центральное ожирение, курение, дислипидемия, гипергликемия, длительность СД, инсулинорезистентность и гиперинсулинемия. Факторы риска сердечно-сосудистой заболеваемости для пациентов с СД играют огромное значение в течении и прогрессировании заболевания. Именно поэтому наиболее эффективная стратегия профилактики сосудистых осложнений у больных СД включает контроль артериального давления (АД), уровня гликемии, а также антитромбоцитарную и гиполипидемическую терапию [3–5]. В этом плане большое значение имеет сердечно-сосудистая безопасность долгосрочной сахароснижающей терапии, которая в идеале тоже должна способствовать снижению риска сердечно-сосудистых осложнений.
Результаты последних исследований убедительно продемонстрировали, что инкретины не только эффективно контролируют уровень глюкозы, но и оказывают положительное влияние на сердечно-сосудистую систему (рис. 5) [11]. Обнаружено, что ГПП-1-рецепторы имеются не только на островковых клетках поджелудочной железы, но и в почках, легких, головном мозге, в сердце [18]. Терапия, основанная на повышении активности инкретинов, не влечет за собой побочных эффектов (повышения массы тела и гипогликемии), что также способствует снижению сердечно-сосудистого риска.
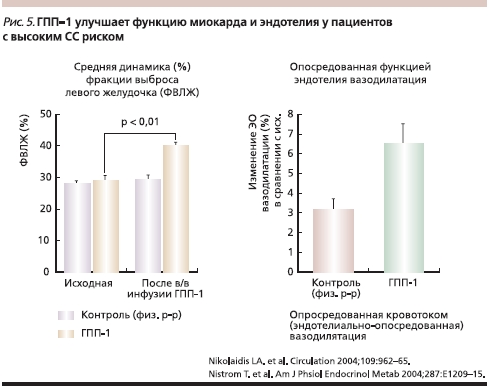
Несколько экспериментальных исследований доказали влияние инкретинов на сердечно-сосудистую систему [18]. Так, было показано, что при инфузии ГПП-1 отмечалось расширение диаметра исходно суженых легочных артерий [11]. Полученные данные позволяют предположить, что терапия, основанная на стимулировании инкретиновой активности [18–22], может уменьшать размеры зоны инфаркта миокарда как в изолированных тканях, так и у крыс при введении ГПП-1 [18–22].
В ряде исследований было показано, что терапия ГПП-1 улучшает сократительную функцию левого желудочка в поврежденном миокарде. В модели на собаках с дилатационной кардиомиопатией, индуцированной электростимуляцией 48-часовое введение ГПП-1 улучшало чувствительность к инсулину и потребление глюкозы миокардом, увеличивало сердечный выброс и снижало диастолический объем левого желудочка, частоту сердечных сокращений и системное сосудистое сопротивление [23, 24]. Этими фактами можно скорее всего объяснить и снижение повышенного АД на терапии вилдаглиптином.
Результаты широкомасштабного мета-анализа, опубликованного в 2010 г., показали, что относительный риск развития всех совокупных сердечно-сосудистых исходов, в т. ч. инфаркта миокарда, инсульта или сердечно-сосудистой смертности, оказался меньше < 1 на терапии вилдаглиптином (50 мг) как при однократном, так и при двукратном приеме по сравнению с другими ПССП. Более того, сердечно-сосудистая смертность, скорректированная по количеству исходов, составила 0,14 случая/100 пациентолет для вилдаглиптина и 0,25 случая/100 пациенто-лет для всех других ПССП.
Можем ли мы остановить прогрессирование СД2?
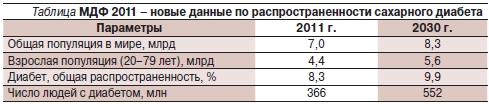
По данным Международной федерации диабета (МФД), в настоящее время в мире насчитывается 366 млн больных СД. Ежегодно от СД умирают 4,6 млн человек. По данным только что опубликованного Атласа МФД 2011 г. (см. таблицу), распространенность СД в 2030 г. составит 9,9 % по сравнению с 8,3 % в 2011 г. Предполагается, что к 2030 г. общее число больных СД может увеличиться до 438 млн человек. В Российской Федерации численность больных СД составляет около 9,6 млн человек. Приблизительно у 75–80 % пациентов, страдающих СД, причиной смерти являются сердечно-сосудистые заболевания. При наличии СД риск развития ишемической болезни сердца в 4 раза выше по сравнению с общей популяцией [2]. Развитие цереброваскулярной болезни и заболеваний периферических артерий также значительно возрастает; в частности риск первичного и повторного ишемического инсульта в 6 раз выше, чем в общей популяции. Несмотря на огромный арсенал средств для терапии СД, больные становятся инвалидами и умирают в связи с быстрым и необратимым прогрессированием осложнений.
Можно ли остановить эпидемию и улучшить прогнозы заболевания?
Анализ исследования DCCT (Diabetes Control and Complications Trial) по контролю диабета и его осложнений показал, что при снижении уровня HbA1c на 1 % риск развития микрососудистых осложнений (ретинопатии, нефропатии) снижался на 35 %. Кроме того, результаты данного исследования четко продемонстрировали, что интенсивный контроль гликемии наряду с нормализацией показателей АД значительно снижает риск развития ишемической болезни сердца, цереброваскулярных заболеваний и периферической ангиопатии у больных СД2. Поэтому основной целью лечения СД является как можно более полная компенсация метаболических нарушений. Для этого должна применяться комплексная, патогенетически обоснованная терапия, учитывающая хроническое течение заболевания, гетерогенность метаболических нарушений, прогрессирующее снижение массы β-клеток, возраст больных, опасность гипогликемий, необходимость восстановления нарушенной секреции инсулина и необходимость достижения долгосрочного гликемического контроля. Программы профилактики диабета (DPP – Diabetes Prevention Program и DPPOS – Diabetes Prevention Program Outcomes Study) были разработаны с целью ответить на вопрос: можно ли остановить прогрессирование СД2 с использованием медикаментозных препаратов? Они показали, что контроль диеты и физические нагрузки являются наиболее эффективным подходом [25]. Изменение образа жизни способствовало снижению прогрессирования СД в 56 % случаев, в то время как метформин – только в 38 % случаях. Кроме того, все пациенты после прекращения врачебного наблюдения сразу же стали набирать массу тела и возвращаться к прежнему состоянию здоровья. Были сделаны следующие выводы: на сегодняшний день вылечить СД2 невозможно, но больные могут эффективно управлять СД и жить полноценной жизнью. Основная цель терапии предиабета и диабета – предотвращение развития микро- и макрососудистых осложнений.
Надежды на то, что СД2 удастся предотвратить и контролировать, связаны с новыми группами препаратов (к которым относятся и-ДПП-4), обладающих следующими свойствами [23, 24]:
• разнонаправленным механизмом действия, нацеленным на коррекцию функции α- и β-клеток;
• улучшением секреции инсулина и чувствительности к нему;
• глюкозозависимой секрецией инсулина;
• меньшим риском развития гипогликемий;
• сохранением функции β-клеток;
• стимулированием неогенеза и замедлением апоптоза β-клеток.
Так как измерить массу β-клеток человека прямыми методами невозможно, используются косвенные методы оценки их функции (HOMA-B тест, отношение содержания проинсулина к инсулину, уровень С-пептида). В исследовании B. Ahren и соавт. [16] было показано, что применение комбинации вилдаглиптина (50 мг/сут) и метформина (1500–3000 мг/сут) позволило достоверно увеличить секрецию инсулина на 40 пмоль. Кроме того, отмечалось повышение инсулиногенного индекса (усиление секреции инсулина в ответ на увеличение пострандиальной концентрации глюкозы) через 52 недели терапии комбинацией вилдаглиптина с метформином. Было обнаружено, что секреция инсулина после приема пищи в группе вилдаглиптин + метформин была выше, чем в группе плацебо + метформин. Наиболее существенные результаты действия вилдаглиптина были зафиксированы в первые 12 недель. Увеличение секреции инсулина отмечалось в течение всего исследования.
В исследованиях in vitro было показано увеличение массы и активности островковых клеток у новорожденных крыс при приеме вилдаглиптина (рис. 6). Экстраполяция результатов этих исследований на человека требует дальнейшей тщательной проверки.
В заключение хотелось бы подчеркнуть, что управление диабетом – это не только коррекция гликемии, но и контроль основных параметров сердечно-сосудистой системы и липидного обмена. Многофакторный подход, индивидуальная постановка целей, применение новых эффективных и безопасных препаратов разнонаправленного действия являются основой эффективного лечения.


