Неалкогольная жировая болезнь печени (НАЖБП), являясь одним из основных компонентов метаболического синдрома, в последние годы получила широкое распространение [20, 31]. Экспертами Национального института здоровья США НАЖБП признана одним из ведущих факторов развития сердечно-сосудистых заболеваний в связи с тем, что печени принадлежит ведущая роль в реализации процессов атерогенеза [5, 21, 40, 42]. Во Фрамингемском исследовании, исследованиях PROCAM и ATR III показано, что риск возникновения заболеваний сердечно-сосудистой системы в течение 10 лет достоверно выше у пациентов с НАЖБП по сравнению со здоровыми лицами.
R. Ross определил атеросклероз как хроническое субклинически протекающее воспаление [38, 39]. Со времен описания Людвигом стеатогепатита представления о НАЖБП претерпели изменения [36]. Впервые термин НАЖБП был введен К. Sligte в 2004 г.
В настоящее время НАЖБП рассматривается как ряд последовательно протекающих стадий:
• жировая дистрофия печени (стеатоз);
• жировая дистрофия с воспалением и повреждением гепатоцитов – неалкогольный стеатогепатит (НАСГ);
• прогрессирование стеатогепатита с развитием фиброза и возможностью прогрессирования с исходом в цирроз печени.
НАСГ как вторая стадия развития заболевания опасна своим переходом в ряде случаев в цирроз и рак печени (в 60–80 % наблюдений цирроз печени неясной этиологии развивается из нераспознанного НАСГ) [20, 26, 28]. НАСГ разделяют на первичный и вторичный. Основными причинами развития первичного НАСГ являются висцеральное ожирение, сахарный диабет 2 типа, дислипидемия [7, 22, 24, 25]. Причины развития вторичного НАСГ: лекарственные препараты (глюкокортикоиды, амиодарон, эстрогены, тамоксифен, тетрациклин, ацетилсалициловая кислота, индометацин, ибупрофен), другие противовоспалительные средства; недостаточное питание, особенно недостаток белка (при обширных операциях на желудке и тонкой кишке, при резком – более 1,5 кг в неделю – снижении массы тела, при некоторых врожденных аномалиях обмена – болезни Вильсона–Коновалова, болезни Вебера–Крисчена). Патогенез НАСГ до конца не изучен.
Существующая модель патогенеза НАСГ – теория “двух толчков” – объединяет известные факторы риска стеатогепатита. При нарастании ожирения увеличивается поступление в печень короткоцепочечных жирных кислот (КЖК) и развивается стеатоз печени – “первый толчок”. Во время этого процесса происходят реакции окисления свободных жирных кислот, образуются продукты перекисного окисления липидов (ПОЛ) и реактивные формы кислорода – оксидативный стресс – “второй толчок”. Последний ответствен за появление стеатогепатита, в связи с чем имеет более важное клиническое и прогностическое значение. Непосредственными факторами, вызывающими воспаление, считаются нарушенные функции внутриклеточных структур (митохондрий), а факторами, вызывающими гибель гепатоцитов и развитие фиброза, – ПОЛ, секреция цитокинов [7, 24].
Патогенетические механизмы возникновения и прогрессирования НАЖБП обусловлены воспалением и тесно связаны с дисбалансом в составе кишечной микрофлоры [15, 34] и как следствие – увеличением продукции КЖК и эндотоксинемией [1, 2, 4, 9, 14, 16–18, 32, 33, 35, 41]. В исследовании, проведенном в Центральном научно-исследовательском институте гастроэнтерологии (ЦНИИГ), доказана прямая достоверная корреляционная связь между прогрессированием воспаления в печени (повышением уровня печеночных ферментов, индекса гистологической активности) и гиперэндотоксинемией (наличием в крови эндотоксин-липополисахаридного комплекса, являющегося частью мембраны грамотрицательных бактерий). Считается, что возникновение эндотоксемии при стеатогепатите характеризуется повышенной выработкой провоспалительных цитокинов (фактора некроза опухоли α, интерлейкина-6, интерлейкина-8) и повышенной экспрессией рецепторов к провоспалительным цитокинам. В связи с этим формирование и прогрессирование НАЖБП необходимо рассматривать в тесной взаимосвязи с микробиотой пищеварительного тракта.
Наличие воспаления и жировой инфильтрации приводит к выраженным нарушениям многих функций печени, как органных, так и системных, включая обмен липидов. Эффективность многих кардиологических препаратов, метаболизирующихся в печени, зависит от повреждения детоксицирующей системы печени. Наиболее ярким клиническим примером являются больные, получающие гиполипидемические препараты, с атерогенной дислипидемией, развивающейся на фоне НАЖБП.
В настоящее время медикаментозная терапия нарушений липидного обмена включает следующие группы препаратов:
• ингибиторы ГМК-Ко-А-редуктазы (статины);
• комбинированную терапию: статины + ингибитор абсорбции холестерина (эзетимиб), статины + фибраты;
• производные фиброевой кислоты (фибраты);
• никотиновую кислоту (ниацин);
• секвестранты желчных кислот (ионно-обменные смолы);
• омегу-3 полиненасыщенные жирные кислоты.
Наиболее широко применяемыми препаратами являются статины и фибраты [3, 10, 11, 19]. Однако не стоит забывать, что статины обладают известным гепатотоксическим действием, а фибраты способствуют литогенезу [12, 13].
Клиническая и биохимическая диагностика НАЖБП сложна ввиду неспецифичности симптомов, а трансаминазная активность не является критерием тяжести поражения печени. Наиболее ранним маркером повреждения печени при НАЖБП ранее считали гипертрансаминаземию. В последнее время доказано, что повышение активности гамма-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ) предшествует цитолитическому синдрому. Также следует отметить, что диагноз “неалкогольная жировая болезнь печени” является “диагнозом исключения”, когда данные анамнеза и лабораторно-диагностические показатели позволяют опровергнуть остальные причины повреждения печени. Однако не всегда возможно поставить диагноз без пункционной биопсии печени с морфологическим исследованием биоптата (табл. 1) [6, 29, 30].
Примечание. АСТ – аспартатаминотрансфераза, АЛТ – аланинаминотрансфераза.
Таким образом, диагностика НАЖБП основывается на совокупности трех критериев:
• данных соответствующих исследований, позволяющих исключить другие хронические заболевания печени;
• гистологической характеристике;
• отсутствии злоупотребления алкоголем.
Следует отметить недостаточную эффективность препаратов, метаболизирующихся в печени (антигипертензивных, гиполипидемических, антисекреторных и др.), при их применении больными НАЖБП. В отсутствие должного эффекта статинов у пациентов с высокими коронарными рисками врачи идут по пути увеличения дозы препаратов, не учитывая побочного действия лекарственных веществ данной группы [25].
Таким образом, своевременная диагностика НАЖБП и ее стадии у пациентов с дислипидемией принципиально важна и является залогом успешной терапии атерогенных дислипидемий, профилактики сердечно-сосудистых заболеваний, поскольку применение гиполипидемических препаратов в отсутствие объективной информации о клинических, функциональных и морфологических изменениях в печени увеличивает риск развития лекарственных поражений печени [22, 23] и снижает гиполипидемический эффект.
Для предотвращения побочных эффектов статинов и лечения НАЖБП, сопутствующей атерогенной дислипидемии, необходимо назначать гепатопротекторы в качестве терапии сопровождения. В настоящее время на фармакологическом рынке известно множество препаратов, объединенных в группу “гепатопротекторы”.
Наиболее распространенными из них в лечении больных НАЖБП являются:
1. Эссенциальные фосфолипиды (ЭФЛ);
2. Препараты урсодезоксихолевой кислоты (УДХК).
Поскольку всем больным НАЖБП необходима коррекция липидного спектра, к назначению гепатопротекторов следует подходить дифференцировано. Лечение необходимо проводить курсами, доза препарата и число курсов во многом зависят от уровня печеночных ферментов. Выбор группы препарата обусловливается ведущим лабораторным синдромом, а также стадией заболевания: при НАЖБП в стадии стеатоза, а также при более выраженном синдроме цитолиза больному следует назначать препараты группы ЭФЛ, при холестатическом синдроме показана терапия УДХК (рис. 1).
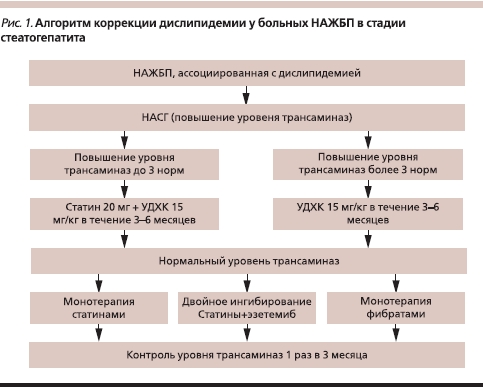
Применение ЭФЛ (Эслидин, Эссливер форте, Эссенциале, Фофоглив) курсами по 2 капсулы 3 раза в сутки в течение 2 месяцев 2–3 раза в год способствует нормализации показателей ПОЛ и системы антиоксидантной защиты, уровня трансаминаз.
ЭФЛ – сложные вещества, представляющие собой диглицеридные эфиры фосфатидных и ненасыщенных жирных кислот (в основном олеиновой и линолевой). Являются важным структурным элементом клеточных мембран и мембран органелл гепатоцитов. Фосфолипиды регулируют проницаемость мембран, активность мембраносвязанных ферментов, обеспечивая нормальные процессы окислительного фосфорилирования. Препараты данной группы нормализуют биосинтез фосфолипидов и общий липидный обмен при повреждениях гепатоцитов различной этиологии, восстанавливают мембраны гепатоцитов путем структурной регенерации и за счет конкурентного ингибирования окислительных процессов. Встраиваясь в биомембраны, ненасыщенные жирные кислоты способны принимать на себя токсикогенные воздействия вместо мембранных липидов, они также способствуют регенерации клеток печени, стабилизируют физико-химические свойства желчи. Длительное применение ЭФЛ предотвращает развитие фиброза печени и дальнейшее прогрессирование заболевания.
В последнее время широкое распространение в качестве препарата, улучшающего функцию печени при НАЖБП, получило также применение метионина – незаменимой аминокислоты, необходимой для нормального роста и обмена веществ. Метионин стимулирует образование биологически активных веществ, активизирует действие гормонов, витаминов, ферментов. Препарат способствует образованию белков, препятствует жировой инфильтрации печени, понижает содержание холестерина в крови; оказывает антитоксическое действие, укрепляя мембраны клеток, уменьшает действие ядов на печень и другие ткани.
Одним из препаратов группы эссенциальных фосфолипидов с доказанными антифибротическими свойствами является Эссенциале форте. Эссенциале и Эссливер форте содержат ЭФЛ (субстанцию EPL), являющиеся основными элементами в структуре клеточной оболочки и клеточных органелл печени, а также тиамин, рибофлавин, пиридоксин, цианокобаламин, никотинамид, токоферол. Обладая всеми свойствами ЭФЛ, препараты содержат микроэлементы, выполняющие различные функции. Тиамин (витамин В1) в качестве кофермента участвует в углеводном обмене. Рибофлавин (витамин В2) – важнейший катализатор процессов клеточного дыхания. Пиридоксин (витамин B6) в качестве кофермента принимает участие в метаболизме аминокислот и белков. Цианокобаламин (витамин B12) вместе с фолиевой кислотой участвует в синтезе нуклеотидов. Никотинамид (витамин РР) участвует в процессах тканевого дыхания, жирового и углеводного обмена. Токоферол (витамин Е) обладает антиоксидантными свойствами, обеспечивает защиту ненасыщенных жирных кислот в мембранах от ПОЛ.
Фосфоглив – оригинальный гепатопротективный препарат на основе фосфатидилхолина (фосфолипида) растительного происхождения (из семян сои) и тринатриевой соли глицирризиновой кислоты из корня солодки. Фосфолипиды восстанавливают целостность мембран клеток, в первую очередь гепатоцитов. Глицирризиновая кислота характеризуется широким спектром биологической активности, противовоспалительными свойствами, применяется в лечении заболеваний печени токсического и вирусного происхождения, в т. ч. и гепатита С. За счет детергентного действия обеспечивает эмульгирование фосфатидилхолина в кишечнике. Сочетание этих двух компонентов делает Фосфоглив особенно эффективным при лечении заболеваний печени.
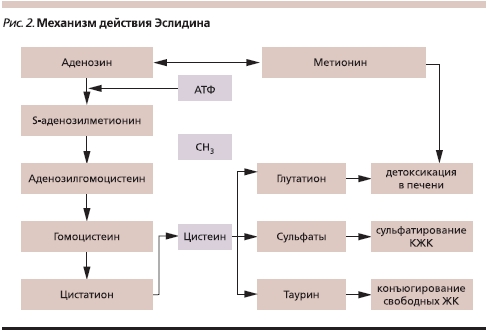
Препаратом выбора среди гепатопротекторов группы ЭФЛ в настоящее время является Эслидин. Входящий в его состав метионин представляет собой незаменимую аминокислоту, которая является источником подвижных метильных групп. Метионин необходим для синтеза холина. Увеличение содержания холина способствует увеличению синтеза эндогенных фосфолипидов и уменьшению отложения нейтрального жира в печени. При атеросклерозе метионин снижает концентрацию холестерина и повышает содержание фосфолипидов в крови. Метионин и ЭФЛ усиливают действие друг друга. Метионин также участвует в обмене серосодержащих аминокислот, в синтезе эпинефрина, креатинина и других биологически активных соединений, преобразует действие гормонов, витаминов (В12, аскорбиновой, фолиевой кислот), ферментов, белков, участвует в реакциях переметилирования, дезаминирования, декарбоксилирования. Таким образом, Эслидин восстанавливает функцию печени, повышает ее дезинтоксикационную способность, а также нормализует жировой, углеводный и белковый обмены веществ в организме (рис. 2).
Прямого гиполипидемического действия у препаратов данной группы не отмечено. Некоторые из них при длительном применении в качестве терапии сопровождения снижают гепатотоксичный эффект статинов. Побочные эффекты от приема ЭФЛ выражены минимально, проявляются в виде аллергических реакций.
В литературе появились работы, свидетельствующие о положительном эффекте Эссенциале форте, при этом, по приведенным данным, остальные препараты данной группы не обладают достаточным гепатопротективным эффектом. В ЦНИИГ проведены исследования, доказывающие положительное влияние Эслидина, Фосфоглива, Эссливера форте на состояние печени и снижение гепатотоксичного эффекта статинов (аторвастатина, симвастатина) при совместном их применении с указанными гепатопротекторами.
При высоких коронарных рисках, выраженной дислипидемии и/или прогрессировании НАСГ применяют препараты группы УДХК (Урсосан, Урсофальк, Урдокса, Урсодекс, Урсором и др.). Относительно их использования следует сказать, что они могут применяться не только как гепатопротекторы, но и в качестве альтернативной гиполипидемической терапии пациентов с сопутствующей НАЖБП в стадии стеатогепатита в стандартной дозировке 15 мг/кг. Широкий спектр применения препаратов УДХК основывается на многочисленных механизмах, обусловливающих разносторонность его действия [15, 20, 23, 27]: УДХК не только изменяет липидный обмен, но и обладает прямыми гепатопротективным, желчегонным, холелитолитическим и некоторым иммуномодулирующим эффектами. Обладая высокими полярными свойствами, УДХК образует нетоксичные смешанные мицеллы с аполярными (токсичными) желчными кислотами, что снижает способность желудочного рефлюктата повреждать клеточные мембраны при билиарном рефлюкс-гастрите и рефлюксэзофагите. Кроме того, УДХК образует двойные молекулы, способные включаться в состав клеточных мембран гепатоцитов, холангиоцитов, эпителиоцитов желудочно-кишечного тракта, стабилизировать их и делать невосприимчивыми к действию токсичных мицелл. Уменьшая концентрацию желчных кислот, токсичных для гепатоцитов, и стимулируя холерез, богатый бикарбонатами, УДХК эффективно способствует разрешению внутрипеченочного холестаза; уменьшает насыщенность желчи холестерином за счет угнетения его абсорбции в кишечнике, подавления синтеза в печени и понижения секреции в желчь; повышает растворимость холестерина в желчи, образуя с ним жидкие кристаллы; уменьшает литогенный индекс желчи. Результатом является растворение холестериновых желчных камней и предупреждение образования новых конкрементов. Иммуномодулирующее действие обусловлено угнетением экспрессии антигенов HLA-1 на мембранах гепатоцитов и HLA-2 на холангиоцитах, нормализацией естественной киллерной активности лимфоцитов и др. Достоверно задерживает прогрессирование фиброза у больных первичным билиарным циррозом, муковисцидозом и алкогольным стеатогепатитом; уменьшает риск развития варикозного расширения вен пищевода. Кроме того, УДХК замедляет процессы преждевременного старения и гибели клеток (гепатоцитов, холангиоцитов). Минимальный курс терапии – 3 месяца (2–3 раза в год) или длительно (в течение 6–12 месяцев.).
Препаратом выбора для пациентов с печеночной недостаточностью, сопровождающейся печеночной энцефалопатией, депрессивными состояниями, а также при прогрессировании воспаления при жировой дистрофии печени на фоне приема алкоголя и гепатотоксических препаратов (статинов, противотуберкулезных, противоопухолевых, нестероидных противовоспалительных средств, парацетамола, эстрогенов, анаболических стероидов, антибиотиков, антиретровирусных препаратов, фитопрепаратов) является адеметионин (Гептрал) – биологически активное соединение, аналогичное внутриклеточному адеметионину, входящее в состав всех тканей и жидких сред организма. Ежесуточно 8 г эндогенного адеметионина синтезируется в печени из аденозина и метионина [8]. Его молекула участвует в реакциях транметилирования как донор метильной группы, а также является предшественником тиоловых соединений (цистеина, таурина, глутатиона и др.). Адеметионин обладает антидепрессивной активностью, которая проявляется постепенно начиная с конца 1-й недели лечения. У лиц с ипохондрической депрессией наблюдается регресс симптомов заболевания. При внутривенном, а также длительном пероральном применении в дозе 800 мг/сут отмечается улучшение показателей функции печени. Среди больных алкогольным циррозом отмечено повышение содержание глутамина в печени, повышение концентрации цистеина и таурина в плазме и понижение – метионина в сыворотке, что свидетельствует о нормализации метаболических реакций в печени.
Связь фармакодинамики с клиническим действием Гептрала наглядно представлена в табл. 2.
С целью коррекции состава кишечной микрофлоры и учетом патогенетических аспектов развития НАСГ необходимо проводить санацию толстой кишки (метронидазол 250 мг 4 раза в сутки, рифаксимин 200 мг 2 раза в сутки, нифуроксазид 200 мг 4 раза в сутки) в течение 7–10 дней с последующим назначением пробиотиков (Линекс 2 капсулы 3 раза в сутки, Бактистатин 1 капсула 2 раза в сутки, Пробифор по 25–30 доз 3 раза в сутки, Бифиформ комплекс по 1 таблетке 2 раза в сутки) и пребиотиков (Хилак форте 40–60 капель 3 раза в сутки, Споробактерин 2–4 мл, Дюфалак в дозе 5–10 мл в сутки), длительность приема – 3–4 недели. Курсы следует проводить 2–3 раза в год.
Заключение
Неалкогольная жировая болезнь печени является основным фактором риска сердечно-сосудистых заболеваний. При НАЖБП в стадии стеатоза, а также при более выраженном цитолитическом синдроме целесообразна терапия ЭФЛ. При НАЖБП в стадии НАСГ и с признаками холестаза на основании данных клинического и лабораторного обследований необходимо назначать препараты УДХК. В комплекс гепатопротективной терапии больных НАЖБП с учетом патогенетических аспектов необходимо включать препараты, нормализующие кишечную микрофлору (кишечные антисептики, пре- и пробиотики).



