Проблема лучевой диагностики нейроэндокринных опухолей (НЭО) легких является одной из малоизученных в современной онкопульмонологии. НЭО – это гетерогенная группа новообразований, развивающихся из клеток диффузной нейроэндокринной APUD-(Amine Precursor Uptake and Decarboxylation)-системы. Эта система объединяет клетки, которые синтезируют биогенные амины, многочисленный класс пептидных гормонов и расположены практически во всех органах. Описано более 50 типов клеток APUD-системы (апудоцитов), которые продуцируют более 60 регуляторных пептидов и биогенных аминов. Самыми важными свойствами этих клеток являются поглощение предшественников аминов и декарбоксилирование [1].
В 1938 г. F. Feyrter впервые высказал предположение о том, что в эпителиальной выстилке дыхательных путей имеются клетки с эндокринной функцией [2]. Впоследствии было установлено присутствие апудоцитов в легочной ткани, изучены их функции, гистогенез, значение в развитии патологических процессов в легких, в т. ч. опухолей. Диффузная нейроэндокринная система бронхолегочного аппарата представлена как одиночными нейроэндокринными клетками, так и их скоплениями – нейроэпителиальными тельцами, обладающими разными морфологией и функциями: ССК клетки секретируют холецистокинин; ЕС-клетки – серотонин, мелатонин, гастрин-рилизинг фактор; Р-клетки – бомбезин, дофамин; D1-клетки – вазоактивный интестинальный пептид, лей-энкефалин; С-клетки – кальцитонин; D-клетки – соматостатин [3]. Установлено, что наиболее характерными маркерами нейроэндокринных элементов являются хромогранин А и синаптофизин. Маркером пролиферативной активности является антиген Ki-67 [3].
В соответствии с классификацией ВОЗ (2004) НЭО легких имеют различные гистологические варианты, характеризующиеся особенностями клинического течения [4]. Одним из вариантов НЭО легких являются карциноиды (типичный и атипичный), точная оценка степени атипии которых, дифференциальная диагностика с другими опухолями и патологическими процессам имеют большое практическое значение.
Современная классификации легочных НЭО [5] включает четыре подтипа опухолей:
- Типичный карциноид, характеризующийся высокой степенью дифференцировки и низким митотическим индексом.
- Атипичный карциноид с более высоким митотическим индексом (меньше 10/10 HPF) и отдельными участками очагового некроза.
- Крупноклеточная нейроэндокринная карцинома, которую бывает сложно отличить от атипичного карциноида; характеризуется большим митотическим индексом (> 10/10 HPF) и более распространенными некрозами.
- Мелкоклеточный рак легких – самая низкодифференцированная нейроэндокринная опухоль легких, называемая также классической “овсяноклеточной карциномой”. Митотический индекс очень высокий (больше 80/10 HPF) с обширными зонами некроза.
Европейским обществом по НЭО предложено выделение трех степеней злокачественности НЭО в зависимости не только от уровня дифференцировки опухоли, но и от ее внутренней биологической агрессивности с учетом числа митозов и показателя пролиферативной активности (Ki-67):
- G1-градация – число митозов < 2, Ki-67 < 2;
- G2 – число митозов – 2–20, Ki-67 – 3–20;
- G3 – число митозов > 20, Ki-67 > 20.
НЭО могут сопровождаться различными клиническими проявлениями с развитием карциноидного синдрома, синдрома Иценко–Кушинга или акромегалии. Следует отметить, что клиническая картина НЭО легкого не только сопровождается симптомами, связанными с продукцией гормонов [6, 7], но и зависит от клинико-анатомической формы роста опухоли [8].
В последние годы в связи с бурным развитием компьютерных технологий идет интенсивное изучение и внедрение в клиническую практику спиральной и мультиспиральной компьютерной томографии (МСКТ) в сочетании с методикой высокого разрешения и внутривенным контрастированием [9, 10]. Высокое контрастное разрешение и отсутствие суммационного эффекта позволили существенно расширить возможности выявления изменений в легочной ткани [11]. Вопросы дифференциальной лучевой диагностики опухолей легких основываются на комплексном изучении рентгенологической и компьютерно-томографической (КТ) картин [12–15]. КТ-исследование дает возможность уточнять характер, локализацию опухоли и позволяет выявлять особенности в рентгенологической картине НЭО [16].
В повседневной клинической практике наибольшие дифференциально-диагностические трудности возникают при оценке периферических образований в легких [17, 18], которые могут быть представлены злокачественными опухолями эпителиальной и неэпителиальной природы, туберкулезом, шаровидными пневмониями, абсцессами легких, ретенционными и паразитарными кистами, доброкачественными опухолями и редкими формами гранулематозов [19, 20]. В этих случаях для решения задач дифференциальной диагностики необходимо проведение морфологического исследования. Однако и при гистологическом исследовании часто возникают диагностические трудности, связанные с решением вопроса о принадлежности данной опухоли легких к новообразованиям нейроэндокринного типа и определением степени их атипии или злокачественности. В плане идентификации НЭО наиболее информативными являются электронная микроскопия (выявление специфических нейроэндокринных гранул) [21] и иммуногистохимическое определение нейроэндокринных маркеров (синаптофизин, хромогранин-А). Кроме того, на степень атипии или злокачественности указывают число митозов, индекс пролиферативной активности (Ki-67) [22] и скорость прохождения митотического цикла (аргирофильные белки областей ядрышковых организаторов) [23].
Перечисленные обстоятельства свидетельствуют об актуальности проблемы своевременной диагностики НЭО легких. В связи со сказанным целью данного исследования явилось совершенствование диагностики этого вида опухолей на основании комплексного применения лучевых методов с учетом морфологических (гистологических, электронно-микроскопических, иммуногистохимических) данных.
Материал и методы
Материалом для исследования послужил анализ данных комплексного клинико-рентгенологического обследования 130 больных карциноидом легких, наблюдавшихся в РОНЦ им. Н.Н. Блохина РАМН с 1986 по 2010 г. Изучены особенности клинико-рентгенологической картины типичных и атипичных карциноидов. Наибольшее число больных – 75 (57,7 %) составили пациенты в возрасте до 50 лет, до 30 лет – 18 (13,8 %), до 40 лет – 32 (24,6 %) больных. Средний возраст женщин был 41,9 года, т. е. на 10 лет меньше, чем у мужчин (p = 0,0003). Установлено, что карциноиды у женщин и мужчин встречаются почти с одинаковой частотой (49,9 и 51,1% соответственно). Диагностический алгоритм включал клиническое, лабораторное эндоскопическое обследования. Рентгенологическое исследование осуществлялось в прямой и боковой проекциях, МСКТ – в стандартном режиме и с внутривенным контрастированием. При морфологическом изучении проводили гистологическое, электронно-микроскопическое, иммуногистохимическое определение степени атипии данной группы опухолей.
Результаты
Клиническая симптоматика заболевания развивалась остро в 33,3 %, постепенно – в 42,4 % и скрыто – в 24,3% случаев. Период времени от появления первых признаков заболевания до установления окончательного диагноза колебался в среднем от 2,2 до 5,6 месяца. Четверо пациентов наблюдались в институте эндокринологии, из них у одной больной диагностирован карциноидный синдром, а у троих – клиническая картина сопровождалась развитием синдрома Иценко–Кушинга. При остром развитии болезни у 19 (13 %) больных клинические проявления заболевания сопровождались гектическим подъемом температуры тела. Из клинических признаков заболевания наиболее часто выявлялись кашель – 74,1 %, слабость – 47,0 %, повышение температуры тела – 46,6 %, боль в грудной клетке – 42,4 %, кровохарканье – в 16,5 % случаев. В одном случае отмечена осиплость голоса. Изменения со стороны желудочно-кишечного тракта у 5 больных проявлялись гастритом, дуоденитом, язвенной болезнью желудка и колитом. У 32 (24,6 %) пациентов в анамнезе имелись указания на частые пневмонии.
При изучении рентгенологических проявлений карциноидов легких в зависимости от характера роста опухоли выделено две их формы: центральная у 85 (65,4 %) и периферическая у 45 (34,6 %) больных. Следует отметить, что все пациенты с центральным карциноидом были достоверно моложе, чем с периферическим (p = 0,005).
По результатам морфологического исследования опухолей с учетом их гистологических, ультраструктурных и иммуногистохимических особенностей, числа митозов и показателя пролиферативной активности (Ki-67) в 58,9 % случаев выделены типичные, а в 41,1 % – атипичные карциноиды. При центральной локализации из 85 больных типичный карциноид установлен у 59 (69,4 %), атипичный – у 26 (30,6 %) пациентов. При периферической локализации из 45 больных типичный карциноид диагностирован у 25 (55,6 %), атипичный – у 20 (44,4 %) пациентов.
Центральный карциноид
Характер роста опухоли относительно стенки бронха в зависимости от гистологического варианта карциноида представлен на рис. 1, из которого следует, что эндобронхиальный рост опухоли наблюдается преимущественно у типичных карциноидов.
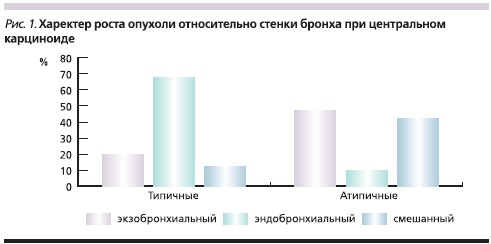
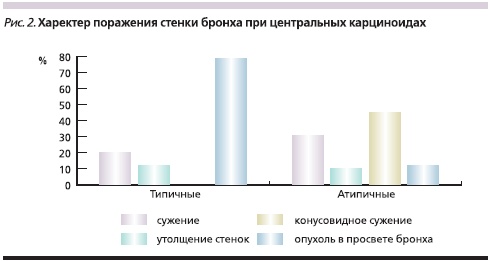
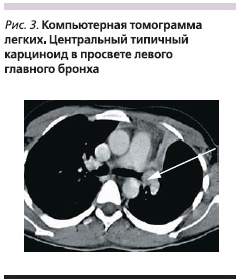
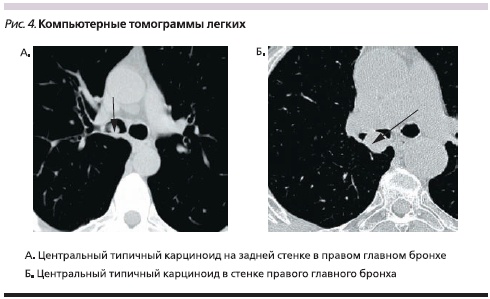
Изучение рентгенологической и КТ-симптоматики центральных карциноидов легких у 85 больных позволило выявить различный характер поражения бронхов при типичных и атипичных карциноидах, что представлено на рис. 2, из которого видно, что при типичных карциноидах в 67,5 % наблюдений опухоль выявлялась в просвете бронха. Из них в 74,1 % наблюдений свободный край опухоли больше, чем ее основание, вдавался в просвет бронха, в 40,7 % случаев перекрывая его частично и в 33,3 % – полностью. Культя имела вид обрубленного бронха с выпуклой линией обрыва, направленной в сторону главного бронха. В одном наблюдении размер опухоли превысил диаметр бронха, и последний приобрел вид раструба (рис. 3). В 25,9 % наблюдений опухоль широким основанием исходила из стенки бронха, имела гладкие очертания, выступала в просвет бронха и перекрывала его, оставляя узкую щель вдоль противоположной стенки (рис. 4). При типичной форме карциноида в 17,5 % случаев отмечен экзобронхиальный рост, внутрибронхиальная часть опухоли имела гладкую, четко очерченную поверхность на фоне воздушного столба; в 15,0 % случаев определено неравномерное сужение просвета бронха и утолщение его стенок.
При атипичном карциноиде сужение просвета бронха установлено в 31,8 %, неравномерное утолщение стенок бронха – в 9,1 %, конусовидное сужение – в 45,5 % случаев. Обтурация просвета опухолью наблюдалась в 13,6 % случаев, когда часть опухоли полуовальной формы в виде “айсберга” располагалась в просвете бронха, прорастала стенку и, разрушая хрящевую пластинку, проникала в окружающую легочную ткань.
При центральных карциноидах нарушение бронхиальной проходимости выявлено в 48,4 % наблюдений, среди которых гиповентиляция встречалась в 27,4 %, ателектаз – в 21,0 %, воспаление в гиповентилированной доле – в 22,6 % случаев.
Увеличение лимфатических узлов в корне легкого отмечено в 68,2 %, а в средостении – в 31,8 % наблюдений. Причем в 22,7 % случаев опухолевый конгломерат увеличенных лимфатических узлов корня легкого сливался с лимфатическими узлами средостения (рис. 5, 6). В среднем и верхнем этажах центрального средостения увеличенные лимфатические узлы выступали в правое легочное поле. Раннее распространение опухолевого процесса в медиастинальные лимфатические узлы явилось в данном случае причиной диагностической ошибки на поликлиническом этапе обследования. Это повлекло назначение непоказанной гормональной терапии по поводу предполагаемого саркоидоза внутригрудных лимфатических узлов. При этом время наблюдения от момента первых признаков заболевания до установления окончательного диагноза увеличилось до 4 месяцев. Одностороннее увеличение внутригрудных лимфатических узлов является характерным признаком метастатического поражения, в то время как при саркоидозе внутригрудные лимфатические узлы увеличены, как правило, с обеих сторон. Целенаправленное лучевое обследование с использованием компьютерной томографии позволило четко обнаружить опухолевый узел в нижней доле правого легкого.
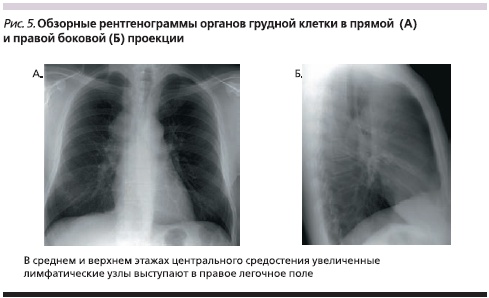
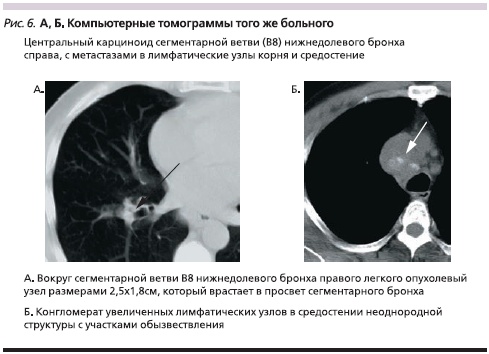
Анализ результатов исследования показал, что наиболее полное представление о размерах и распространенности опухолевого процесса в легком было получено при использовании лучевых методов исследования, в то время как при эндоскопическом исследовании удавалось обнаружить лишь внутрибронхиальный компонент опухоли.
Периферический карциноид
При морфологическом анализе типичный карциноид диагностирован в 55,6 %, атипичный – в 44,4 % случаев.
Рентгенологическая семиотика периферического карциноида легкого изучена в 45 наблюдениях, из них в 66,7 % случаев опухоль локализовалась в правом, в 33,3 % – в левом легком. Установлено, что характерными рентгенологическими признаками типичных периферических карциноидов являются небольшие размеры выявленных фокусов, которые не превышали 3,0 см в диаметре и встречались в 75,1 % наблюдений; фокусы с размером до 5,0 см в наибольшем измерении были отмечены в 17,8 %, свыше 5,0 см – в 7,1 % случаев. Округлая форма узловых образований выявлена в 60,7 %, овальная – в 32,2 % наблюдений. Фокусы, состоявшие из слившихся между собой очагов с четкими неровными контурами, отмечены в 10,7 % случаев, в то время как фокусы с гладкой поверхностью – в 60,7 %. В группе больных типичным карциноидом четкие ровные контуры опухоли были обусловлены наличием капсулы вокруг опухоли в 68,7 % случаев. Структура опухолевых образований была однородной в 78,6 % наблюдений. Неоднородность ее в 14,3 % случаев была обусловлена многоузловатостью, а в 7,1 % – мелкими известковой плотности включениями. Ни в одном случае участков деструкции в опухоли выявлено не было. Окружающая легочная ткань оставалась интактной. Внутригрудные лимфатические узлы не были увеличены.
При атипичных периферических карциноидах рентгенологическая картина зависела от фазы развития опухоли. При централизации опухолевого процесса медиальный контур в 21,4 % наблюдений был нечетким, лучистым, с редкими тяжами за счет перибронхиального распространения опухоли в сторону корня легкого. Большие трудности в дифференциальной диагностике между опухолями эпителиальной и неэпителиальной природы вызывала нечеткость контуров образования. Контуры опухолевых узлов в 25 % наблюдений были четкие, но неровные, поверхность их бугристая, с редкими короткими тяжами по периферии. Поверхность выявляемых узловых образований была мелкобугристой в 17,8 %, крупнобугристой – в 57,2 % случаев. Нечеткость контуров в виде лучистости по всему периметру опухолевого образования определялась в 7,1 % случаев, с такой же частотой отмечена нечеткость контуров по одной какой-либо полуокружности – чаще медиальной.
При атипичных периферических карциноидах в двух наблюдениях обнаружены метастазы в противоположное легкое, в одном из них – в сочетании с множественными метастазами в печень. При субплевральном расположении опухолевого узла в 7,2 % случаев выявлено втяжение висцеральной плевры, в 10,7 % – неравномерное утолщение прилежащих отделов реберной плевры. Распространение опухолевой ткани непосредственно на грудную стенку отмечено только в одном наблюдении (рис. 7).
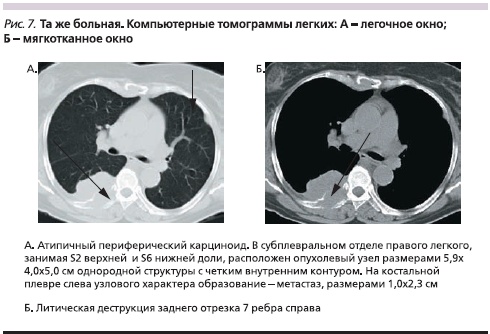
Темпы роста периферических узлов обычно различались даже при типичных карциноидах. Увеличение размеров опухолевого узла на 2 мм за месяц отмечено в 6,3 %, а за 5 месяцев – в 87,4 % наблюдений. У одного пациента размеры опухоли оставались стабильными в течение 7 месяцев, а за последующие 15 месяцев увеличились на 7 мм. При атипичном карциноиде в одном наблюдении за месяц опухолевый узел увеличился в размере на 15 мм в диаметре. При этом появились четко видимые увеличенные лимфатические узлы в корне легкого.
Сопоставление полученных рентгенологических и морфологических данных позволило установить, что при атипичных периферических карциноидах распространение опухолевого процесса на субсегментарные и сегментарные бронхи отмечено в 83,3 %, а при типичных – в 37,7 % наблюдений. При атипичных периферических карциноидах в двух наблюдениях опухоль, расположенная экстрабронхиально, проросла стенку долевого бронха и в виде “айсберга” расположилась в просвете бронха наименьшей своей частью. При центральных карциноидах локализация опухоли в бронхе была весьма разнообразной. В одних случаях опухоль исходила из сегментарного бронха и распространялась на долевой, в других случаях она исходила из устья верхнедолевого бронха и спускалась как бы на “ножке” в нижнедолевой бронх.
Обсуждение
При проведении дифференциальной диагностики карциноидов с другими злокачественными новообразованиями легких необходимо обращать внимание не только на рентгенологические данные, но и на пол, а также на возраст больных, что имеет значение для оценки характера патологического процесса в легких.
При сравнительном анализе обследованных больных по возрастному показателю установлено, что карциноиды превалируют в возрастной группе до 50 лет (75,8 % случаев), в то время как рак легкого в 64,0 % случаев выявлялся у больных старше 50 лет. Установлено, что у женщин карциноиды встречаются чаще (49,9 % случаев), чем рак легкого (27,3 %; p = 0,01); кроме того, женщины были моложе мужчин на 10 лет (p = 0,0003).
Анализ результатов рентгенологического исследования позволил выделить ряд значимых рентгенодиагностических симптомов, которые позволяют отличать карциноид от периферических эпителиальных злокачественных, а также доброкачественных опухолей легких:
- Для карциноида легкого более характерна центральная локализация процесса (68,8 %).
- Все обследованные больные центральными карциноидами были достоверно моложе, чем пациенты с периферическими карциноидами (р = 0,005).
- При центральном росте карциноидные опухоли наиболее часто локализуются в промежуточном бронхе (40,4 %), в то же время в главном бронхе они составляют 19,4 %, а в верхне-, нижне- и среднедолевом – по 12,9 % случаев в каждом.
- Эндобронхиальный характер роста опухоли установлен в 44,1 %, экзобронхиальный – в 30,9 %, смешанный – в 25,0 % наблюдений.
- Для центральной локализации типичного карциноида легких более характерно наличие эндобронхиального роста опухоли. Обычно опухоль имела полиповидную форму, выступала в бронх или обтурировала просвет бронха (30 %).
- При центральном карциноиде в просвете бронха выявляется опухоль полуокруглой или полуовальной формы, которая растет в виде “айсберга”. При этом часть опухоли располагается в просвете бронха, прорастает его стенку, разрушает хрящевую пластинку и проникает в окружающую легочную ткань.
При атипичном карциноиде в результате инфильтративного роста опухоль вызывает неравномерное (31,8 %) или коническое (45,5 %) сужение просвета бронха. Это обстоятельство в 84,6 % случаев затрудняет проведение дифференциальной диагностики с бронхогенным раком. Вовлечение в процесс бронха в 46,4 % случаев развивалось в результате прорастания опухоли из экзобронхиально расположенного опухолевого узла. При этом патологические изменения ограничивались лишь местным распространением опухоли.
Следует отметить, что размер первичной опухоли не отражает реальной степени распространенности процесса, которая зависит от гистологического строения карциноида.
Для периферического карциноида при проведении дифференциальной диагностики большое значение имеют такие признаки, как структура, интенсивность, характер контуров и темпы роста опухоли. При карциноидах однородная структура установлена в 78,6 %, гладкая поверхность – в 60,7 %, округлая форма – в 60,7 % выявляемых узловых образований. Указанные рентгенологические признаки в сочетании с выраженной интенсивностью (32,1 %) и четкими контурами (39,3 %) на фоне неизмененной окружающей легочной ткани позволяют с большой долей вероятности устанавливать диагноз карциноида. Дополняет диагностическую информацию в пользу карциноида овальная (32,1 %) или грушевидная (7,2 %) форма образования в сочетании с крупнобугристой его поверхностью и четкими очертаниями, а также обызвествлением в толще опухоли в 7,1 % случаев.
Ведущими дифференциально-диагностическими признаками при периферическом типичном карциноиде является интенсивное, овальной или неправильной формы образование, которое располагается рядом с сегментарным или долевым бронхом или же вдоль бронхо-сосудистого пучка. Растущая опухоль может состоять из одного или нескольких слившихся между собой узлов. Причем в одних наблюдениях узлы сливаются между собой и дают картину шаровидного образования с крупнобугристой поверхностью, в других случаях приобретают неправильную форму, располагаясь по длине вдоль бронхо-сосудистого пучка.
Оценка выявленных периферических образований в легких вызывала большие диагностические трудности, которые особенно возрастали при сочетании неоднородной структуры и четкости контуров, а также однородной структуры и нечеткости контуров опухолевого узла. Большие диагностические затруднения возникали в случаях присоединения изменений со стороны бронхиального дерева в виде конического сужения просвета бронха или обтурации его опухолью. В подобных ситуациях возникала необходимость дифференциальной диагностики с периферическим или центральным раком легкого и доброкачественными образованиями.
Такие рентгенологические симптомы, как четкость контуров, гладкая поверхность образования, участки обызвествления в толще опухоли, становились причиной диагностических ошибок при доброкачественных опухолях легких в 6,7 % наблюдений.
Выявление единичных коротких тонких тяжей по контуру образования затрудняло дифференциальную диагностику с периферическим раком легкого. В случаях неуверенности в варианте опухоли (рак/карциноид) выставлялся диагноз злокачественной опухоли, что влияло на выбор дальнейшей тактики ведения и лечения больного. Правильная оценка рентгенологической семиотики периферических карциноидов позволяет повысить уровень их диагностики.
Заключение
На основании изучения клинической картины и рентгенологических проявлений карциноида легкого у 130 больных установлено, что большинство – 75 (57,7 %) – составили пациенты в возрасте до 50 лет, из них до 30 лет – 18 (13,8 %), до 40 лет –32 (24,6 %) больных. При карциноидах легочной локализации преобладала центральная форма роста опухоли (65,4 %), реже отмечалась периферическая форма (34,6 %). При центральной локализации опухоли имело место преимущественное поражение промежуточного бронха (40,4 %).
Характерным рентгенологическим признаком типичного центрального карциноида легкого являлось эндобронхиальное расположение опухоли (67,5 %), которая исходила из стенки узким (74,1 %) или широким (25,9 %) основанием. Опухоль имела гладкую, четко очерченную поверхность на фоне воздушного бронхиального просвета, вдавалась в бронх или перекрывала его полностью.
При атипичном карциноиде одинаково часто отмечался экзобронхиальный и смешанный рост опухоли (46,4 и 42,9 % соответственно), что в 31,8 % случаев сопровождалось неравномерным сужением бронха, в 31,7 % – конусовидным сужением бронха в виде остроконечной культи, в виде “айсберга” опухоль располагалась в просвете бронха в 13,6 % случаев.
Локализация опухоли в бронхе, медленные темпы роста вели к появлению признаков нарушения бронхиальной проходимости – гиповентиляции или ателектаза в дистально расположенных участках легкого, что нередко сопровождалось развитием вторичных воспалительных процессов. Именно это обстоятельство в 22,1 % случаев было причиной диагностических ошибок на поликлиническом этапе обследования.
Для периферического типичного карциноида характерны медленные темпы роста, однородная структура (78,6 % случаев), а также гладкая поверхность и округлая форма узловых образований (60,7 %). Указанные рентгенологические признаки в сочетании с выраженной интенсивностью (32,1 %) и четкими контурами образования (39,3 %) на фоне неизмененной окружающей легочной ткани позволяют с большей долей вероятности диагностировать периферический карциноид.
При анализе скиалогической картины атипичного карциноида в результате инфильтративного роста опухоли в 84,6 % случаев могут возникать большие трудности при проведении дифференциальной диагностики с периферическим и центральным раком легкого. Ошибки при проведении дифференциальной диагностики с доброкачественными опухолями, в частности с гамартомами, в 14,3 % случаев обусловлены неоднородностью структуры за счет многоузловатости, в 7,1 % – мелкими, известковой плотности включениями.
Необходимо отметить, что острое начало заболевания, сопровождающееся болью, кашлем, одышкой и гектической температурой тела, не может быть основанием для исключения злокачественного процесса.
Информация об авторах:
Алексеева Тамара Рубеновна – доктор медицинских наук, ведущий научный сотрудник отдела лучевой диагностикии рентгенохирургических методов лечения НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-45-06, 324-63-78, e-mail: toma@xrayblog.ru;
Смирнова Елена Александровна – доктор биологических наук, профессор лаборатории гистохимии и электронной микроскопииотдела патологической анатомии опухолей человека НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН;
Чистякова Ольга Васильевна – кандидат медицинских наук, ведущий научный сотрудник лаборатории клиническойцитологии НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН;
Райхлин Натан Танфельевич – доктор медицинских наук, профессор лаборатории гистохимии и электронноймикроскопии отдела патологической анатомии опухолей человека НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН;
Волова Наталья Львовна – клинический аспирант отдела лучевой диагностики и рентгенохирургических методовлечения НИИ клинической онкологии ГУ РОНЦ им. Н.Н. Блохина РАМН



