В отечественных и зарубежных исследованиях доказано, что риск неблагоприятных исходов беременности у женщин с сахарным диабетом 1 типа (СД1) выше по сравнению с общей популяцией [1, 3–6, 8–10, 13]. Многие материнские и перинатальные осложнения зависят от декомпенсации углеводного обмена [12, 16, 19], а хороший метаболический контроль позволяет снизить их частоту [7, 14, 15, 18]. К сожалению, поддерживая жесткий контроль гликемии (см. таблицу), не удается избегать гипогликемических эпизодов, которые без адекватного лечения могут стать причиной серьезных осложнений со стороны матери и плода.

Так, гипогликемия у беременной женщины может служить причиной нарушения сознания, развития комы и даже ее гибели. Часто повторяющиеся эпизоды гипогликемии способны приводить к прогрессированию диабетической ретинопатии и нарушению когнитивных функций. Наибольшее число гипогликемических эпизодов имеет место с 7-й по 15-ю неделю беременности [17] по следующим причинам:
- интенсифицированная инсулинотерапия (ИИТ), направленная на обеспечение целевой нормогликемии (см. таблицу);
- повышенная чувствительность к инсулину;
- нарушение контррегуляционного гормонального ответа на гипогликемию;
- снижение клиренса инсулина;
- тошнота;
- рвота.
Частые гипогликемии матери могут служить причиной внутриутробной задержки развития плода, нарушения у него сердечного ритма [11, 17]. Кроме того, лечение гипогликемии часто проводиться путем приема легкоусвояемых углеводов в избыточном количестве, что сопровождается рикошетной длительной гипергликемией и является причиной развития многоводия, отечности и макросомии плода. Следовательно, одним из условий обеспечения компенсации СД1 во время беременности является не только подбор оптимальной инсулинотерапии, сводящей к минимуму пики гипергликемии и риск развития гипогликемий, но и обучение пациенток грамотному лечению и профилактике гипогликемий.
Целью нашего исследования явилась оценка эффективности лечения и профилактики гипогликемии у женщин с СД1 в первой половине беременности с помощью таблеток d-глюкозы (декстрозы) по сравнению с привычными методами лечения легкоусвояемыми углеводами, а также выявление развития рикошетной гипергликемии после купирования гипогликемии.
Материал и методы
В исследовании приняли участие 80 беременных, страдавших СД1. Возраст женщин составил 26 (24–28) лет, длительность заболевания – 14,5 (7,5–21) лет, срок беременности на момент начала исследования – 15 (6–22) недель. Степень компенсации СД1 оценивали по уровню гликозилированного гемоглобина (HbA1c), который составил 6,3 % (6,1–6,8 %). ИИТ ультракороткими аналогами инсулина и пролонгированными инсулинами НПХ (нейтральный протамин Хагедорна) или инсулином детемир получали 56 женщин. Остальные 24 находились на постоянной подкожной инфузии инсулина (ППИИ) с использованием ультракоротких аналогов. Исследование продолжалось 20 дней.
Клинически подтвержденной гипогликемией считали снижение уровня глюкозы крови < 3,5 ммоль/л. По степени тяжести гипогликемии разделяли на легкие и тяжелые. Легкой гипогликемией считали снижение уровня глюкозы крови < 3,5 ммоль/л с наличием симптомов гипогликемии или без них, купируемое самостоятельным приемом легкоусвояемых углеводов. К основным симптомам гипогликемии относились внезапное чувство голода, потливость, озноб, тремор рук, дрожь, слабость, бледность, чувство страха, изменение настроения, раздражительность. Тяжелой гипогликемией считали эпизод снижения содержания сахара в крови с потерей или без потери сознания, требующий помощи другого лица для купирования симптомов гипогликемии.
Для лечения гипогликемии пациенткам было рекомендовано принимать 3 таблетки d-глюкозы (12 г декстрозы) или 1 ХЕ (хлебную единицу) легкоусвояемых углеводов (сок, сахар, фрукты с высоким гликемическим индексом, мед, сладкие молочные продукты). Если через час после приема пищи гликемия оставалась на препрандиальном уровне или находилась в диапазоне 3,5–4,5 ммоль/л, то для профилактики гипогликемии было рекомендовано принимать 1–2 таблетки d-глюкозы (4–8 г декстрозы) или 0,5–1 ХЕ легкоусвояемых углеводов.
Результаты лечения гипогликемии оценивали по данным дневника самоконтроля и данным анкетирования (для проведения самоконтроля гликемии применялись глюкометры АккуЧек). Измерение глюкозы проводили через 15 минут и через час после эпизода гипогликемии. Все пациентки до участия в исследовании были обучены в школе больных СД1.
Для статистической обработки материала использовали программу Statistica 8.0 для Windows. Данные представлены в виде медианы (верхний и нижний квартили). Для анализа нормальности распределения использовали критерий Шапиро–Уилка, для сопоставления групп – t-критерий Стьюдента. Вероятность того, что статистические выборки отличались друг от друга, существовала при p < 0,05.
Результаты и обсуждение
За время исследования было зафиксировано 243 эпизода гипогликемии, из них 53 эпизода на фоне действия базального инсулина, а 190 – после введения болюса. Сто сорок четыре эпизода гипогликемии были купированы таблетированной декстрозой, а 99 – легкоусвояемыми углеводами. При этом число таблеток декстрозы или количество углеводов пищи, требуемое для купирования гипогликемии, в группах ППИИ или ИИ не различалось.
Последнее измерение сахара крови до возникновения эпизода гипогликемии было на уровне 5,7 (5,0–6,7) ммоль/л, продолжительность времени от его измерения до возникновения гипогликемии составило 5 (2–9) часов. Зарегистрированный уровень сахара крови во время эпизода гипогликемии равнялся 3,2 (2,8–3,5) ммоль/л и был достоверно ниже (p < 0,05) по сравнению с предпоследним измерением. После приема декстрозы уровень гликемии через 15 минут составил 4,5 (4,1–5,0) ммоль/л, что было достоверно выше, чем во время эпизода гипогликемии (p = 0,0001), и по сравнению с уровнем гликемии через 15 минут после приема типичной пищи, который равнялся 4,2 (3,8–4,6) ммоль/л (p = 0,0227). Сахар крови через 60 минут от зарегистрированного эпизода гипогликемии составил 5,2 (4,3–5,85) ммоль/л после приема декстрозы, что достоверно ниже (p = 0,0001) уровня гликемии через 60 минут после приема легкоусвояемых углеводов: 7,6 (6,8– 8,8) ммоль/л (рис. 1).
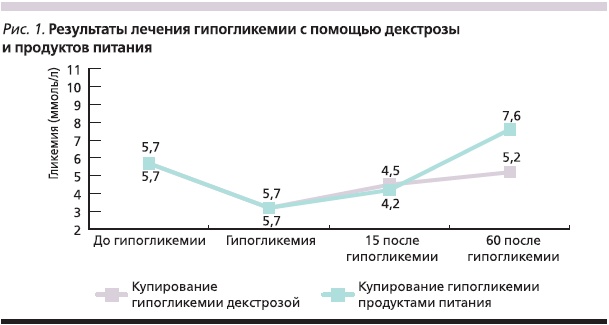
Уровни гликемии через 15 и 60 минут после приема декстрозы или еды были достоверно выше значения сахара крови во время гипогликемии (p < 0,05) и достоверно различались между собой (p < 0,05, рис. 1).
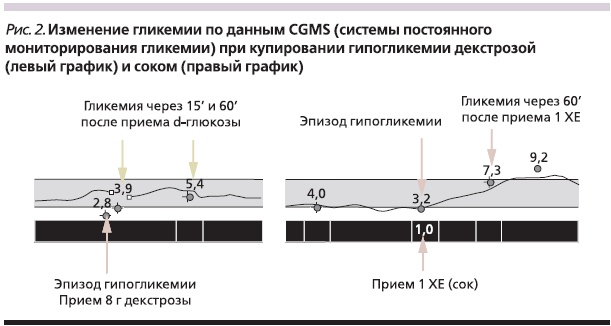
Интерквартильный ранг гликемии через 15 минут после гипогликемии, представленный на рис. 2, показывает, что уровень сахара крови после купирования гипогликемии обыкновенной едой повышается до целевых значений медленнее, чем после приема декстрозы. Полученные результаты обусловлены тем, что декстроза состоит из одной молекулы и ей не требуется переваривания в желудочно-кишечном тракте в отличие от сахарозы, состоящей из двух молекул глюкозы и фруктозы или других длинноцепочечных углеводов [2]. Обращает на себя внимание вариабельность гликемии через 60 минут после купирования эпизода гипогликемии с помощью приема пищи (рис. 3). Максимальные значения доходили до 10,6 ммоль/л, а 50 % измерений находились в пределах от 6,8 до 8,8 ммоль/л, что превышает рекомендуемые целевые пределы гликемии в течение дня (перед едой) во время беременности [11].

Заключение
Декстроза быстрее, чем обычные продукты, повышает уровень сахара в крови до целевых значений через 15 минут после гипогликемии. В отличие от обычной еды после приема декстрозы нет рикошетной гипергликемии, ухудшающей компенсацию углеводного обмена во время беременности.
Информация об авторах:
Арбатская Наталья Юрьевна – кандидат медицинских наук, врач-эндокринолог КДЦ ГКБ № 1
им. Н.И. Пирогова, ассистент кафедры эндокринологии и диабетологии ФУВ ГОУ ВПО РГМУ Росздрава.
E-mail: narbatskaya@yandex.ru;
Тиселько Алена Викторовна – кандидат медицинских наук, врач-эндокринолог отдела эндокринологии
репродукции НИИ акушерства и гинекологии им. Д.О. Отта СЗО РАМН.
E-mail: alenadoc@mail.ru;
Игнатова Надежда Геннадьевна – врач-эндокринолог КДЦ ГКБ № 1 им. Н.И. Пирогова.
E-mail: ignatova_nadia@mail.ru


