В развитых странах в структуре онкологической заболеваемости женщин рак молочной железы (РМЖ) занимает 1-е или 2-е место и составляет 20–25 % всех случаев рака [2]. Усовершенствование ранней диагностики и использование адъювантной терапии существенно улучшили результаты лечения больных ранним РМЖ. Однако более чем у половины пациенток с РМЖ на том или ином этапе заболевания развиваются отдаленные метастазы.
Метастатический РМЖ (мРМЖ) является неизлечимым заболеванием, однако современные лечебные подходы позволяют достигать у больных клинически значимого регресса опухолевого процесса [1]. Современные схемы комбинированной химиотерапии (ХТ) позволяют добиваться выраженного клинического эффекта у 50–60 % больных диссеминированным РМЖ при средней продолжительности ремиссии 6–14 месяцев и медиане продолжительности жизни с момента начала лечения около 2 лет [1, 2].
У больных РМЖ с распространенным опухолевым процессом и висцеральными поражениями предпочтительнее использовать в первой линии лечения комбинации, включающие антрациклины и таксаны. Во второй линии терапии применяются препараты, не обладающие перекрестной резистентностью, к числу которых относится капецитабин.
Противоопухолевый препарат, антиметаболит капецитабин – производное фторпиримидина карбамата, представляет собой цитостатик для приема внутрь, активирующийся в ткани опухоли и оказывающий на нее селективное цитотоксическое действие. Перорально назначаемый капецитабин предоставляет врачам возможность лечить пациентов с РМЖ с таким же эффектом, как это обеспечивают длительные инфузии фторурацила, но без осложнений и расходов, связанных с парентеральным введением последнего и применением инфузионных насосов [1, 5, 6, 8]. Капецитабин был одобрен в 1998 г. Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (FDA) в монотерапии мРМЖ, резистентных к паклитакселу и антрациклинам, а также для лечения больных РМЖ, резистентных к паклитакселу, которым противопоказано назначение антрациклинов. В настоящее время препарат применяют как в монотерапии, так и в комбинации с другими цитостатиками, такими как доцетаксел, цисплатин, винорелбин и др. [3, 4, 5, 7].
Целью нашего исследования являлась оценка эффективности препарата Кселода производства компании Ф. Хоффманн Ля-Рош Лтд., Швейцария при лечении мРМЖ и связанной с его применением токсичности [3].
Материал и методы
В исследование было включено 63 пациентки с генерализацией РМЖ, находившихся на лечении в РНИОИ с 2000 по 2010 г., в возрасте от 30 до 80 лет (табл. 1).
Таблица 1. Распределение больных РМЖ по возрасту.
Самой многочисленной была группа больных в возрасте 50–59 лет (38 %). Женщины в возрасте 50 лет и старше составили более половины больных – 37 (58 %).
Менструальная функция была сохранена у 17,5 % пациенток. У остальных отмечена менопауза различной продолжительности: менее года – 17,5 %, 1–5 лет – 23,8 %, 5–10 лет – 19 %, более 10 лет – 20,6 %. Овариэктомия была проведена 14 (22,2 %) пациенткам, в т. ч. двум по поводу метастазов в яичники и 12 – для устранения действия эстрогенов.
По морфологическому строению опухоли преобладал инфильтрирующий протоковый рак – 92 %, остальные гистологические типы были представлены слизистым и медуллярным раком.
Исходно больные мРМЖ имели различные стадии заболевания: I – 7 (11,1 %), II – 23 (36,5 %), III – 28 (44,4 %), IV – 5 (7,9 %). Однако к началу проводимой нами терапии у всех пациенток имел место распространенный опухолевый процесс. Минимальное время от окончания ранее проведенного лечения до прогрессирования в исследуемой группе составило 2,5 месяца, максимальное – 16 лет. У 78 % больных в метастатический процесс было вовлечено более 2 органов и систем. Среди 14 пациенток с поражением одного органа в пяти случаях определены метастазы в печень, в пяти – в легкие, в трех – в кости, в одном – в надключичные лимфоузлы. При наличии нескольких метастатических очагов наблюдалась практически одинаковая частота поражения: печени – 33 (52,3 %), легких – 32 (50,8 %) и костей – 30 (47,6 %). Отмечено также частое поражение мягких тканей, имевшее место у 21 пациентки (33,3 %).
Препарат Кселода применялся в составе 3-й и последующих линий терапии мРМЖ – в основном при прогрессировании заболевания на фоне применения антрациклинов и/или таксанов [6]. Препарат назначался в дозе 1250 мг мг/м2 2 раза в сутки в течение 14 дней с перерывами в 7 дней. За исследуемый период пациенткам было проведено 266 курсов ХТ с использованием различных схем лечения (табл. 2).
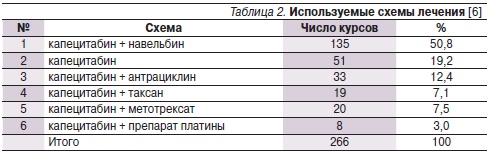
Чаще всего использовали схему Кселода + навельбин (50,8 %), в монорежиме Кселоду применяли в 19,2 % курсов. Больным проводили от 2 до 6 курсов ХТ, терапию продолжали до достижения максимального эффекта или прогрессирования. В результате 28 пациенткам было проведено 6 курсов, 12 (в связи с прогрессированием) – только 2 курса, остальные больные пациентки получали по 3–4 курса ХТ.
Во время контрольного осмотра каждой больной проведено физикальное и общепринятое лабораторное обследования.
Анализ общей (ОВ) и безрецидивной выживаемости (БРВ) по Каплану–Майеру проведен с использованием программы STATISTICA 6.0 в двух группах больных. Статистическую значимость различий в выживаемости оценивали с помощью Log-Rank тест.
Результаты
Объективный ответ на проводимое лечение получен среди 40 (63,5 %) пациенток, в т. ч. у 4 (6,3 %) больных была достигнута полная ремиссия, 6 (9,5 %) – частичная и у 30 (47,6 %) – стабилизация процесса. У 23 (36,5 %) больных наблюдалось прогрессирование опухолевого процесса. Необходимо отметить, что прогрессирование отмечено среди пациенток с множественными метастазами в печень, легкие и головной мозг.
Медиана ОВ наблюдавшихся больных составила 9 месяцев (рис. 1), а медиана БРВ – 5 месяцев (рис. 2).
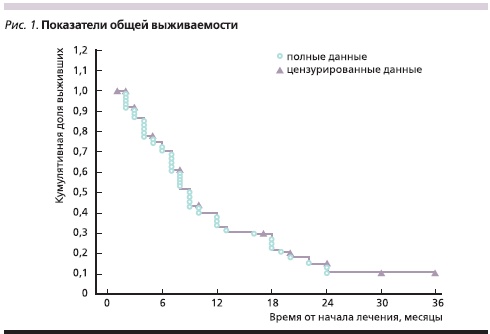
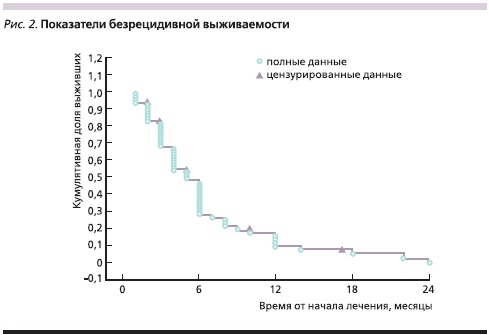
Для более детальной оценки ОВ и БРВ участницы исследования были разделены на две группы – с объективным ответом (эффектом) на лечение и с прогрессированием процесса.
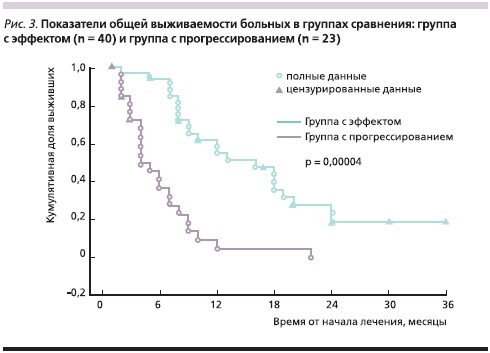
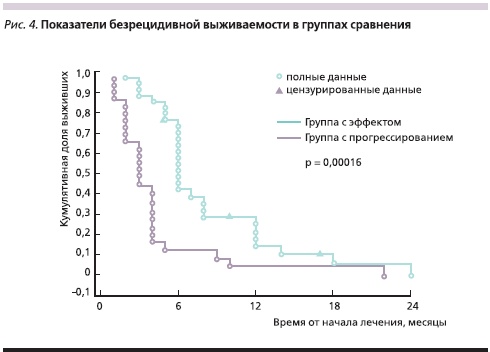
В группе с эффектом от проводимой терапии медиана ОВ составила 13 месяцев, а в группе с прогрессированием заболевания – 4 месяца (р = 0,00004; рис. 3). Медиана БРВ в группе с эффектом была равна 6, а в группе с прогрессированием – 3 месяцам (р = 0,00016; рис. 4). Живы на момент подготовки статьи 8 (12,7 %) пациенток.
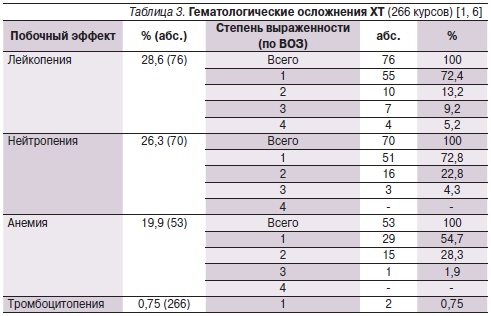
При изучении токсичности проводимой ХТ было проанализировано 266 курсов.
Гематологическая токсичность была представлена в основном лейкопенией (28,6 %) и нейтропенией (26,3 %), преимущественно 1 и 2 степеней (табл. 3). Случаев фебрильной нейтропении не было отмечено ни у одной пациентки. Анемия также главным образом 1 и 2 степени развивалась на фоне 19,9 % курсов ХТ. Тромбоцитопения I степени тяжести за время проведения исследования зарегистрирована у двух пациенток. Лечение гематологической токсичности проводилось общепринятыми методами.
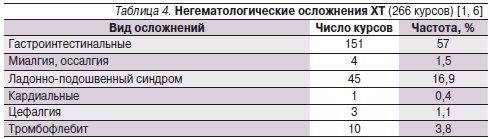
Негематологические осложнения представлены в табл. 4. Из их числа преобладали гастроинтестинальные осложнения – 57 %. Чаще всего наблюдались тошнота – 28,5 %, рвота – 12,5 % и диарея – 16,0 %. Проявление ладонно-подошвенного синдрома имели 1–2 степени выраженности и не требовали коррекции проводимой терапии [1, 6].
У одной пациентки лечение Кселодой было прекращено на 4-е сутки из-за выраженных диспепсических явлений (тошноты и рвоты), а также головной боли и головокружения, которые купировались после отмены препарата.
Заключение
Полученные в исследовании данные по частоте объективного ответа, ОВ и БРВ подтверждают мнение многих авторов об эффективности применения препарата Кселода (капецитабин) в группе больных мРМЖ, ранее получавших лечение антрациклинами и/ или таксанами, а так же увеличение продолжительности выживаемости [1, 3, 9].
Проведенный анализ применения препарата Кселода в монотерапии и в сочетании с другими препаратами показал, что он характеризуется хорошей переносимостью, минимальными токсическими проявлениями, которые купируются применением адекватной симптоматической терапии. Исходя из этого, Кселоду можно использовать в лечении пожилых больных, в амбулаторном режиме и у ослабленных пациентов.
Информация об авторах:
Владимирова Любовь Юрьевна – доктор медицинских наук, профессор, руководитель отделения химиогормонотерапии ФГУ “Ростовский научно-
исследовательский онкологический институт” Министерства здравоохранения и социального развития РФ.
Тел. 8 (8863) 2-955-374, e-mail: vlu@aaanet.ru;
Попова Ирина Леонидовна – кандидат медицинских наук, научный сотрудник отделения химиогормонотерапии ФГУ “Ростовский научно-
исследовательский онкологический институт” Министерства здравоохранения и социального развития РФ.
Тел. 8 (8863) 2-538-546


