Аллергические заболевания имеют тенденцию к росту в современном мире. Так, аллергический ринит (АР) встречается у 20–30 % взрослых и до 40 % детей.
Основными препаратами в лечении аллергических заболеваний являются антигистаминные средства – антагонисты Н1-гистаминовых рецепторов (Н1-блокаторы). В настоящее время класс Н1-блокаторов существенно пополнился новыми препаратами 2-го поколения, которые представлены их метаболитами (иногда их называют 3-м поколением Н1-блокаторов): дезлоратадином, левоцетиризином, фексофенадином.
Классификация Н1-блокаторов:
1. 1-е поколение:
- дифенгидрамин;
- хлорфенамин;
- бромфенирамин;
- гидроксизин.
2. 2-е поколение:
- лоратадин;
- цетиризин.
- Метаболиты препаратов 2-го поколения:
- дезлоратадин;
- левоцетиризин;
- фексофенадин.
К настоящему времени установлено четыре подтипа гистаминовых рецепторов, выполняющих в организме различные функции (табл. 1) [1]. При аллергических заболеваниях взаимодействие аллергенов с иммуноглобулином Е (IgЕ) на поверхности тучных клеток приводит к их дегрануляции и высвобождению гистамина, других провоспалительных медиаторов. Через Н1-гистаминовые рецепторы реализуется реакция немедленной гиперчувствительности и аллергического ответа.
Таблица 1.Функции гистаминовых рецепторов.
Современное представление о механизме действия антагонистов Н1-рецепторов связано с конформацией и стабилизацией Н1-рецепторов внеактивном состоянии (обратный агонизм), больше чем с чистой блокадой рецепторов, препятствующей агонистиндуцируемой их активации [2].
Селективность Н1-блокаторов является наиболее важной характеристикой фармакодинамики, в т. ч. выраженности побочных эффектов. Первое поколение Н1-блокаторов имеет невысокую селективность действия к Н1-рецепторам; препараты 2-го поколения отличаются высокой селективностью действия на Н1-рецепторы. Так, дезлоратадин имеет в 60 раз большую аффинность к Н1-рецепторам, чем Н2-рецепторам [3]. Н1-блокаторы 2-го поколения характеризуются высокой степенью аффинности к Н1-рецепторам и медленной диссоциацией из связи с ними. Дезлоратадин (Лордестин) отличается наибольшей аффинностью среди других препаратов 2-го поколения: в 200 раз большей, чем фексофенадин, в 50 раз большей, чем лоратадин и цетиризин, и в 3 раза большей, чем левоцетиризин [3, 4]. Причем дезлоратадин является наиболее мощным обратным агонистом Н1-рецепторов, чем фексофенадин и цетиризин, что связано с его высокой аффинностью [5].
Дополнительным свойством препаратов 2-го поколения является наличие противовоспалительного действия. В ранней фазе развития аллергической реакции ведущая роль принадлежит гистамину, который повышает проницаемость сосудистой стенки и вазодилатацию, вызывая отек, ринорею, гиперемию. Через несколько часов начинается поздняя фаза аллергической реакции, во время которой активируется клеточный ответ: адгезия циркулирующих нейтрофилов и инфильтрация тканей; активированные воспалительные клетки также высвобождают провоспалительные медиаторы (цитокины, лейкотриены и простагландины), пролонгируя и усиливая аллергический каскад. Противовоспалительный эффект новых антигистаминных препаратов (АГП) включает down-регуляцию высвобождения медиаторов воспаления, экспрессии цитокинов, клеточной адгезии, хемотаксиса и up-регуляцию иммунореактивности нейтрофилов и эпителиальных клеток, количества и функции β-адренорецепторов [6, 7]. Дезлоратадин в микро- и наномолярных концентрациях подавляет IgE-зависимое и независимое высвобождение интерлейкинов из базофилов, а также других провоспалительных медиаторов и из эозинофилов in vitro [8, 9]. Механизм противовоспалительного эффекта Н1-блокаторов связан с подавлением экспрессии гена – регулятора нуклеарного фактора-κB (NF-κB). NF-κB регулирует продукцию большинства провоспалительных цитокинов и активируется через Н1-рецепторы даже в отсутствие гистамина. Н1-блокаторы 2-го поколения подавляют активность NF-κB; по выраженности этого эффекта препараты располагаются в следующем порядке: дезлоратадин > цетиризин > лоратадин > фексофенадин [10].
Ввиду того что Н1-рецепторы на 45 % имеют строение, гомологичное с мускариновыми рецепторами, Н1-блокаторы потенциально могут взаимодействовать с М-холинорецепторами, проявляя холинобликирующие эффекты (сухость во рту, задержка мочи, запор, тахикардия и др.) [11]. Антихолинергические эффекты наблюдаются в основном при приеме препаратов 1-го поколения. Аффинность дезлоратадина в 50–100 раз меньше к М-холинорецепторам, чем к Н1-рецепторам [12]. Максимальная плазменная концентрация дезлоратадина при применении терапевтических доз в 10 раз меньше необходимой концентрации для проявления М-холиноблокирующего действия in vitro. Фексофенадин и левоцетиризин также не показывают клинически значимой антихолинергической активности. Препараты 2-го поколения не взаимодействуют с натриевыми каналами кардиомиоцитов и не вызывают синдром удлиненного интервала QT [2].
При выборе АГП необходимо учитывать такие характеристики, как быстрота начала действия, продолжительность эффекта и кратность приема, особенности фармакокинетики (распределение, особенно в ЦНС, метаболизм, период полувыведения, лекарственные взаимодействия), выраженность побочных эффектов (особенно седативного), влияние на качество жизни.
Фармакокинетические характеристики АГП оказывают влияние на межиндивидуальные колебания, скорость начала и длительность эффектов (табл. 2) [13, 14]. Минимальные межиндивидуальные различия плазменных концентраций отмечаются для препаратов, имеющих наименьшую степень метаболизации. Так, дезлоратадин, левоцетиризин и фескофенадин в отличие от своих предшественников характеризуются низкой степенью пресистемного метаболизма, что демонстрирует стабильную фармакокинетику. Вместе с тем дезлоратадин подвергается метаболизму в печени с участием цитохрома Р450 (CYP3A4) и глюкуронилтрансферазы [14], тогда как фексофенадин и левоцетиризин не взаимодействуют с цитохромом Р450, что минимизирует риск лекарственных взаимодействий с индукторами или ингибиторами цитохрома Р450 [13]. Дезлоратадин и левоцетиризин не показали клинически значимых взаимодействий с кетоконазолом, эритромицином, азитромицином, циметидином, флуоксетином, тогда как совместное применение фексофенадина с эритромицином и кетоконазолом приводит к существенному увеличению его концентрации [1, 15]. Кроме того, фексофенадин является субстратом для нескольких мембранносвязанных транспортеров, осуществляющих эфлюкс лекарственных средств (Р-гликопротеин – P-gp, органических анионов транспортер – OATP). В результате биодоступность и другие параметры фармакокинетики фексофенадина (AUC, Cmax) значительно возрастают при сочетании с приемом грейпфрутового, апельсинового и яблочного соков, которые являются ингибиторами транспортеров [1, 15].
Таблица 2.Сравнительная фармакокинетика и фармакодинамика 2-го поколения Н1-блокаторов.
Метаболиты препаратов 2-го поколения характеризуются достаточно большой скоростью достижения максимальной плазменной концентрации (Tmax – 1–3 часа) и быстрым началом действия. Так, в тестах с гистамининдуцированными кожными пузырями дезлоратадин, левоцетиризин и фексофенадин через 4 часа ингибировали их образование. FDA (Food and Drug Administration ) констатирует время начала эффекта АГП с момента развития статистически значимых изменений конечной точки аллергического заболевания. Так, для дезлоратадина начало действия отмечено через 1,25–3,0 часа, для левоцетиризина и фексофенадина – через 0,75–1,00 час [16]. Кроме того, препараты отличаются большой продолжительностью эффекта с возможностью однократного приема в сутки.
Важным дифференциальным фактором, различающим АГП между собой, является выраженность седативного побочного эффекта. АГП 1-го поколения свойственно развитие выраженного седативного эффекта: сонливости в течение дня, нарушения работоспособности и дневной активности; даже при приеме на ночь в дневные часы сохраняется остаточное седативное действие, снижаются внимание и активность. В отличие от препаратов 1-го поколения Н1-блокаторы 2-го поколения имеют плохую проницаемость через гематоэнцефалический барьер (ГЭБ), почти не вызывают седацию и другие побочные эффекты со стороны ЦНС.
Исследования последних лет показали, что концентрация лекарственных препаратов в ЦНС зависит от таких факторов, как липофильность, способность к ионизации и участие механизма эфлюкса через транспортер Р-gp. АГП 2-го поколения являются субстратами для Р-gp, который осуществляет эфлюкс препаратов из ЦНС и контролирует их проникновение через ГЭБ [17, 18]. Отсутствие или минимально выраженное седативное побочное действие препаратов 2-го поколения связано с эффективным эфлюксом через ГЭБ. Поэтому 1-е поколение Н1-блокаторов называют седативными препаратами, 2-е поколение – неседативными. Так, в сравнительном перекрестном исследовании у 44 здоровых добровольцев дезлоратадин не вызывал изменений в тесте бодрствования и тесте засыпания по сравнению с дифенгидрамином.
Новые АГП имеют минимальные побочные эффекты со стороны ЦНС (табл. 3) [1]. В крупном когортном исследовании в Великобритании (n > 24 тыс.) у больных АР, получавших дезлоратадин и левоцетиризин в реальной практике, частота развития сонливости/седации составила 0,08 % (9 случаев) и 0,37 % (46 случаев) соответственно. При этом риск развития случаев седации был в 5 раз выше в течение первого месяца приема левоцетиризина по сравнению с дезлоратадином [19].
Таблица 3.Седативные эффекты Н1-блокаторов 2-го поколения.
В исследованиях у здоровых добровольцев дезлоратадин не влиял на когнитивные и психомоторные функции, на время пробуждения в отличие от дифенгидрамина. У 248 больных АР дезлоратадин в дозе 5 мг не вызывал достоверных изменений в тестах на оценку когнитивных функций по сравнению с дифенгидрамином в дозе 50 мг (20).
Таким образом, дезлоратадин и фексофенадин относят к неседативным АГП, левоцетиризин – к слабоседативным [13].
Препараты Н1-блокаторов 2-го поколения с учетом их высокой селективности действия, благоприятной фармакокинетики и отсутствия (или минимального) седативного эффекта рекомендуется использовать в качестве препаратов выбора в лечении симптомов АР и хронической крапивницы.
Эффективность дезлоратадина в лечении сезонного АР изучалась в трех крупных плацебо-контролируемых клинических исследованиях (около 1000 больных) [14]. Дезлоратадин назначали 14-дневным курсом в период весеннего и осеннего аллергических сезонов, симптомы заболевания оценивали отдельно и по суммарной шкале Тotal Symptoms Scores (TSS) и Total Nasal Symptoms Score (TNSS). Дезлоратадин эффективно уменьшал назальные и глазные симптомы по шкале TSS в оба сезонных периода: на 28 % (против 12,5 % на плацебо) в весеннем и на 30 % (против 22 % на плацебо) в осеннем периодах. При этом достоверное улучшение отмечено уже после приема первой дозы препарата, а длительность эффекта удерживалась в утреннее время через 24 часа после приема в 93 % по шкале TSS [14].
В двух клинических исследованиях изучали эффективность дезлоратадина у пациентов с сезонным АР и сопутствующими симптомами астмы [14]. По сравнению с плацебо помимо купирования симптомов АР дезлоратадин достоверно уменьшал симптомы астмы и потребность в β2-агонистах.
Дезлоратадин (Лордестин) является препаратом выбора для лечения круглогодичного аллергического ринита (АР; FDA рекомендованы лишь дезлоратадин и цетиризин). В двух крупных клинических исследованиях у пациентов с умеренными и тяжелыми симптомами заболевания (TSS ≥ 12, около 2000 больных) применение дезлоратадина в дозе 5 мг в течение 4 недель достоверно уменьшало баллы по шкале TSS на 35 % (против 27,4 % на плацебо), достоверное уменьшение баллов TSS отмечено уже через 12 часов после приема первой дозы [14].
В ряде исследований изучалась эффективность АГП в лечении синдрома заложенности носа на фоне АР. Заложенность носа является ведущим синдромом при АР, его отмечают более 85 % пациентов, причем 75 % описывают его как среднетяжелый и тяжелый [20]. Почти половина пациентов считают заложенность носа наиболее значимой причиной снижения качества жизни, эмоционального функционирования, продуктивности в работе/учебе и дневной активности; 80 % пациентов называют заложенность носа негативной причиной засыпания и качества сна. В последних клинических исследованиях показано, что новое поколение Н1-блокаторов эффективно не только в контроле симптомов АР (ринореи, чихания, зуда), но и в облегчении заложенности носа, что связывают с наличием у препаратов противовоспалительных эффектов. Более ранние исследования не позволили доказать эффективность АГП, включая 2-е поколение, в улучшении лечения заложенности носа ввиду недостатков методологии этих исследований [22].
В недавнем мета-анализе, объединившем 13 клинических исследований и 3108 пациентов с АР, проводилась оценка эффективности применения дезлоратадина по динамике общих симптомов заболевания и назальной аэродинамики в течение 2–4-недельного применения. Дезлоратадин в дозе 5 мг/сут приводил к достоверному снижению баллов по шкалам ТSS и TNSS на -1,63 и -0,66 соответственно и достоверному повышению пиковой скорости назального инспираторного потока на 32 % по данным передней ринометрии [23]. По рекомендациям ВОЗ (2008) и Международного респираторного общества (IPCRG, 2006), АГП 2-го поколения рекомендуются для лечения заложенности носа на фоне АР в сочетании с деконгестантами [24].
АГП являются средством первого выбора для лечения хронической идиопатической крапивницы (ХИК), которая представляет собой медицинскую проблему, по степени снижения качества жизни пациентов сопоставимую с ишемической болезнью сердца. Пациенты жалуются на снижение энергии, нарушения сна, эмоциональный дистресс, ограничение социальной активности [25]. В нескольких исследованиях (n = 894) изучалась эффективность дезлоратадина у пациентов с умеренной/тяжелой ХИК [26].
Дезлоратадин уменьшал все основные симптомы крапивницы по шкалам зуда, пузырей, крапивницы и общих симптомов на 50–70 %. Действие дезлоратадина продолжалось до 24 часов, уменьшение симптомов зуда в конце интервала дозирования составляло 45 % (против 4 % на плацебо) после первой дозы и 69 % через 6 недель приема. Отмечено достоверное уменьшение размеров и числа пузырей на фоне терапии дезлоратадином при длительном применении. Эффективность дезлоратадина после первой дозы по динамике ТSS составила 41 % (против 10 % на плацебо), через неделю – 51 % (против 19 % на плацебо). Пациенты отметили уменьшение проблем сна и дневной активности на 80 % [27]. В исследовании по оценке качества жизни у пациентов с ХИК на фоне приема дезлоратадина в течение 7 дней отмечено уменьшение баллов по шкале опросника Dermatology Life Quality Index с 13,4 до 9,1 [28].
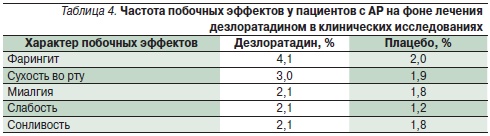
Анализ безопасности дезлоратадина по базе данных исследований (около 6000 больных) показывает частоту возникновения нежелательных реакций, сравнимую с уровнем плацебо (табл. 4) [14]. Не выявлено различий в частоте нежелательных реакций у детей в возрасте 2–11 лет на фоне приема дезлоратадина (12,7 против 10,7 % на плацебо); у пожилых лиц частота нежелательных реакций оказалась даже меньше уровня плацебо (1,7 против 10,0 % соответственно) [14].
Представляют интерес результаты изучения эффективности и переносимости новых АГП в постмаркетинговых наблюдательных исследованиях реальной клинической практики, охватывающих большую популяцию пациентов с разными аллергическим заболеваниями. Эффективность и переносимость дезлоратадина в реальной клинической практике лечения аллергических заболеваний изучалась в четырех крупных наблюдательных исследованиях 2001–2002 гг. в Германии [29]. Общее число пациентов в возрасте старше 12 лет в данном мета-анализе составило 77 880. Основными заболеваниями были АР с характерными симптомами со стороны носа, сопутствующими глазными симптомами и ХИК. Симптомы аллергических заболеваний оценивались дважды: исходно и в конце лечения (табл. 5); дополнительно проводилась оценка степени нарушения сна и дневной активности, а также частота побочных эффектов. Умеренные и тяжелые проявления аллергических заболеваний наблюдались у 70 % больных АР и 30 % – крапивницей, 50 % пациентов имели сопутствующие глазные симптомы. В результате лечения дезлоратадином отмечен значимый по выраженности клинический эффект, у подавляющего числа пациентов наблюдалось купирование симптомов. Причем быстрое начало действия на фоне приема дезлоратадина отметили 67 % пациентов и 63 % врачей [29].
Таблица 5.Динамика симптомов аллергических заболеваний на фоне лечения дезлоратадином.
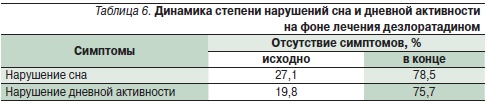
Помимо купирования основных симптомов аллергических заболеваний у пациентов в подавляющем большинстве случаев улучшалось общее состояние в виде нормализации сна и повышения дневной активности (табл. 6) [29].
По оценке пациентов, эффективность терапии дезлоратадином была отличной/хорошей в 98,5 %, по оценке врачей – в 99,1 % [29]. В мета-анализе выделена подгруппа в составе 17 575 пациентов, имевших неэффективную предшествующую терапию другими препаратами 2-го поколения (лоратадином, цетиризином, фексофенадином). Анализ эффективности дезлоратадина в этой подгруппе также показал высокий уровень: 90,3 % – по оценке пациентов и 91,6 % – по оценке врачей. Эти результаты имеют большое значение для определения преимуществ между разными АГП, т. к. в сравнительных клинических исследованиях различий между препаратами установлено не было.
По результатам мета-анализа в наблюдательных исследованиях выявлено 386 нежелательных реакций 287 (0,37 %) пациентов; прекращение лечения в связи с их развитием потребовалось 166 (0,21 %) пациентам [29]. Наиболее частыми побочными эффектами на фоне лечения дезлоратадином были слабость (0,07 %), головная боль (0,07 %), сухость во рту (0,04 %), тошнота (0,03 %).
Таким образом, дезлоратадин (Лордестин) является высокоэффективным АГП 2-го поколения, о чем свидетельствуют результаты плацебо-контролируемых и сравнительных клинических исследований пациентов с аллергическими заболеваниями. Лечение дезлоратадином достоверно уменьшает назальные и глазные симптомы при разных формах АР (сезонном, круглогодичном), ассоциированную с ним заложенность носа, а также купирует симптомы хронической крапивницы. Дезлоратадин улучшает качество жизни пациентов с аллергическими заболеваниями благодаря нормализации сна и дневной активности, уменьшению депрессии и отсутствию седативного эффекта. Эффективность и хорошая переносимость дезлоратадина подтверждается и в наблюдательных популяционных исследованиях. Кроме того, по результатам наблюдательных исследований показано преимущество дезлоратадина у пациентов с неэффективной предшествующей терапией другими АГП, что позволяет использовать дезлоратадин в таких случаях.
Информация об авторе:
Леонова Марина Васильевна – профессор кафедры клинической фармакологии ГОУ ВПО РГМУ Росздрава.
Тел (499) 261-23-08, e-mail: anti23@mail.ru


