Согласно опубликованным доклиническим данным, комбинация бевацизумаба (Авастин) с цитостатиками обладает синергизмом. Увеличение эффективности терапии при включении бевацизумаба в стандартные режимы 1-й и 2-й линий химиотерапии при HER2-негативном метастатическом раке молочной железы (мРМЖ) продемонстрировано в нескольких рандомизированных исследованиях III фазы: E2100, AVADO (бевацизумаб в комбинации с таксанами в качестве 1-й линии терапии) [1, 2], RIBBON-1 (бевацизумаб в комбинации с таксанами или капецитабином, или антрациклинами в качестве 1-й линии терапии) [3], RIBBON-2 (бевацизумаб + стандартная химиотерапия в качестве 2-й линии) [4].
При мета-анализе [5] результатов указанных исследований показано 36 %-ное снижение риска рецидива и смерти, увеличение времени без прогрессирования заболевания и частоты общего ответа во всех подгруппах больных с HER2-негативным мРМЖ, в 1-й линии терапии получавших цитостатики в комбинации с бевацизумабом, в отсутствие различий в общей выживаемости. Профиль безопасности бевацизумаба при этом соответствовал ранее полученным данным.
К сожалению, в повседневной клинической практике до настоящего времени существует группа больных мРМЖ с неустановленным (по тем или иным причинам) HER2/neu и ER/PR-рецепторным статусом. Эти пациентки не могут рассматриваться в качестве кандидаток для терапии трастузумабом (Герцептин), однако использование бевацизумаба у них вполне оправданно, поскольку не требует определения уровня VEGF в сыворотке крови и рецепторов к нему. При этом эффективность комбинации бевацизумаба с цитостатиками была четко показана в перечисленных выше исследованиях.
Приводим наш опыт использования бевацизумаба в 1-й и 2-й линиях химиотерапии у больных мРМЖ с неустановленным HER2/neu и ER/ PR-рецепторным статусом.
Клиническое наблюдение № 1
Больная 1947 г. р., менопауза, состояние по шкале ECOG-1.
В 2000 г. установлен диагноз: рак левой молочной железы (МЖ), стадия рT2N0M0 (IIа). Проведена резекция левой МЖ (11.07.2000) с последующей лучевой терапией (46 Гр). Гистологическое заключение: инвазивный рак без метастазов в лимфатические узлы. Определение статуса ER/PR/HER2 не выполнено.
Прогрессирование заболевания в декабре 2008 г. (длительность безрецидивного периода – 8 лет 5 месяцев).
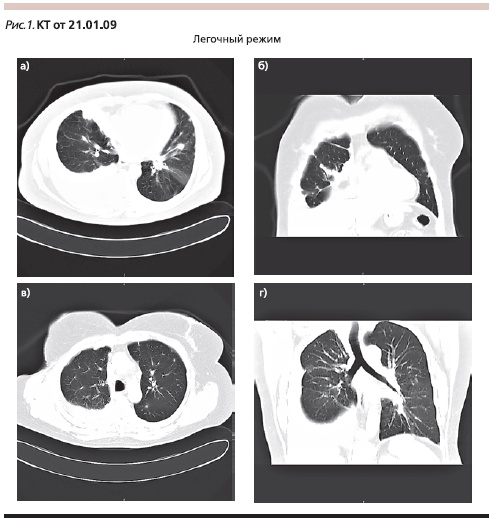
При осмотре жалобы на одышку, кашель; обнаружены правосторонний плеврит, дыхательная недостаточность II степени. По данным компьютерной томографии (КТ; 21.01.2009; рис. 1): правосторонний плеврит (1,5 л), в обоих легких множественные метастазы от 5 до 20 мм в диаметре, увеличение всех групп медиастинальных лимфатических узлов.
Из плевральной полости эвакуировано 1,5 л жидкости. Цитологическое заключение: железистый рак.
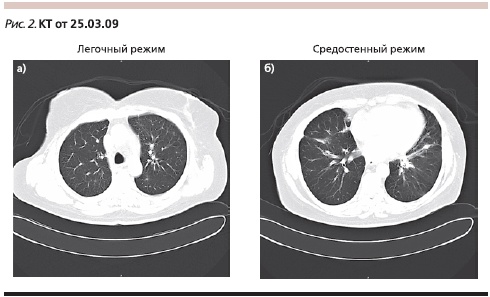
В 1-й линии терапии назначены паклитаксел 90 мг/м2 внутривенно в дни 1, 8, 15 + бевацизумаб 10 мг/кг внутривенно в дни 1 и 15. После двух циклов терапии, по данным КТ (25.03.2009; рис. 2), отмечено уменьшение числа (до 4–6) и размеров (до 5–7 мм) выявленных ранее очагов; медиастинальные лимфатические узлы не увеличены; незначительное количество выпота в плевральной полости (частичный ответ по критериям RECIST).
Лечение продолжено. По данным контрольной КТ (03.06.2009), после 4-го цикла терапии отмечено дальнейшее уменьшение числа и размеров (до 3–5 мм) выявленных ранее очагов; медиастинальные лимфатические узлы не увеличены; в плевральных полостях жидкость не определяется (частичный ответ по критериям RECIST).
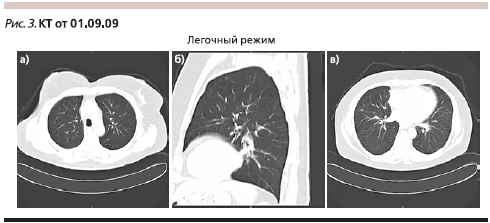
Лечение продолжено в том же режиме. Контрольная КТ после 7 циклов терапии (01.09.2009; рис. 3): полный регресс выявленных ранее очагов; медиастинальные лимфатические узлы не увеличены; плевральные полости свободны (полный ответ по критериям RECIST).
Осложнения в процессе лечения – носовое кровотечение 1-й степени, лейкопения, нейтропения 1-й степени и ухудшение зрения, не обусловленное лечением, не препятствовали терапии и не требовали дополнительных лекарственных назначений. Лечение было прервано по инициативе больной. По данным контрольной КТ (01.12.2009) – без динамики.
Спустя 4 месяца после завершения терапии, в январе 2010 г., отмечено дальнейшее прогрессирование заболевания (появление кашля, одышки). По данным КТ (22.01.2010), зарегистрировано появление новых метастазов в легких, увеличение медиастинальных лимфатических узлов. В плевральных полостях жидкость: справа – 150, слева – 50 мл. Выявлены метастатические поражения 3-го ребра справа – по подмышечной линии уплотнение костной ткани на протяжении 20 мм и 4-го ребра справа – участок деструкции 26 мм.
Продолжительность периода до прогрессирования составила 12 месяцев. Во 2-й линии терапии использован следующий режим: винорелбин 25 мг/м2 внутривенно в дни 1 и 8, капецитабин 2000 мг/м2 внутрь в дни 1–14 и бевацизумаб 10 мг/кг внутривенно в дни 1 и 15. Кроме того, в лечение был включен бисфосфонат: золедроновая кислота 4 мг внутривенно каждый 21-й день.
После 3-го цикла терапии, по данным КТ, достигнут частичный регресс метастазов в легких и медиастинальных лимфатических узлах, а также полный регресс выпота в плевральной полости. Лечение продолжено без осложнений. Больной проведено 6 циклов терапии; по данным контрольной КТ в мае 2010 г., сохраняется частичный регресс опухолевых очагов. Проведено еще 3 цикла терапии, лечение завершено в августе 2010 г.
Продолжительность периода до прогрессирования составила 8 месяцев. По данным контрольной КТ (01.09.2010), стабилизация ранее выявленных очагов при нарастании количества жидкости в правой плевральной полости. Эвакуировано (01.09.2010) 1,5 л (цитология – железистый рак). В настоящее время больная получает 3-ю линию полихимиотерапии.
Клиническое наблюдение № 2
Больная 1965 г. р., менопауза, состояние по шкале ECOG-2.
В 1998 г. по поводу рака правой МЖ, стадия рT2N0M0 (IIа), выполнена радикальная мастэктомия (11.10.1998) с последующей адъювантной химиотерапией (5 циклов в режиме CMF – циклофосфамид + метотрексат + фторурацил). Гистологическое заключение: инфильтрирующий протоковый рак, Gr. II. Определение статуса ER/ PR/HER2 не выполнено.
Прогрессирование заболевания в январе 2009 г. (длительность безрецидивного периода – 10 лет 3 месяца).
При осмотре выраженная одышка, сухой кашель. По данным КТ (26.01.2009), множественные метастазы в легких, медиастинальных лимфатических узлах.
В 1-й линии терапии назначены паклитаксел 90 мг/м2 внутривенно в дни 1, 8, 15 + бевацизумаб 10 мг/кг внутривенно в дни 1 и 15. После двух циклов терапии, по данным КТ (31.03.2009), отмечен регресс метастазов в легких > 50 % (частичный ответ по критериям RECIST). Осложнения лечения – гематологическая токсичность 1–2-й степеней, не требующая дополнительного назначения лекарственных средств. Терапия продолжена в прежнем режиме без редукции доз. По данным контрольной КТ (05.06.2009), после 4-го цикла терапии на месте ранее определявшихся очагов – остаточные явления по типу фиброза. В средостении – единичные лимфатические узлы до 9 мм. Осложнения лечения – гематологическая токсичность 3-й степени, кровянистые выделения из носа 2-й степени, в связи с чем последнее введение паклитаксела было отменено. Дополнительно применялись колониестимулирующие факторы. Лечение продолжено в прежнем режиме без редукции доз. При контрольном обследовании после 6-го цикла, по данным КТ (30.06.2009), полный регресс метастазов в легких (полный ответ по критериям RECIST). Несмотря на профилактическое использование колониестимулирующих факторов, вновь отмечено развитие гематологической токсичности 3–4-й степеней, фебрильной нейтропении, потребовавшей назначения антибактериальной терапии.
После шести циклов химиотерапии при сохраняющемся полном регрессе метастазов в легких больной рекомендовано проведение химиотерапии капецитабином в поддерживающем режиме. При контрольной компьютерной томографии в сентябре 2010 г. эффект терапии сохраняется.
Клиническое наблюдение № 3
Больная 1953 г. р., менопауза, состояние по шкале ECOG-0.
В 2008 г. выявлен РМЖ, стадия T4N2M0 (IIIб). Цитология (пункционная биопсия аксилярного лимфатического узла): низкодифференцированный рак. Трепанобиопсия выполнена 16.04.2008. По данным морфологического исследования: инфильтрирующий протоковый рак, Gr II. ER/PR/ HER2 статус не определен.
В 1-й линии терапии больной проведено 4 цикла лечения в режиме FAC (фторурацил + доксорубицин + циклофосфамид в дозах 1000, 100 и 1000 мг/м2 соответственно) с интервалами в 21 день (до 21.07.2008). Спустя 3 месяца (больная на лечение не являлась) отмечено прогрессирование заболевания – увеличение первичной опухоли до 7,0 см, лимфатических узлов в аксиллярной области до 4,5 см. Данных о наличии отделенных метастазов при обследовании не выявлено.
Во 2-й линии терапии применялись паклитаксел 90 мг/м2 внутривенно в дни 1, 8, 15 + бевацизумаб 10 мг/кг внутривенно в дни 1 и 15. Уже после первого цикла терапии (без осложнений) клинически, по данным маммографии и ультразвукового исследования лимфатических узлов, был отмечен регресс опухоли до 3 см и лимфатических узлов до 2 см (частичный ответ по критериям RECIST).
Лечение продолжено. После 4-го цикла терапии клинически, по данным маммографии и ультразвукового исследования лимфатических узлов, установлен регресс первичного очага > 75 % и полный регресс лимфатических узлов (частичный ответ по критериям RECIST). Осложнения лечения – носовое кровотечение 1-й степени, контролируемая артериальная гипертензия 1-й степени.
Лечение продолжено. При контрольном обследовании после шести циклов терапии клинически и по данным визуализационных методов обследования установлены дальнейший регресс первичной опухоли, отсутствие отдаленных и регионарных метастазов. Осложнения лечения – контролируемая артериальная гипертензия 1-й степени.
Больной предложено хирургическое лечение, от которого она отказалась. Проведен курс лучевой терапии. В дальнейшем в течение года пациентка получала терапию капецитабином. Длительность периода до прогрессирования – 24 месяца.
Заключение
Клиническая эффективность бевацизумаба (Авастин) в 1-й линии терапии в комбинации с цитостатиками у больных мРМЖ продемонстрирована в ходе трех рандомизированных исследований III фазы – Е2100, AVADO и RIBBON-1. Кроме того, показана клиническая эффективность бевацизумаба при добавлении к стандартной химиотерапии 2-й линии в исследовании RIBBON-2. Мы полагаем, что больные мРМЖ с неустановленным (по тем или иным причинам) HER2/neu и ER/ PR-рецепторным статусом могут рассматриваться в качестве кандидаток на проведение 1-й и 2-й линий терапии в комбинации с бевацизумабом, поскольку назначение последнего не требует определения уровня VEGF и рецепторов к VEGF.
Наш опыт свидетельствует о клинической эффективности бевацизумаба как в комбинации с таксанами, так и при назначении в сочетании с режимами, не содержащими таксанов. Спектр побочных эффектов, наблюдаемых при проведении такой терапии, не отличался от ранее опубликованных данных.
Информация об авторах:
Константинова Мария Михайловна – доктор медицинскийх наук, ведущий научный сотрудник
отдела новых технологий, ФГУ "Институт хирургии им. А.В. Вишневского".
E-mail: maria.konstantinova@rambler.ru;
Шикина В.Е. – 2 ГУЗ "Московский областной онкологический диспансер" МЗ МО,
Макшанцев А.Ю. – ФГУ “3-й ЦВКГ им. А.А. Вишневского” Минобороны России