Введение
Псориаз – одно из наиболее распространенных заболеваний кожи, встречающееся у 2–5 % лиц европеоидной расы. Число больных псориазом в мире достигает 125 млн [1], при этом в России их численность составляет около 3,5 млн.
Высокая социальная значимость псориаза обусловлена тем, что это заболевание относится к немногочисленной группе хронических дерматозов, приводящих к инвалидизации. Оно характеризуется длительным хроническим рецидивирующим течением и редко достигаемой полной клинической ремиссией. Наличие при псориазе патологических изменений на коже, существенно влияющих на внешний вид больного и сопровождающихся зудом, артралгиями, значительно снижает качество жизни больных, нередко приводит к развитию тревожно-депрессивных состояний.
В последние годы были опубликованы результаты крупных исследований, свидетельствующих о том, что псориаз сокращает ожидаемую продолжительность жизни на 3–4 года, причем самыми частыми причинами смерти и потери трудоспособности при этом заболевании являются инфаркт миокарда (ИМ) и мозговой инсульт [2–4].
Выявленная в ходе клинических и популяционных исследований связь псориаза и сердечно-сосудистых заболеваний (ССЗ) имеет многофакторный характер и, вероятно, обусловлена тем, что эти болезни могут иметь общую генетическую предрасположенность, общие факторы риска и общие механизмы патогенеза. Более того, лекарственные средства, применяемые при лечении одного заболевания, могут оказывать негативное влияние на течение другого. Кроме этого недостаточное внимание к профилактике и лечению сопутствующих заболеваний у больных псориазом, их угнетенное психологическое состояние могут стать дополнительными факторами риска, обусловливающими неблагоприятный прогноз [5].
Артериальная гипертензия (АГ), один из важнейших факторов риска развития нежелательных сердечно-сосудистых событий – ИМ, инсульта и преждевременной смерти, среди больных псориазом встречается чаще, чем в общей популяции. В ряде исследований показано, что псориаз существенно повышает риск развития АГ, а также ожирения и сахарного диабета (СД) [6–8]. Эта связь может быть обусловленной рядом причин. Помимо негативного действия таких факторов, как депрессия, курение, злоупотребление алкоголем и малоподвижный образ жизни, больные псориазом часто не получают адекватную медикаментозную терапию. Отчасти это вызвано тем, что некоторые β-адреноблокатороы, ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов к ангиотензину (БРА), антагонисты кальция, антиаритмические и гиполипидемические средства могут провоцировать обострение и ухудшение течения псориаза [9]. Результаты исследований последних лет показали, что ангиотензин II, участвующий в регуляции артериального давления (АД), электролитного состава и объема крови, может играть важную роль в патогенезе этого заболевания.
Целью нашего исследования являлось изучение эффективности и безопасности Ко-Диротона, представляющего собой фиксированную низкодозовую комбинацию лизиноприла и гидрохлоротиазида (ГХТ), в сравнении с эналаприлом и ГХТ у больных псориазом, страдающих АГ 1–2-й степени и избыточным весом.
Материал и методы
Настоящая работа основана на результатах наблюдения больных распространенным псориазом, которые включались в исследование последовательно при поступлении в стационар. После первоначального обследования и получения информированного согласия проводилась рандомизация пациентов, удовлетворявших критериям включения. Все больные находились под наблюдением дерматолога и кардиолога, получали адекватную медикаментозную терапию для лечения псориаза, включавшую иммуносупрессивные, противовоспалительные, дезинтоксикационные лекарственные средства и наружные препараты.
В исследование были включены больные с избыточным весом (индекс массы тела [ИМТ] – более 25 кг/м²), госпитализированные в связи с обострением псориаза, у которых при первичном обследовании выявлена АГ 1–2-й степеней с уровнями систолического АД (САД) 140–180 мм рт. ст. и диастолического АД (ДАД) 90–110 мм рт. ст.
Пациенты получали Ко-Диротон (Гедеон-Рихтер, Венгрия), содержащий 10 мг лизиноприла и 12,5 мг ГХТ, эналаприл в дозе 10 мг или ГХТ в дозе 25 мг/сут в утренние часы однократно.
В исследование не включались лица, имеющие противопоказания к назначению ИАПФ или диуретиков, а также с повышенной чувствительностью к любому из компонентов применяемых препаратов; больные со вторичной (симптоматической) АГ, тяжелой хронической сердечной, почечной или печеночной недостаточностью, нестабильной стенокардией или другими сопутствующими заболеваниями, требующими постоянного приема препаратов, оказывающих влияние на уровни АД.
Продолжительность наблюдения составила 3 недели. Эффективность антигипертензивной терапии оценена на основании ежедневного двукратного измерения АД методом Короткова. Целевой уровень АД для пациентов, перенесших ИМ или страдающих СД типа 2 (СД2), был определен ниже 130/80 мм рт. ст., для остальных – ниже 140/90 мм рт. ст.
Для оценки степени тяжести псориаза и эффективности проводимой терапии использовался индекс PASI (Psoriasis Area and Severity Index) [10, 11]. Этот показатель характеризует площадь поражения кожи, степень выраженности объективных (эритема, шелушение, инфильтрация) и субъективных (зуд кожи) симптомов. При максимальной распространенности процесса и выраженности объективных и субъективных симптомов индекс PASI составляет 72, а при их полном отсутствии индекс – 0. Результаты исследований обрабатывались с использованием пакета прикладных программ для научно-технических расчетов PASW Statistics 17.0 (SPSS Inc.). Для оценки межгрупповых различий использован непараметрический U-критерий Манна–Уитни; оценка корреляционной связи количественных признаков произведена с использованием метода ранговой корреляции Кендалла.
Достоверность различий качественных признаков определена путем построения таблиц сопряженности и их анализа с помощью критерия χ².
Результаты
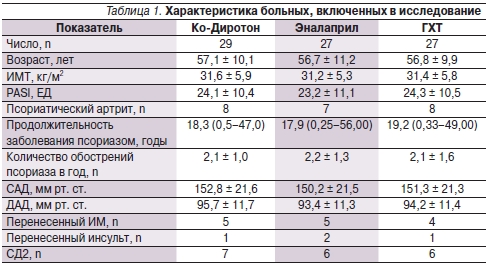
В исследование были включены 90 больных. По различным причинам 7 пациентов выбыли из исследования и в окончательный анализ были включены 83 больных, в т. ч. 39 (47 %) лиц женского и 44 (53 %) мужского пола в возрасте от 38 до 73 лет (средний возраст – 56,9 ± 11,5 лет). Длительность заболевания АГ составила от 1 до 34 лет. У 56 пациентов диагностирована АГ 1-й, у 27 – 2-й степеней. Четырнадцать больных ранее перенесли ИМ, в связи с чем они получали β-адреноблокаторы в дозах, не изменявшихся на протяжении всего исследования. Четверо больных ранее перенесли острое нарушение мозгового кровообращения по ишемическому типу, у 19 пациентов был СД2. В результате рандомизации были сформированы 3 группы больных, которым назначали Ко-Диротон 10/12,5 мг, ГХТ 25 мг/сут или эналаприл 10 мг/сут. Достоверных различий в демографических и клинических показателях между группами не отмечено (табл. 1).
На фоне проводимого лечения к концу периода госпитализации у всех больных отмечена практически полная ремиссия псориаза. Эффективность достижения ремиссии не различалась в группах больных, получавших Ко-Диротон, эналаприл и ГХТ. Средние величины индекса PASI в этих группах снизились с 24,1 ± 3,3 до 4,4 ± 1,1, с 23,2 ± 3,6 до 5,7 ± 1,4 и с 24,3 ± 3,3 до 5,1 ± 1,2 соответственно; различия между группами не достигали уровня статистической значимости. Не было выявлено и достоверных различий в продолжительности госпитализации среди больных, получавших Ко-Диротон, эналаприл и ГХТ (18,3 ± 5,2, 20,1 ± 6,1 и 17,9 ± 5,8 дня соответственно; p > 0,05). Трем больным (11 %), получавшим эналаприл, и одному больному (3,7 %), получавшему ГХТ, потребовалось дополнительное назначение метотрексата для достижения ремиссии псориаза, в то время как среди пациентов, получавших Ко-Диротон, необходимости в дополнительном назначении метотрексата не возникло.
Назначение антигипертензивной терапии во всех трех группах сопровождалось существенным снижением АД. На фоне приема Ко-Диротона отмечено более выраженное снижение АД, чем при приеме эналаприла или ГХТ. Достоверных различий в антигипертензивном действии эналаприла и ГХТ выявлено не было (рис. 1 и 2).
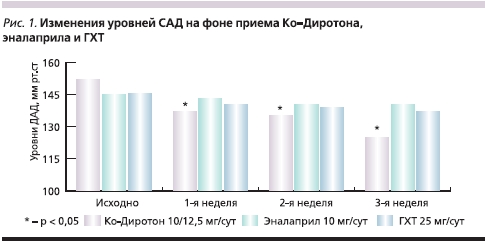
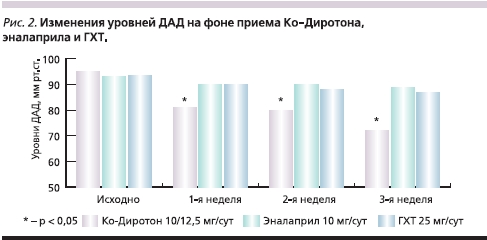
К концу периода наблюдения достижение целевых уровней АД отмечено у 24 (82,8 %) больных, получавших Ко-Диротон, у 13 (48,1 %) получавших эналаприл, и у 12 (44,4 %) пациентов, получавших ГХТ. Сравнение относительных частот достижения целевых уровней АД при помощи критерия χ² показало, что на фоне приема Ко-Диротона достижение целевых уровней АД происходило достоверно чаще (табл. 2). Различия между эналаприлом и ГХТ не были статистически значимыми.
На фоне назначения антигипертензивных средств отмечены редкие побочные явления. У трех больных, ранее не принимавших ИАПФ, развился сухой кашель, обусловивший необходимость отмены этих препаратов: у двоих – на фоне назначения эналаприла, у одного – на фоне приема Ко-Диротона.
Анализ изменений лабораторных показателей в группе больных, принимавших Ко-Диротон, выявил достоверное снижение уровней мочевины, креатинина, АЛТ и АСТ (табл. 3). На фоне приема эналаприла отмечено некоторое повышение, на фоне ГХТ – снижение уровня калия, в обоих случаях не достигших уровня статистической значимости.
Обсуждение
Результаты проведенного исследования свидетельствуют о том, что у больных псориазом, страдающих АГ и избыточным весом, назначение эналаприла в дозе 10 мг/сут, ГХТ в дозе 25 мг/сут или Ко-Диротона 10/12,5 мг безопасно, хорошо переносится и сопровождается достоверным снижением АД. На эффективность достижения клинической ремиссии псориаза эти препараты не влияют. При этом фиксированная комбинация ХГТ и лизиноприла, входящих в состав Ко-Диротона, обладает существенно более выраженным антигипертензивным действием, чем принимаемые в монотерапии эналаприл или ГХТ: на фоне приема Ко-Диротона у достоверно большего числа больных удалось достичь целевых уровней АД.
Несмотря на проведенные крупномасштабные исследования, направленные на изучение патогенеза псориаза, единого мнения о механизмах развития этого заболевания нет. В настоящее время псориаз расценивают как иммуно-опосредованное заболевание, в основе патогенеза которого лежит патологическая активация аутореактивных Т-лимфоцитов под воздействием неких высокоспецифичных кожных аутоантигенов. Активированные Т-лимфоциты продуцируют в коже ряд цитокинов и биологически активных молекул, вызывающих гиперпролиферацию эпидермиса с образованием большого количества незрелых кератиноцитов и инфильтрацию очага поражения дендритными клетками, макрофагами, нейтрофилами и Т-лимфоцитами. Красный цвет псориатических бляшек обусловлен большим количеством капилляров в очаге поражения. Попадая в кровь, провоспалительные цитокины и биологически активные соединения способствуют развитию у больных псориазом различных “сопутствующих” заболеваний. Результаты клинических и популяционных исследований свидетельствуют о том, что у больных псориазом повышена вероятность развития неспецифического язвенного колита, рака, СД и ишемической болезни сердца [12]. Выявленная в ходе клинических и популяционных исследований связь псориаза и ССЗ носит сложный многофакторный характер и, вероятно, обусловлена тем, что эти заболевания могут иметь общую генетическую предрасположенность, общие факторы риска и общие механизмы патогенеза. При этом лекарственные средства, использующиеся для лечения одного заболевания, могут оказывать негативное влияние на течение другого. Многие авторы указывают на корреляцию тяжести клинических проявлений псориаза с наличием и выраженностью факторов риска ССЗ, таких как АГ, гипер- и дислипидемия, СД, курение и ожирение [13–16].
В связи с вышеизложенным становится очевидным интерес к разработке методов сочетанного лечения псориаза и ССЗ, позитивно влияющих на их течение и прогноз.
Связь АГ и псориаза была продемонстрирована в ряде исследований [17–21]. У 78 061 женщины, включенной в “исследование американских медсестер” (Nurses’ Health Study II), показано, что псориаз сопровождается повышением относительного риска развития АГ на 17 %, СД – на 63 % [22].
Не исключено, что АГ и псориаз могут иметь общие механизмы развития. Так, у больных псориазом и псориатической артропатией выявлена высокая частота носительства мутантных аллелей гена АПФ, повышающих риск развития АГ [23]. Показано, что при псориазе повышены активность тканевых изоформ АПФ и уровень АПФ в плазме крови, а ремиссия псориаза сопровождается снижением содержания АПФ в плазме [24].
Как показали результаты экспериментальных исследований, ангиотензин II и продукты его деградации (гидролиза), такие как ангиотензин 1–12 и ангиотензин 1–7, могут участвовать в процессах заживления ран, стимулируя пролиферацию кератиноцитов, хемотаксис кератиноцитов, фибробластов и моноцитов, продукцию внеклеточного матрикса и ангиогенез [25]. С другой стороны, уменьшение биодоступности ангиотензина II помимо снижения АД может уменьшать риск развития заболеваний, в основе патогенеза которых лежит избыточная пролиферация клеток эпидермиса. Так, Moscarelli L. и соавт. [26] показали, что прием ИАПФ или БРА в течение 5 лет сопровождается снижением риска развития рака кожи у реципиентов почечного трансплантата на 51 %.
Проведенное исследование показало, что Ко-Диротон, обладая такой же переносимостью, как эналаприл в дозе 10 мг/сут и ГХТ в дозе 25 мг/сут, оказывает более выраженное гипотензивное действие. Среди больных, получавших Ко-Диротон, снижение АД до целевых уровней отмечено в 83 % случаев, в то время как на фоне приема эналаприла и ГХТ этот показатель составил 48 и 44 % соответственно.
Ко-Диротон представляет собой фиксированную низкодозовую комбинацию лизиноприла и ГХТ. Целесообразность комбинировании ИАПФ и тиазидного диуретика обусловлена более эффективным контролем АД, в первую очередь связанным с ингибирующим действием ИАПФ на ренин-ангиотензиновую систему, активность которой повышается на фоне действия диуретика, потенциированием ренопротективного действия ИАПФ и снижением риска развития побочных действий [27].
В исследование, проведенное в Финляндии, были включены 1156 больных в возрасте 30–70 лет с неконтролируемой АГ на фоне медикаментозной терапии. После рандомизации больным или увеличивали дозу ранее принимаемых лекарственных средств, или заменяли оказавшиеся недостаточно эффективными антигипертензивные средства на лизиноприл в комбинации с ГХТ. Как оказалось, замена на комбинацию ГХТ с лизиноприлом обеспечила более эффективный контроль АД с меньшим количеством побочных явлений по сравнению с “оптимизацией” ранее неэффективной лекарственной терапии [28]. Patel B.V. и соавт. [29] в обсервационном исследовании изучали влияние комбинаций диуретиков с основными классами антигипертензивных средств на риск развития ИМ или инсульта у 1305 больных АГ и ишемической болезнью сердца без сопутствующих сердечной, почечной недостаточности или СД2. Прием тиазидного диуретика в комбинации с лизиноприлом сопровождался более низким риском развития ИМ и инсульта, чем прием диуретика в комбинации с атенололом.
В крупном ретроспективном исследовании у 48 212 больных АГ оценивали соблюдение назначений врача по приему лекарственных средств. Оказалось, что уже через год после назначения ГХТ в монотерапии 70,1 % больных отказались от приема препарата, тогда как после назначения ГХТ в фиксированной комбинации с ИАПФ число больных, отказавшихся от антигипертензивной терапии, было вдвое меньшим [30].
Одним из несомненных преимуществ комбинированной терапии является возможность назначения лекарственных средств в небольших дозах. При использовании лекарственного препарата в монотерапии для достижения желаемого эффекта необходимо увеличивать его дозу, что приводит к повышению риска развития побочных явлений. На фоне применения комбинированной терапии вероятность развития нежелательных явлений снижается, т. к. используются меньшие дозы препаратов, которые в ряде случаев могут взаимно нейтрализовать побочные эффекты друг друга [31].
Анализ динамики лабораторных биохимических показателей на фоне лечения показал, что в группе больных, получавших Ко-Диротон, но не эналаприл или ГХТ, отмечено достоверное снижение уровней мочевины, креатинина, АЛТ и АСТ, что может быть отчасти обусловлено отсутствием необходимости назначения метотрексата, обладающего негативным влиянием на функцию почек и печени.
С другой стороны, лизиноприл, входящий в состав Ко-Диротона, имеет ряд особенностей, отличающих его от других представителей класса ИАПФ. Он является исходно активной лекарственной формой с длительным периодом действия и практически не связывается с белками крови. Отсутствие биотрансформации в печени позволяет эффективно и безопасно применять лизиноприл у больных с различными нарушениями функции этого органа. На его эффективность и безопасность не оказывают влияние ни прием алкоголя, ни одновременное назначение других лекарственных средств, включая сердечные гликозиды, антикоагулянты, антиаритмические средства и т. д.
Таким образом, назначение больным АГ и обострением псориаза или ГХТ в суточной дозе 25 мг, или эналаприла в суточной дозе 10 мг, или Ко-Диротона 10/12,5 мг позволяет безопасно снижать уровень АД без уменьшения эффективности антипсориатической терапии. Являясь фиксированной низкодозовой комбинацией лизиноприла и ГХТ, Ко-Диротон обладает более выраженным антигипертензивным действием и позволяет достигать целевого уровня АД у большинства больных. Не исключено, что длительный прием Ко-Диротона помимо эффективного контроля уровня АД позволит добиться более длительной ремиссии псориаза и снизить риск обострений заболевания.


