Введение
Сахарный диабет (СД) является одной из ведущих медико-социальных и экономических проблем большинства стран мира, что определяется неуклонным ростом заболеваемости, высокой частотой, тяжестью и прогрессированием сосудистых осложнений, приводящих к ранней инвалидизации и высокой летальности.
По данным Международной федерации диабета [7], в настоящее время в мире насчитывается 285 млн больных СД в возрасте 20–79 лет, из которых 85–95 % составляют пациенты c СД типа 2 (CД2). Предполагается, что к 2030 г. общее число больных СД увеличится до 438 млн. В 2009 г. в Российской Федерации были зарегистрированы 3 029 397 больных СД, из них с СД2 –2 735 775 пациентов. Только за последние 8 лет численность больных СД в России увеличилась на 40 %. К 2025 г.ожидается увеличение их количества до 4,51 млн человек, в основном за счет прироста пациентов с СД2.
В развитии и прогрессировании сосудистых осложнений, приводящих к значительным экономическим затратам на оказание медицинской и социальной помощи больным, ключевая роль принадлежит хронической гипергликемии [15, 17]. Контролируемые клинические исследования, такие как DCCT и UKPDS, убедительно продемонстрировали, что поддержание нормогликемии является наиболее эффективным средством предупреждения микро- и макрососудистых осложнений и снижения общей смертности. Хроническая гипергликемия участвует в патогенезе диабетических ангиопатий как непосредственно, так и опосредовано, инициируя несколько биохимических процессов, к которым относятся окислительный стресс, избыточное образование конечных продуктов гликозилирования, увеличение синтеза диацилглицерина и др. [2]. Наряду с показателями гликемии натощак и уровнем гликированного гемоглобина важным маркером достижения оптимального гликемического контроля и снижения риска развития сосудистых осложнений является послепищевая (постпрандиальная) гликемия (ППГ), повышение которой ассоциируется с повышенным риском развития ретинопатии, увеличением толщины интимы-медиа сонной артерии, снижением миокардиального объема крови и миокардиального кровотока [1, 16]. В связи с этим коррекция и мониторирование показателей ППГ, являющейся независимым фактором риска развития макро- и микроангиопатий при СД2, абсолютно необходимы с точки зрения профилактики диабетических осложнений.
Как известно, одной из целей диетотерапии при СД2 является обеспечение адекватной нутритивной поддержки пациентов, направленной на коррекцию сложного комплекса метаболических нарушений – базальной и постпрандиальной гипергликемии, гиперинсулинемии, дислипидемии и др. С этой целью традиционно используются специализированные продукты для энтерального питания (ЭП), характеризующиеся модифицированным углеводным и жировым составом, включением в их состав комплекса витаминов, минеральных веществ и микроэлементов. В многочисленных клинических исследованиях продемонстрировано преимущество специализированных продуктов для ЭП по сравнению со стандартными смесями в плане достижения оптимального гликемического контроля и улучшения показателей липидного спектра крови у больных СД [3, 6, 18].
Результаты мета-анализа 23 исследований [8] показали, что использование специализированных смесей для ЭП приводит к значимому снижению ППГ, меньшим пиковым значениям глюкозы в крови и уменьшению площади под гликемической кривой у больных СД. Кроме того, в нескольких исследованиях показано значимое уменьшение потребности в инсулине – на 26–71 %. Оптимизация гликемического контроля у больных СД тесно связана с модификацией углеводного состава специализированных продуктов для ЭП, в т. ч. сисключением моно- и дисахаридов, их заменой на мальтодекстрины с низкойстепенью гидролиза, включением сахарозаменителей, высоким содержаниемпищевых волокон и др.
Модификация жирового состава специализированных продуктов за счетих обогащения мононенасыщеннымижирными кислотами (МНЖК) играетважную роль в коррекции нарушений липидного обмена и снижении рискаразвития сосудистых осложнений приСД2. МНЖК длительное время рассматривались в качестве жировогокомпонента рациона, практически не оказывающего влияния на уровеньлипидов крови. Вместе с тем в работах последних лет [11, 13] показано, что обогащение диеты МНЖК приводит к столь же эффективному уменьшениюсодержания общего холестерина (ХС)и ХС липопротеидов низкой плотности, как и применение низкожировой диеты или диеты, обогащенной полиненасыщенными жирными кислотами. По данным мета-анализа 10 исследований, проведенного Garg A. и соавт. [11],обогащение рациона МНЖК сопровождается уменьшением содержаниятриглицеридов и ХС липопротеидовочень низкой плотности в крови на 19 и 22,5 % соответственно. Одновременно констатировано повышение уровняХС липопротеидов высокой плотности.Результаты клинических исследованийдемонстрируют целесообразность обогащения рациона МНЖК для оптимизации показателей липидного обмена у больных СД2.
Компания Abbott NutritionInternational (ANI; Чикаго, Иллинойс,США) разработала специализированныйпродукт для ЭП “Глюцерна SR”, предназначенный для больных СД в качестве дополнительного источника энергии, а также макро- и микронутриентов [5,10]. Глюцерна SR содержит в расчете на 100 мл продукта: белки – 4,65 г, жиры – 3,38 г, углеводы – 11,09 г, фруктоолигосахариды – 0,42 г, пищевые волокна – 0,76 г, таурин – 8,4 мг, карнитин – 7,2 мг, инозитол – 84 мг; витамины: А – 70 мкг, β-каротин – 30 мкг, D3 – 1,1 мкг, Е – 8,5 мг, К – 8,4 мкг, С – 9,1 мг, В1 – 0,16 мг, В2 – 0,18 мг, В6 – 0,42 мг, В12 – 0,37 мкг, РР – 1,9 мг, пантотеновая кислота – 0,8 мг, фолиевая кислота – 84 мкг, биотин – 3,8 мкг, холин – 42 мг, натрий – 89 мг, калий – 156 мг, хлор – 132 мг, кальций – 64 мг, фосфор – 60 мг, магний – 18 мг, железо – 1,3 мг, цинк – 1,0 мг, марганец – 0,32 мг, медь – 210 мкг, йод – 16 мкг, селен – 4,5 мкг, хром – 51 мкг, молибден – 9,7 мкг. Калорийность – 89 ккал. В состав продукта входят казеинаты, мальтодекстрин, фруктоза, мальтитол, камедь, ацесульфам К, высокоолеиновое подсолнечное масло, каноловое масло, соевый лецитин, ароматизаторы, красители.
Целью настоящих исследований была сравнительная оценка величины и длительности ППГ у больных СД2 при потреблении специализированного продукта для ЭП “Глюцерна SR” и после стандартной пищевой нагрузки.
Материал и методы
Оценка динамики ППГ у больных СД2 была проведена в виде открытого двугруппового параллельного исследования.
Критерии включения:
1. Добровольное подписание информированного согласия, утвержденного Комитетом по этике НИИ питания РАМН.
2. Наличие верифицированного диагноза СД2.
3. Применение пероральных сахароснижающих препаратов в течение не менее двух месяцев до начала исследования.
4. Возраст старше 18 лет.
5. Пациент – мужчина или небеременная женщина, не собирающаяся забеременеть в процессе исследования.
6. Индекс массы тела – 25–40 кг/м2.
7. При применении тиреоидных препаратов или гормональной терапии использование их постоянной дозировки не менее двух месяцев до посещения врача для отбора в исследование.
8. Желание пациента следовать протоколу исследования.
Критерии исключения:
1. Наличие потребности в инсулине и применение инсулинотерапии у больного СД2.
2. Наличие СД типа 1.
3. Диабетический кетоацидоз в анамнезе.
4. Наличие инфекционного заболевания (требующего медикаментозного лечения), хирургическая операция в стационаре, системное лечение кортикостероидами в последние 3 месяца или антибиотиками в последние 3 недели перед началом исследования.
5. Активная стадия злокачественного новообразования (исключая базальноклеточный рак, плоскоклеточный рак, преинвазивный рак шейки матки).
6. Тяжелый сердечно-сосудистый приступ менее чем за 6 месяцев до включения в исследование или застойная сердечная недостаточность в анамнезе.
7. Терминальная стадия недостаточности внутренних органов или состояние после трансплантации органа.
8. Почечные заболевания, тяжелый парез желудка в анамнезе.
9. Наличие заболевания печени или желудочно-кишечного тракта в активной стадии или расстройств,
которые могут нарушить усвоение, распределение, метаболизм или выведение пищевых веществ,
исключая СД.
10. Наличие хронического эпидемического инфекционного заболевания, такого как туберкулез в активной стадии, вирусный гепатит В или С и ВИЧ.
11. Ежедневное применение лекарственных препаратов (исключая разрешенное медикаментозное лечение) в дозах, способных нарушить усвоение, метаболизм, выведение пищевых веществ, двигательную функцию желудка или повлиять на уровень глюкозы в крови.
12. Потеря сознания или другие побочные реакции при заборе проб крови до включения в настоящее исследование.
13. Нарушения свертываемости крови или кровотечения.
14. Указания на аллергические реакции на любые составляющие исследуемого продукта или их непереносимость.
15. Участие пациента в одновременно проводимом исследовании, вступающее в противоречие с данным исследованием.
В исследование были включены 34 больных СД2, женщины и мужчины в возрасте 57,5 ± 1,5 года, в стадии субкомпенсации углеводного обмена, без потребности в инсулине, находящихся на стандартной диетотерапии, имеющих сопутствующие заболевания, не требующие интенсивного лечения.
Все больные имели избыточную массу тела и ожирение I–II степеней. Индекс массы тела в среднем по группе составил 36,3 ± 0,7 кг/м2. На момент первичного обследования у всех больных определялась стадия метаболической субкомпенсации: уровень базальной гликемии в венозной крови в среднем по группе составил 7,3 ± 0,3, в капиллярной крови – 7,0 ± 0,6 ммоль/л.
Из сопутствующих заболеваний у обследованных больных диагностированы артериальная гипертензия (у 73,5 %), ишемическая болезнь сердца (у 41 %), хронический гастродуоденит (у 23,5 %), хронический некалькулезный холецистит (у 29,4 %), желчнокаменная болезнь (у 12 %), постхолецистэктомический синдром (у 6 %), мочекаменная болезнь (у 15 %), деформирующий артроз (у 44 %), хронический спондилез и остеохондроз позвоночника (у 30 %).
Больные СД2, включенные в настоящее исследование, методом случайной выборки были разделены на две однотипные группы: основную группу (n = 17) и группу сравнения (n = 17), сравнительная характеристика которых представлена в табл.1.
Таблица 1. Сравнительная характеристика больных СД2 в группах наблюдения.
Дизайн исследования
Все больные были предварительно проинформированы о процедуре исследования и правилах поведения в процессе исследования; получено информированное согласие всех пациентов на участие в настоящем исследовании.
Каждому пациенту дважды, с интервалом в одну неделю, проводилось исследование уровня глюкозы в капиллярной крови натощак (после 14-часового голодания) и через 30, 60, 90, 120, 180 и 240 минут после потребления 230 мл специализированного продукта для ЭП “Глюцерна SR” в виде напитка (со вкусом ванили), содержавшего 10,7 г белка, 7,8 г жира и 26,0 г углеводов. У пациентов группы сравнения в те же временные интервалы проведена оценка динамики ППГ после потребления 27 г пшеничного хлеба, 4,5 г сливочного масла и 250 мл питьевого стерилизованного молока 1,5 %-ной жирности. Содержание белка, жира и углеводов в тестируемой пищевой нагрузке составило 9,6, 7,79 и 26,0 г соответственно.
Эффективность специализированного продукта для ЭП “Глюцерна SR” оценивалась при сравнительном анализе ППГ после потребления тестируемого напитка и стандартной пищевой нагрузки, а также величин площадей под гликемическими кривыми, полученными в процессе настоящего исследования. Расчет площадей под гликемическими кривыми в исследованные временные интервалы (от 0 до 240 минут) проводили по общепринятой методике с учетом только тех участков площади под кривой, которые находились выше значения для нулевого момента времени. Участки площади под кривой, находившиеся ниже значения для нулевого момента времени, принимали равными нулю.
В процессе исследования проводился тщательный контроль над полным потреблением тестируемых пищевых нагрузок всеми пациентами, участвовавшими в исследовании. Забор крови производили из пальца с использованием одноразовых ланцетов. Уровень гликемии определяли с помощью глюкометра One Touch® Ultra™.
У всех испытуемых весь объем исследований выполнен полностью, отказов от продолжения исследований не было. В процессе исследования пероральные сахароснижающие и другие лекарственные препараты пациенты не принимали.
Полученные результаты исследований обработаны статистически на ПЭВМ с использованием пакета прикладных программ SPSS 11.5 для Windows. Результаты представлены в виде средних величин и их стандартной ошибки (M ± m). Оценка статистической значимости различий средних величин проведена с использованием t-критерия Стьюдента.
Результаты
Переносимость специализированного продукта для ЭП “Глюцерна SR” была хорошей, при этом каких-либо признаков его непереносимости не отмечено.
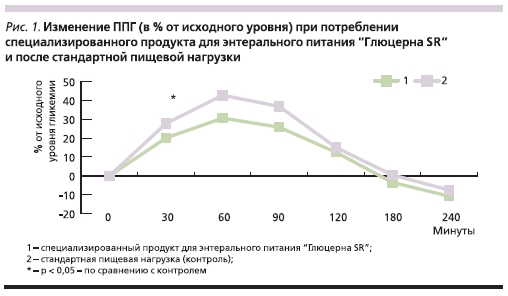
Динамика ППГ гликемии у больных СД2 при потреблении специализированного продукта для ЭП “Глюцерна SR” и после стандартной пищевой нагрузки представлена в табл. 2
и на рис. 1.
Таблица 2. Динамика ППГ у больных СД2 при потреблении специализированного продукта для
ЭП “Глюцерна SR” и после стандартной пищевой нагрузки (M ± m).
Из табл. 2 и рис. 1 следует, что потребление специализированного продукта для ЭП “Глюцерна SR” сопровождалось значимо меньшим повышением уровня гликемии через 30 минут от начала исследования по сравнению со стандартной пищевой нагрузкой (в среднем на 20,1 и 27,8 % от исходного уровня соответственно, p < 0,05). Через 60 и 90 минут после потребления продукта “Глюцерна SR” повышение уровня глюкозы в крови (в среднем на 30,6 и 25,8 % от исходного уровня соответственно) было меньшим, чем после стандартной пищевой нагрузки (в среднем на 42,7 и 36,8 % от исходного уровня соответственно), при этом статистически значимых различий в динамике
ППГ у больных СД2 в эти временные интервалы не отмечено. Через 120, 180 и 240 минут после тестируемых пищевых нагрузок уровень гликемии изменялся в равной степени, без значимых различий между группами.
Сравнительная оценка площадей под гликемическими кривыми у больных СД2 при потреблении специализированного продукта для ЭП “Глюцерна SR” и после стандартной пищевой нагрузки представлена на рис. 2.
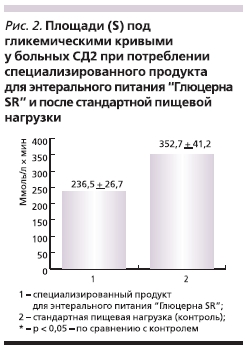
Оказалось, что площадь под гликемической кривой при потреблении продукта “Глюцерна SR” была значимо меньше, чем при стандартной пищевой нагрузке (236,5 ± 26,7 ммоль/л × мин против 352,7 ± 41,2 ммоль/л × мин, p < 0,05).
Таким образом, настоящим исследованием установлено, что потребление специализированного продукта для ЭП “Глюцерна SR” в количестве 230 мл сопровождалось менее выраженной послепищевой гликемической реакцией по сравнению со стандартной пищевой нагрузкой (27 г пшеничного хлеба, 4,5 г сливочного масла и 250 мл питьевого стерилизованного молока 1,5 %-ной жирности). Полученные данные согласуются с результатами исследований, свидетельствующими, что потребление специализированного продукта для ЭП “Глюцерна SR”, характеризующегося модифицированным углеводным и жировым составом, приводило к существенно меньшему повышению
глюкозы в крови по сравнению со стандартными смесями с преобладанием в их составе низкомолекулярных углеводов [3, 6, 17].
Выводы
Органолептическая оценка специализированного продукта для ЭП “Глюцерна SR” показала его хорошие органолептические качества и вкусовые свойства, при этом каких-либо неблагоприятных побочных явлений при его потреблении не отмечено.
Оценка ППГ и площадей под гликемическими кривыми у больных СД2 показала меньшую послепищевую гликемическую реакцию при потреблении специализированного продукта для ЭП “Глюцерна SR” в количестве 230 мл по сравнению со стандартной пищевой нагрузкой (27 г пшеничного хлеба, 4,5 г сливочного масла и 250 мл питьевого стерилизованного молока 1,5 %-ной жирности).
Результаты проведенной оценки эффективности специализированного продукта для ЭП “Глюцерна SR” позволяют заключить, что он может применяться в питании больных СД2 в качестве дополнительного источника энергии и макро- и микронутриентов.


