Введение
Пробиотики широко применяются в медицинской практике для нормализации микробиоты человека, профилактики и лечения различных воспалительных заболеваний желудочно-кишечного тракта (ЖКТ), постинфекционного синдрома раздраженного кишечника, при ожирении, сахарном диабете типа 2, артериальной гипертензии и др. [1–4]. Рассчитано, что общий геном бактерий, обнаруженных в ЖКТ, получивший обозначение как “микробиом”, насчитывает 400 тыс. генов, что в 12 раз превышает размер генома человека, насчитывающего 35 тыс. генов. Стабильность микробиома человека тесным образом связана с состоянием его здоровья. По праву можно сказать, что возможность стабилизации микробиома, т. е. микробиоты человека, определяет в настоящее время эру метабиомики в гастроэнтерологии [5]. Основные механизмы лечебно-профилактического действия пробиотиков представлены в таблице.
Целью настоящего сообщения является анализ данных по клеточному и молекулярному механизмам действия пробио тических бактерий, входящих в состав лечебно-профилактических препаратов.
Механизмы терапевтического действия пробиотических препаратов
Полагают, что эффект действия пробиотиков тесным образом связан с приживлением вводимых в организм человека, в данном случае в его ЖКТ, бактерий-симбионтов на слизистой оболочке кишечника, а также с особенностями их биологической, антагонистической и иммуностимулирующей активности [6–8]. В экспериментах на лабораторных животных и в исследованиях с участием людей показано, что после перорального введения живые бифидобактерии и лактобациллы приживаются на слизистой оболочке кишечника в течение нескольких дней. Позитивное действие живых пробиотических бактерий на организм может быть связано как с их иммуномодулирующей способностью, так и с конкуренцией за питательные вещества и рецепторы адгезии на эпителии; подавлением роста патогенных и условно-патогенных микроорганизмов в результате синтеза различных бактерицидных и бактериостатических веществ, инактивации и предотвращением поступления токсинов из просвета кишечника в системный кровоток [9–10].
Известно, что бактерии пробиотических препаратов способны взаимодействовать с эпителиальными клетками слизистой оболочки и нейтрофилами. Недавно было показано, что живые нейтрофилы при взаимодействии с жизнеспособными бактериями производственных штаммов Bacteroides bifidum 1, Lactobacillus plantarum 8P-A3 и Escherichia coli M-17 in vitro формируют во внеклеточном пространстве сетеподобные внеклеточные ловушки, максимально выраженные при взаимодействии с бифидобактериями [11].
Образраспознающие рецепторы
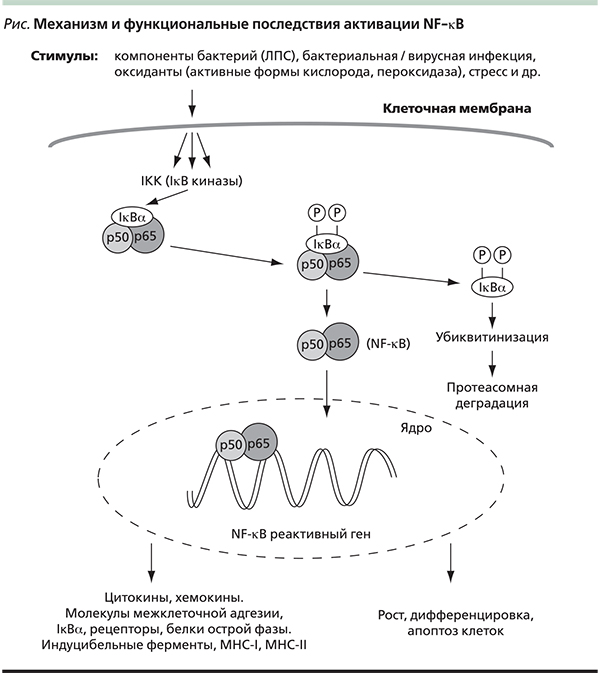
Важным является контакт вводимых пробиотических бактерий с образраспознающими рецепторами (ОРР) эпителиальных и иммунокомпетентных клеток, в частности с Toll-подобными рецепторами (TLR – Toll-like receptors). Подробные сведения об ОРР приведены в ряде обзоров [12–15]. В настоящее время известно три семейства ОРР: NOD-, маннозолектиновые рецепторы и TLR. NOD-рецепторы распознают, как правило, патогенные микроорганизмы. Все три типа рецепторов являются сигнальными, т. е. они распознают различные образы – т. н. лиганды, принадлежащие главным образом микроорганизмам и вирусам, оповещают об их приходе и запускают каскад реакций, обеспечивающих передачу сигнала к ядру иммунокомпетентной клетки. Важную роль играют эпителиоциты, фагоцитирующие и дендритные клетки (DCs – Dendtritic сells). DCs своими отростками проникают между эпителиоцитами. Передача сигнала от всех этих рецепторов проходит с использованием адапторной молекулы MyD88 и транскрипционного фактора NF-kB, приводит к продукции спектра различных медиаторов: провоспалительных и противовоспалительных цитокинов, интерферонов, катионных противомикробных пептидов, стимуляции процессов регенерации, апоптозу и др. Транскрипционный ядерный фактор NF-kB представлен группой консервативных плазматических белков, присутствующих во всех клетках человека. При стимуляции эти белки перемещаются в ядро, где связываются с промоторными участками многих генов, обеспечивая их экспрессию (см. рисунок). Мишенями служат гены, кодирующие синтез интерлейкина-1 (ИЛ-1), ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-12, фактора некроза опухоли α (ФНО-α), гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ), интерферона γ (ИФН-γ), а также адгезивных молекул межклеточного взаимодействия, острофазных белков, NO-синтазы, циклооксигеназы-2, β-дефенсинов, молекул главного комплекса гистосовместимости (MHC – major histocompatibility complex) и регуляторов апоптоза [16]. Следует отметить, что провоспалительные цитокины ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-8 обладают многофакторным действием в отношении ряда клеток организма: лейкоцитов, клеток центральной нервной системы, эндотелия сосудов, печени и др., при повышенной концентрации могут вызывать метаболические, гормональные и нейроэндокринные эффекты [16, 17].
TLR обнаружены у клеток эпителия, эндотелия, моноцитов и макрофагов, полиморфно-ядерных лейкоцитов, дендритных клеток, т. е. у клеток, в первую очередь вступающих в контакт с чужеродными агентами. У человека идентифицировано наличие одиннадцати TLR, распознающих различные, в основном экзогенные и некоторые эндогенные, молекулярные структуры.
Установлено, что:
- TLR1 формирует гетеродимеры с TLR2 и распознает триациловые липопептиды;
- TLR2 во взаимодействии с TLR1 и TLR6 распознает пептидогликан, липопептиды и липопротеиды грамположительных бактерий, липопротеиды микоплазм и зимозан дрожжевых грибов;
- TLR3 распознает двунитевую РНК;
- TLR4 вместе с внеклеточными белками MD2, CD14 и LBP (Lipo-polysaccharide binding protein) распознает бактериальные липополисахариды;
- TLR5 распознает бактериальные флагеллины;
- TLR6 в ассоциации с TLR2 узнает диациловые липопептиды;
- TLR7 и TLR8 распознают однонитевую РНК;
- TLR9 – неметилированные дезоксцитидил-фосфат-дезоксигуанозин (СрG)-структуры;
- Лиганды TLR10 и TLR11 пока не идентифицированы.
Сигнальный путь, инициированный взаимодействием бактериальных лигандов с разными TLR
После лиганд-рецепторного контакта дальнейший путь является общим для большинства клеточно-опосредованных процессов. Этот путь включает взаимодействие с протеином MyD88, отвечающим за дифференциацию миелоидов. Рецепторы TLR мобилизуют MyD88, используя домен TIR (Toll-IL-1-Receptor). Дальнейшая передача сигнала осуществляется через протеинкиназу IRAK, ассоциированную с IL-1R, и через фактор TRAF6 (TNF receptor-associated factor 6), ассоциированный с рецептором ФНО-α.

Это вызывает активацию фактора NF-kB и MAP-киназы, что ведет к экспрессии различных биологически активных молекул, указанных выше. Совокупность TLR и других рецепторов обеспечивает распознавание ряда консервативных структур микроорганизмов и вирусов, развитие реакций врожденного и адаптивного иммунитета. Следует отметить, что реакция образования цитокинов на грамположительные и грамотрицательные бактерии-комменсалы может полностью меняться, когда моноциты дифференцируются на DCs. В той же работе показано, что различные бактерии-комменсалы могут по-разному участвовать в регуляции мукозного и системного иммунитета. Была изучена реакция двух типов антигенпрезентирующих клеток, моноцитов и DCs на различные штаммы типичных бактерий кишечной микрофлоры. Очищенные человеческие моноциты и дендритные клетки, производные моноцитов, стимулировали УФ-инактивированными грамположительными бактериями L. plantarum и Bifidobacterium adolescentis, а также грамотрицательными бактериями E. coli и Veillonella parvula. При этом было установлено, что моноциты продуцировали более высокие уровни ИЛ-12 и ФНО-α при стимуляции бактериями L. plantarum, чем при стимуляции бактериями E. coli и V. parvula. В противоположность тому DCs, производные моноцитов, продуцировали большие количества ИЛ-6, ИЛ-10, ИЛ-12 и ФНО-α при стимуляции E. coli и V. parvula, но не реагировали на L. plantarum и B. adolescentis. Слабый ответ на грамположительные бактерии коррелировал с низкой экспрессией на поверхности клеток рецепторов TLR2 [18].
Ранее, когда речь шла о функциях TLR, подразумевалась их способность распознавать структуры патогенных микроорганизмов. Однако многие лиганды, взаимодействующие с TLR, характерны не только для патогенов, но и для представителей нормальной микрофлоры. Было широко распространено мнение о том, что организм хозяина не отвечает воспалительной реакцией на нормальную микрофлору кишечника в связи с развитием у новорожденных местной толерантности. Полагали, что клетки кишечного эпителия отличают нормальную микрофлору от чужеродной патогенной в связи с тем, что TLR не реагируют на лиганды нормальной микрофлоры. Поэтому само собой полагали, что TLR не распознают лиганды пробиотических бактерий, которые в своем большинстве являются представителями нормальной микрофлоры человека. Однако сравнительно недавно показано, что иммунная система кишечника в норме распознает и отвечает на антигены нормальной микрофлоры и микрофлора влияет на экспрессию генов в клетках, презентирующих антигены [19].
Доказательства важности взаимодействия лигандов нормальной микрофлоры кишечника с TLR
Установлено, что распознавание комменсальной микрофлоры TLR осуществляется в физиологических условиях, что это распознавание необходимо для поддержания кишечного гомеостаза. Авторы вызывали повреждения кишечного эпителия у мышей путем перорального введения декстрансульфата натрия. У животных, дефектных по MyD88, тяжесть поражений кишечного эпителия, потеря веса и смертность были весьма высокими по сравнению с животными дикого типа. Несколько повышенная чувствительность к декстрансульфату натрия была обнаружена также у животных, дефектных по TLR4 или TLR2 [20].
У мышей с дефектным MyD88 гомеостаз кишечного эпителия, синтез протективных цитокинов, а также синтез цитопротективных белков теплового шока были нарушены и до, и после обработки декстрансульфатом. Высокая чувствительность дефектных животных не была связанной с избыточным ростом кишечной микрофлоры. Более того, подавление микрофлоры антибиотиками приводило к подавлению синтеза протективных цитокинов и повышению чувствительности к повреждающему агенту. Введение животным липополисахарида (ЛПС) или липотейхоевой кислоты в относительно небольших дозах защищало животных от повреждающего действия декстрансульфата [20].
Таким образом, нормальная микрофлора кишечника постоянно взаимодействует с TLR и обеспечивает осуществление важных физиологических функций в организме животного.
В связи с этим следует рассматривать две функции TLR: защиту от инфекции и поддержание тканевого гомеостаза.
В осуществлении обеих функций очень важная роль принадлежит лигандам нормальной микрофлоры кишечника.
Известна корреляция рецидивов воспалительной реакции в тонкой кишке при болезни Крона с двумя маркерами, являющимися вариантами CARD-15, и третьим маркером, ассоциированным с геном, кодирующим синтез рецептора ИЛ-23. Мутации в данном гене могут быть также маркером риска развития и неспецифического язвенного колита. Длительное время ключевым медиатором воспаления слизистой оболочки при болезни Крона считали ИЛ-12, т. к. подавление его активности за счет делеции гена или направленных антител уменьшало выраженность воспаления в кишке. Однако роль ИЛ-12 в патогенезе болезни Крона была пересмотрена после обнаружения ИЛ-23Р, являющегося провоспалительным цитокином с уникальной субъединицей р19 и субъединицей р40, как и у ИЛ-12. Показано, что ИЛ-23 участвует в ряде воспалительных каскадов, увеличивая экспрессию ИЛ-17 клетками слизистой оболочки кишечника у пациентов с активными формами болезни Крона и неспецифическим язвенным колитом. Селективная инактивация субъединицы ИЛ-23 р19 при помощи моноклональных антител на биологической модели колита уменьшает выраженность кишечного воспаления и ингибирует развитие воспаления толстой кишки при дефиците ИЛ-10, в то время как блокада ИЛ-12 р35, напротив, оказывает небольшое влияние на воспаление в кишке [21].
Различия в эффектах действия различных пробиотических штаммов лактобацилл
Как было отмечено выше, лактобациллы в норме активируют иммунную систему кишечника, взаимодействуя с TLR2, однако механизмы действия разных пробиотических штаммов лактобацилл могут быть различными. Так, бактерии Lactobacillus acidophilus, L. casei и L. delbrueckii вызывали повышение содержания ФНО-α и ИФН-γ, а заметное повышение ИЛ-4 и ИЛ-10 обнаружены главным образом у животных, получавших L. delbrueckii и L. casei, тогда как существенное повышение продукции ИЛ-2 и ИЛ-12 отмечено только при введении L. acidоphilus [22].
В другой работе показано, что при пероральном введении L. casei в основном активировались клетки врожденной иммунной системы c увеличением содержания рецептора TLR2 и В-лимфоцитов, синтезирующих иммуноглобулин А (IgA), специфичных в отношении L. casei, без повышения популяции Т-клеток, т. е. определяется клональное распределение популяции В-клеток [23].
Интересные данные получены при изучении первичных культур эпителиальных клеток, изолированных от лабораторных животных, с кормом получавших пробиотические лактобациллы. Полученные первичные эпителиальные культуры обрабатывали живыми или убитыми бактериями L. casei или E. coli и сыворотками против TLR2 или TLR4. Исследования выявили различия в концентрации ИЛ-6, необходимого для дифференциации В-клеток, что позволило авторам сделать заключение о том, что эпителиальные клетки кишечника распознают и отличают пробиотические лактобациллы от патогенов, отвечая различными уровнями продукции цитокинов. При использовании таких же культур первичных эпителиальных клеток ободочной кишки показано также, что пробиотик Lactobacillus rhamnosus (LGG) и бактерии Bacteroides ovatus и E. coli, взаимодействуя с TLR2 и TLR4 соответственно, индуцировали синтез разных цитокинов, причем при совместном культивировании пробиотик LGG подавлял синтез цитокинов, индуцированный B. ovatus и E. coli. По-видимому, противовоспалительное действие LGG in vivo опосредовано его взаимодействием с TLR4. Это предположение подтверждается данными о том, что терапевтическое противовоспалительное действие пробиотиков при экспериментальном колите опосредовано TLR9 [24].
Оригинальные данные были получены при изучении действия препарата VSL#3, содержащего 8 пробиотических штаммов – 3 бифидобактерии (Bifidobacterium longum, B. breve, B. infantis), 4 лактобациллы (L. casei, L. plantarum, L. acidophilus, L. delbrieckii subsp.bulgaricus) и 1 штамм Streptococcus salivarius – при экспериментальном колите, вызванном введением декстрансульфата натрия мышам дикого типа и дефектном по адаптеру MyD88 или одному из рецепторов TLR2, TLR4 и TLR9. Мышам вводили в желудок или под кожу живые, облученные гамма-лучами или обработанные ДНКазой бактериальные клетки пробиотика VSL#3, их ДНК (нативную или метилированную), а также ДНК E. coli и тимуса теленка. Введение ДНК пробиотика и E. coli смягчало выраженность течения колитов, в то время как метилированная ДНК пробиотика, ДНК тимуса теленка и клетки пробиотика, обработанные ДНКазой, такого эффекта не давали. Тяжесть течения колитов снижалась в одинаковой степени при введении живых или убитых облучением пробиотиков. Мыши, дефицитные по MyD88, не реагировали на введение пробиотиков. У мышей, дефицитных по TLR2 или TLR4, выраженность течения колита существенно снижалась, тогда как при дефиците TLR9 терапевтический эффект полностью отсутствовал. Эти данные показывают, что терапевтическое действие пробиотиков обусловлено взаимодействием клеток пробиотика (живых или убитых облучением) или их ДНК с TLR, особенно с TLR9 [25, 26].
Все эти материалы показывают, что с TLR могут взаимодействовать и цельные клетки пробиотика, живые или убитые, и их компоненты. Так, пептидогликан лактобацилл активизирует Тоll-подобные рецепторы, индуцирует заметный антиопухолевый эффект в толстой кишке и обусловливает развитие иммунной реакции типа Th1, опосредованной активацией макрофагов [27].
Супернатанты B. breve индуцируют созревание, активацию и выживаемость DCs путем воздействия на TLR2, но не взаимодействуют с TLR4, TLR7 и TLR9 [28]. И в этом случае действующим началом супернатанта являлся пептидогликан клеточной стенки бактерий. Интересно отметить, что супернатант пролонгировал выживаемость дендритных клеток при высокой степени синтеза ИЛ-10 и низкого уровня продукции ИЛ-12 в отличие от того, что наблюдалось при обработке дендритных клеток ЛПС. Более того, супернатант подавлял влияние ЛПС на дендритные клетки. По мнению авторов, супернатант оказывал регуляторное воздействие на профили дендритных клеток, ограничивая чрезмерный ответ по типу Тh1 и чрезмерную поляризацию Тh2, которая наблюдается у новорожденных детей с атопией. Таким образом, моноциты становятся неспособными реагировать на грамположительные пробиотические бактерии в связи с низкой экспрессией рецептора TLR2. Известно, что повышенный транспорт циркулирующих прекурсоров гемопоэтических клеток CD34+ является важной особенностью при системных аллергических воспалениях. Кишечные бактерии и их продукты обладают способностью стимулировать транскрипцию созревающих цитокинов ИЛ-12 и ИФН-γ путем активизации TLR и ядерного фактора NF-γB.
При исследовании влияния орального в течение месяца приема пробиотика, содержащего L. acidophilus, L. delbrueckii и S. thermophilus, показано значительное снижение количества циркулирующих клеток CD34+ у 12 из 14 человек с клиническими симптомами раздраженного кишечника, астмы, конъюнктивита, ринита, крапивницы, атопического дерматита и пищевой аллергии, причем у этих 12 пациентов ранее были обнаружены антиген-специфические сывороточные IgE [29].
Иммуностимулирующая активность нуклеиновых кислот симбионтов
Недавно установлено, что кишечная микробиота и нуклеиновые кислоты, поступающие с пищей, играют важную роль в формировании оральной толерантности. Известно, что пробиотическое действие некоторых штаммов обусловлено наличием в структуре их ДНК иммуностимулирующих олигонуклеотидов. Так, в результате изучения 9 штаммов Lactobacillus и 6 штаммов Streptococcus thermophilus было установлено, что иммуностимулирующей активностью обладала только ДНК из штамма L. bulgaricus NIAI B6, которая содержала СрG-подобный олигонуклеотид [30].
Сильная иммуностимулирующая активность была выявлена у одного из фрагментов ДНК штамма L. gasseri 2716, который содержал АТ-олигодезоксинуклеотиды с шестиосновной самостабилизирующейся петлей [31]. Показано, что пищевые нуклеиновые кислоты могут действовать путем вовлечения ДНК, содержащей CpG-мотив, в процесс активации TLR. Указанная последовательность ДНК обладает иммуностимулирующей активностью. Изучение профилей цитокинов ИЛ-4 и ИФН-γ на безмикробных и моноассоциированных B. infantis мышах линии BALB/c, которых в течение 4 недель содержали либо на свободной от ДНК казеиновой диете, либо на казеиновой с добавлением ДНК, показало снижение образования ИЛ-4 у мышей, содержащихся на диете с ДНК, в обеих группах животных. Однако в группе ассоциированных бифидобактериями животных диета с ДНК приводила к повышению секреции ИФН-γ. Таким образом, потребление с пищей ДНК, лишенной мотива CрG, вкупе с кишечной микробиотой может предотвращать развитие аллергии, т. к. способствует изменению баланса Th1/Th2 в сторону Th1-направленного иммунитета [32].
Последовательность оснований ДНК с иммуностимулирующей активностью, характерная для лактобацилл, была обнаружена у штамма B. longum BB536. ДНК этого штамма ингибировала образование IgE B-клетками, что может объяснить механизм антиаллергического действия бактерий B. longum BB536 [33]. Липотейхоевые кислоты из штаммов Lactobacillus johsonii La1 и L. acidophilus La10 подавляли ответ клеток кишечника человека HT29 на эндотоксин грамотрицательных бактерий [34]. Особое внимание в настоящее время обращено на роль представителей рода Lactobacillus, обеспечивающих экологический барьер защиты организма человека [35].
Заключение
На основании рассмотренных материалов можно сделать заключение о том, что эффект терапевтического действия пробиотических препаратов может быть обусловлен бактериальными клетками, живыми или убитыми, их поверхностными структурными компонентами и ДНК, в основе действия которых лежат лиганд-рецепторное взаимодействие с Toll-подобными рецепторами и последующая активация клеточного и гуморального звеньев врожденного иммунитета. Отмечена важность изучения иммуномодулирующей активности пробиотических бактерий, значительно зависящей от используемого на практике вида и штамма пробиотика, которая в комплексе с данными адгезивной, колонизирующей и антагонистической его активности может определять алгоритм выбора оптимального препарата для конкретного клинического случая.


