Актуальность
Кожа является самым крупным органом человека, поэтому его основная функция заключается в защите организма от широкого спектра внешних факторов: физических, химических и микробных агентов. В этом контексте существуют сильные симбиотические отношения между микроорганизмами, которые составляют ее микробиоту. Можно выделить многочисленные взаимодействия отношений между микроорганизмом и хозяином, среди которых чаще всего встречаются три категории: паразитизм, комменсализм или мутуализм. Защитная функция кожи обеспечивается действием нескольких факторов: физического барьера, pH кожи и выработки генетически детерминированных защитных молекул, таких как антимикробные пептиды, протеазы, лизоцимы, цитокины и хемокины, которые служат активатором врожденного иммунных ответов, а также реактивностью иммунных клеток (Т-лимфоцитов, макрофагов, клеток Лангерганса и т.д.) [1]. Факторы вирулентности, вырабатываемой микроорганизмом, помогают уходить от иммунного ответа хозяина, но в конечном итоге уровень суммарной эффективности защитных механизмов кожного барьера определяет, является ли микроб организмом комменсалом (или взаимным), или опасным патогеном для хозяина.
Негативное воздействие бактерий и грибов на организм многообразно, т.к. включаются различные патогенетические механизмы повреждения кожных покровов. При колонизации кожи патогенной флорой выделяется масса экзогенных протеаз (ферментов, разрушающих корнеодесмосомы), в результате чего усиливаются десквамативные процессы в поверхностных слоях эпидермиса. Результатом данного воздействия служит ксероз кожи и нарушение барьерных свойств эпидермиса [2]. Наиболее значимым триггером среди инфекционных агентов является золотистый стафилококк, который не только усиливает отторжение роговых чешуек, но и вырабатывает супертоксины, в т.ч. и экзотоксин – дельтатоксин, воздействующий на рецепторы тучных клеток, вызывая неспецифическую дегрануляцию и высвобождение биологически активных веществ, что клинически проявляется утяжелением уже имеющегося экзематозного процесса [3]. Количество синтезируемого бактериями токсина у разных больных значительно варьируется. Его выработка усиливается при высоком уровне колонизации для подавления роста «соседней» флоры, в т.ч. и сапрофитной [4]. С другой стороны, при наличии длительно незаживающих язв или ран бактериальная и грибковая флора может способствовать развитию сенсибилизации, т.е. инфекционные агенты и их токсины могут восприниматься организмом как аллергены и стать причиной развития инфекционно-аллергического дерматоза. Таким образом, колонизация кожи патогенной флорой является одновременно и причиной, и следствием аллергического воспаления кожи.
По частоте заболеваемости в педиатрической практике пациенты с аллергодерматозами, осложненными вторичной инфекцией, занимают первое место и составляют 30–40% от общего числа обращений к врачампедиатрам, дерматологам и аллергологам. Наиболее частыми проявлениями явяются атопический дерматит (АтД) с явлениями вторичного инфицирования, микробные экземы, распространенная чесотка, осложненная пиодермией, себорейный дерматит (экзема), паратравматическая экзема, контактно-аллергический дерматит, осложненный вторичной инфекцией.
АтД – одно из самых распространенных заболеваний в детском возрасте, частота его встречаемости составляет около 20% [5]. При АтД отмечаются выраженные изменения в иммунной системе, проявляющиеся подавлением клеточной защиты (снижение уровня естественных киллеров, дисбаланс Тh1 и Th2, снижение продукции интерферона-γ и др.) [6]. Последние исследования показали, что у лиц с активной формой АтД отмечается снижение уровня антимикробных пептидов в коже [7]. При данном заболевании также выявляется нарушение эпидермального барьера, которое создает предпосылки к более легкому проникновению бактерий вглубь кожи, а сопутствующий зуд и последующие расчесы служат входными воротами для различных инфекционных агентов [8]. Отмечено, что у пациентов с АтД заметно меняется микрофлора кожи. У больных АтД традиционно обнаруживают грамположительные бактерии (Staphylococcus spp., ведущую роль среди которых играет Staphylococcus aureus, почти всегда обнаруживаемая в очагах острого воспаления; Streptococcus pyogenes); дрожжеподобные грибы (Candida, Malassezia), а также грамотрицательные бактерии. Эти микроорганизмы запускают каскад иммунологических реакций, приводящих к повреждению эпидермальных клеток, тем самым еще более усугубляя нарушение эпидермального барьера [9]. Именно с этими особенностями связан тот факт, что более чем в 80% случаев АтД осложняется вторичным инфицированием кожи с развитием стрептостафилодермий и кандидоза гладкой кожи. В отсутствие антибактериальной терапии возможна генерализация инфекционного процесса с развитием жизнеугрожающих состояний, таких как сепсис, эндокардит, инфекционное поражение костей и суставов [10–12].
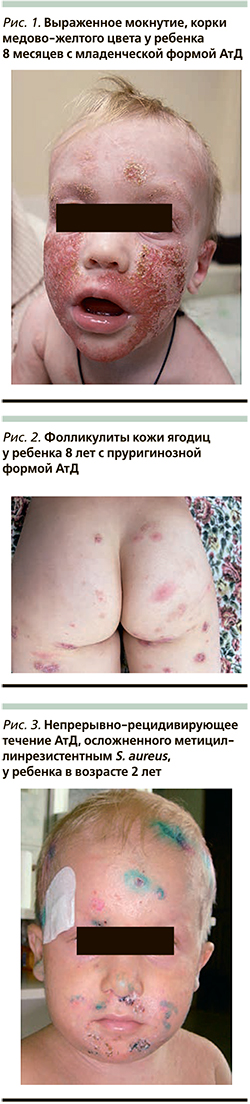
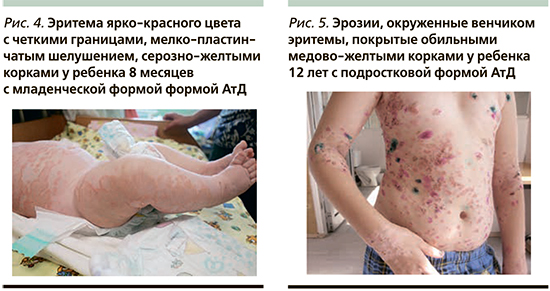
К типичным клиническим признакам вторичного инфицирования АтД S. aureus относят усиление мокнутия в очагах поражения, появление корок медово-желтого цвета, нефолликулярных и фолликулярных пустул [13, 14] (рис. 1, 2). АтД, осложненный метициллинрезистентным S. aureus, характеризуется тяжелым, непрерывно-рецидивирующим течением, устойчивым к адекватно подобранной базисной терапии (рис. 3). Нередко метициллинрезистентный S. aureus служит причиной развития абсцессов, лихорадки и лимфаденопатии у больных АтД. Вторичное инфицирование АтД S. pyogenes характеризуется появлением эритемы ярко-красного цвета с четкими границами, фликтен, пустул с плотной покрышкой и обильными корками на поверхности [15, 16] (рис. 4, 5). β-гемолитический стрептококк группы А может вызывать у больных, страдающих АтД, ангулярный стоматит, эктиму и рожистое воспаление (рис. 6).
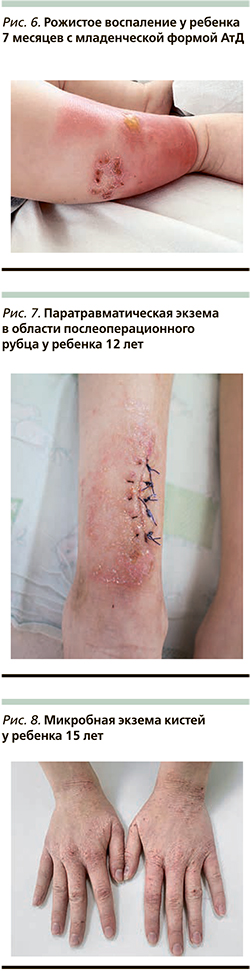
Микробная экзема – одна из наиболее частых форм экзем в детском и подростковом возрасте. В ее патогенезе ведущая роль отводится сенсибилизации к микробному агенту на фоне выраженного изменения иммунитета. Многие дерматологи рассматривают микробную экзему в детском возрасте особым вариантом течения АтД [17].
Так как пиогенная флора обладает выраженной антигенной активностью, она является провоцирующим, поддерживающим и утяжеляющим заболевание фактором у больных экземой. Предпосылками к развитию микробной экземы также становятся генетическая предрасположенность, длительная антигенная стимуляция, наличие очагов хронической инфекции (тонзиллиты, синуситы, воспалительные заболевания мочевыводящей системы и др.), заболевания внутренних органов и систем. Также в патогенезе микробной экземы важную роль играют экссудативные процессы, сопровождающиеся гноетечением (сенсибилизация к белковым структурам, межтканевой жидкости), а также непосредственно процесс мацерации кожи, развивающейся при инфекционном воспалении и значительно нарушающей кожный барьер [18].
Среди микробных экзем у детей чаще встречаются паратравматическая экзема, микробная экзема кистей, себорейная экзема, нуммулярная экзема.
Паратравматическася экзема – особый тип экзематозного процесса, который развивается в области послеоперационных рубцов, в местах открытых переломов, свищей, трофических язв, длительно не заживающих ран, вокруг слухового прохода при гнойных отитах и т.д. В основе патогенеза паратравматической экземы лежит развитие аллергической реакции и сенсибилизации кожи к пиогенным возбудителям (стафилококкам и стрептококкам) и их токсинам [19]. Клиническая картина паратравматической экземы характеризуется появлением островоспалительной эритемы, экссудативных папул и/ или пустул, наслоения чешуйко-корок (рис. 7). Особенность течения данной разновидности микробной экземы – это быстрый регресс экзематозного процесса при стихании инфекционного воспаления и эпителизация кожного дефекта.
Микробная экзема кистей является одной из наиболее торпидных форм экземы в детском возрасте, т.к. часто развивается на фоне АтД (особой формы т.н. неспецифического дерматита кистей) и поддерживается многими провоцирующими факторами, особо актуальными для детей и подростков (частые контакты с водой и снегом, пренебрежение перчатками и варежками в холодное время года, повышенная травматизация и др.) [6]. Нередко течение микробной экземы кистей в подростковом возрасте осложняет гипергидроз, развивающийся на фоне дисфункций вегетативной нервной системы [19]. Клиническая картина микробной экземы кистей характеризуется появлением отчетливо очерченных, отечных и/или инфильтрированных очагов эритемы ярко-розового цвета, папулезно-везикулезных элементов, наслоением серозно-гнойных корок (рис. 8).
Нуммулярная экзема, по-видимому, представляет собой наиболее сложную разновидность микробной экземы с недостаточно изученным этиопатогенезом. Данный вид экземы наиболее часто развивается у детей с АтД (нередко в состоянии ремиссии), у лиц с очагами хронической инфекции, а также на фоне сниженного иммунитета. По данным литературы, в развитии нуммулярной экземы могут играть значение несколько факторов: дефект эпидермального барьера кожи, колонизация кожи S. aureus, наличие сенсибилизации к металлам (никель, хром), аэроаллергенам (клещи ломашней пыли) и к дрожжевой флоре (Candida albicans) [20–24]. Клиническая картина нуммулярной экземы характеризуется появлением на коже округлых бляшек (размером от 1 до 10 см в диаметре) с четкими границами, покрытых чешуйками или чешуйко-корками. Высыпания чаще встречаются на конечностях.
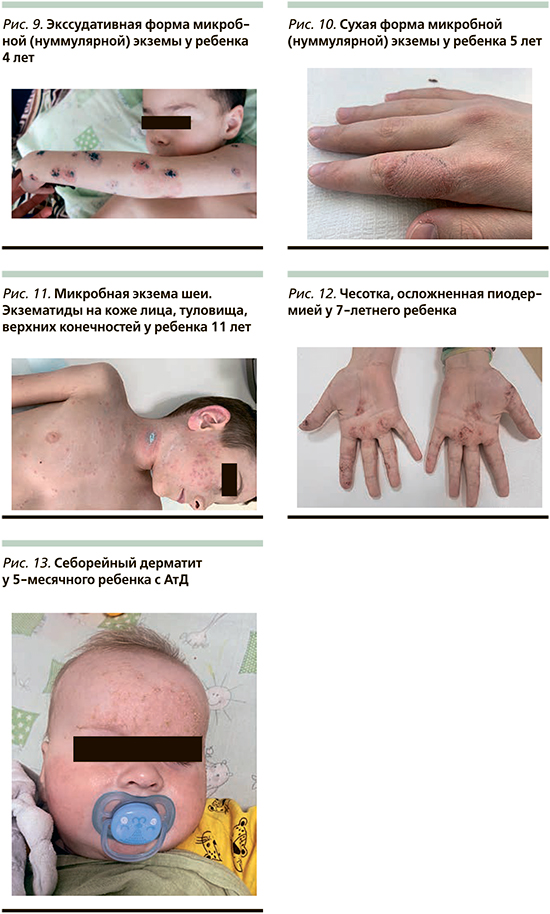
Выделяют несколько клинических форм нуммулярной экземы: экссудативную и сухую. При экссудативной форме отмечается острое начало: нередко на месте травмы или очага пиодермии появляются папулы или везикулы, которые образуют сливные бляшки, покрытые чешуйками и/ или серозно-гнойными корочками, могут встречаться очаги мокнутия. Субъективно беспокоит выраженный зуд. Высыпания могут носить распространенный характер (рис. 9). Сухая форма нуммулярной экземы чаще бывает ограниченной. Чаще появляется на фоне сухости кожи и воздействия внешних раздражающих факторов (неблагоприятные метеоусловия, мыло, бытовая химия и т.д.). Клинически данная форма характеризуется эритематозно-сквамозными высыпаниями округлой формы, нередко бледно-розового цвета, сопровождающимися умеренным зудом (рис. 10). При всех микробных экземах возможно развитие ID-реакции (аутоэкзематизация) – развитие острого дерматита в виде поражения кожи на удалении от первичного воспалительного очага. Отечественные дерматологи ранее называли дочерними высыпаниями, при такой форме экзем экземидами и микотидами. Болезнь развивается вследствие гиперреактивности кожи, индуцированной иммунологическими или неиммунологическими факторами [25]. Клинически характеризуется появлением распространенных зудящих папуло-везикулезных высыпаний, чаще всего локализующихся на конечностях (рис. 11).
Чесотка – распространенное паразитарное заболевание кожи, которое часто осложняется пиодермией и аллергическими состояниями, особенно в детском возрасте. Развитие пиогенных осложнений связано, с одной стороны, глубоким проникновением в кожу «нестерильного» клеща, с другой – нарушением целостности кожного барьера при постоянном расчесывании. Патогенез аллергической реакции связан с сенсибилизацией организма к возбудителю или к продуктам его жизнедеятельности. Характеризуется появлением аллергического дерматита, экземы, крапивницы и обострением АтД [6].
К наиболее распространенным пиогенным осложнениям чесотки относят стафилококковое импетиго (рис. 12), остиофолликулиты, эктима, фурункулы, значительно реже встречается микробная экзема (постскабиозная форма) [26, 27].
Себорейный дерматит/экзема – распространенное хроническое рецидивирующее воспалительное заболевание кожи, встречающееся у детей грудного и подросткового возраста. Гиперпродукция кожного сала, генетическая предрасположенность, нарушение барьерной функции кожи, измененный иммунный ответ на липофильные резидентные дрожжи Malassezia spp. служат предпосылкой для развития себорейного дерматита [28]. Клинические проявления себорейного дерматита могут быть разнообразными: от незначительной перхоти на голове до экзематозной реакции, сопровождающейся появлением желтовато-розовых эритематозных инфильтрированных бляшек, чешуек желтого цвета жирной консистенции (рис. 13), серозно-гнойной экссудации, ретроаурикулярных трещин.
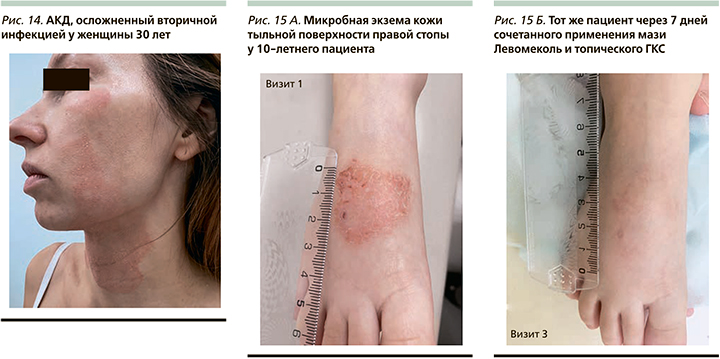
Дерматиты (простой контактный, контактно-аллергический) – воспалительные поражения кожи, возникающие в результате непосредственного воздействия на нее внешних факторов. Различают простые (артифициальные) и аллергические (сенсибилизационные) дерматиты. Простой контактный дерматит возникает при воздействии на кожу облигатных (обязательных) раздражителей, которые могут быть химическими, физическими, биологическими и механическими. Степень выраженности воспалительных явлений зависит от силы раздражителя и времени его воздействия на кожу, в связи с чем в развитии простого дерматита выделяют три стадии: эритематозную, везикулобуллезную и некротически-язвенную. Воспалительные изменения по площади строго соответствуют месту воздействия раздражителя и возникают без скрытого периода. Аллергический контактный дерматит (АКД) возникает под влиянием факультативных раздражителей (сенсибилизаторы) у лиц с повышенной чувствительностью к ним и патогенетически представляют собой аллергическую реакцию замедленного тип [29]. Изменения кожи при АКД в отличие от простого возникают после скрытого периода (от 7–10 дней до 1 месяца и дольше). Клиническая картина АКД сходна с таковой при острой экземе, в связи с чем в его течении различают эритематозную, везикулезную, мокнущую, корковую и сквамозную стадии. Нарушение целостности кожного покрова в результате постоянного расчесывания способствует присоединению вторичной инфекции. К преобладающим аэробным и факультативным бактериям относятся S. aureus и гемолитические стрептококки группы А [30]. Клиническая картина вторичного инфицирования простого контактного и АКД характеризуется усилением эритемы, появлением пустул, четких границ высыпаний, выраженного мелко-пластинчатого шелушения и/или корок медово-желтого цвета на поверхности (рис. 14).
Наружные лекарственные препараты являются неотъемлемым компонентом как для этиопатогенетического, так и для симптоматического лечения аллергодерматозов, осложненных вторичной инфекцией. Преимущество наружных антибактериальных средств заключается в способности создавать высокие бактерицидные концентрации в очаге поражения на коже по сравнению с системной антибактериальной терапией [31]. Поскольку клиническая картина вторичного инфицирования при аллергодерматозах не позволяет делать точного заключения о природе возбудителя, необходимо выбирать антибиотик, эффективный в отношении как стрептококков, так и S. aureus. Из наружных антибактериальных средств данным требованием отвечает мазь Левомеколь®, в состав которой входят действующие вещества: диоксометилтетрагидропиримидин (метилурацил) и хлорамфеникол, а также вспомогательные компоненты: макрогол-1500 и макрогол-400. Хлорамфеникол оказывает выраженное бактериостатическое действие. Он активен в отношении как грамположительных бактерий: Staphylococcus spp., Streptococcus spp.; так и грамотрицательных: Neisseria gonorrhoeae, Neisseria meningitidis, Escherichia coli, Haemophilus influenzae, Salmonella spp., Shigella spp., Klebsiella spp., Serratiaspp, Yersinia spp., Proteus spp., Rickettsia spp., активен также в отношении некоторых крупных вирусов [32]. Устойчивость микроорганизмов к хлорамфениколу развивается относительно медленно. Метилурацил, входящий в состав мази Левомеколь®, усиливает рост и размножение клеток, улучшая течение регенерации в поврежденных тканях, ускоряет заживление ран, язв, ожогов. Вспомогательное вещество макрогол создает влажную раневую среду, так необходимую для активизации процессов очищения и заживления раны.
Поскольку лечение аллергодерматозов, осложненных вторичной инфекцией, невозможно представить без применения лекарственных средств, содержащих глюкокортикостероиды (ГКС), основной задачей является максимальное снижение риска возникновения побочных эффектов при сохранении (усилении) их эффективности. Соответственно, выбор топического ГКС должен основываться на этиопатогенезе дерматоза, характере патологического кожного процесса и стадии воспаления. Соответственно, может быть выбран ГКС для наружного применения слабой или средней степени активности, также необходимо учитывать кратность его нанесения. Цель исследования: оценка терапевтических эффектов и безопасности применения мази Левомеколь® в рутинной клинической практике у детей с вторично-инфицированным дерматозом. Задачи исследования: оценка противовоспалительной, микробиологической эффективности, а таже безопасности применения мази Левомеколь® при аллергодерматозах, осложненных вторичной инфекцией, у детей старше 1 года.
Методы
С 9 января по 30 мая 2022 г. на базе Детской городской клинической больницы им. З.А. Башляевой проведено неинтервационное проспективное исследование препарата Левомеколь® в реальной клинической практике у детей с дерматозами, осложненными вторичной инфекции.
Под нашим наблюдением находились 35 больных (17 мальчиков и 18 девочек) в возрасте от года до 18 лет с диагнозами:
- АтД, осложненный вторичной инфекцией, 23 пациента;
- АКД, осложненный вторичной инфекцией, 4 пациента;
- ирритантный дерматит, осложненный вторичной инфекцией, 2 пациента;
- микробная экзема, 6 пациентов.
Для лечения вторично-инфицированных дерматозов все пациенты получали комбинированную терапию мазью Левомеколь® 2 раза в сутки совместно с применением топических ГКС 1–2 раза в сутки (метилпреднизолона ацепонат, бетаметазона дипропионат, гидрокортизона ацетата, флуоцинолона ацетонид). Выбор топического ГКС и кратность его нанесения определялись механизмом развития инфекционно-аллергического дерматита. Наблюдение за пациентами (оценка субъективных и объективных признаков заболевания) осуществлялось до лечения, на 3-й, 7-й, 10-й и 14-й дни от начала применения препаратов (визиты 1, 2, 3, 4 при необходимости и 5 при необходимости).
У 7 детей с вторично-инфицированными дерматозами проведено культуральное бактериологическое исследование посевов с места инфицирования, по результатам которых S. pyogenes выявлен у 1 пациента, S. aureus – у 6 (у одного из них также выявлен Staphylococcus hominis).
Результаты
На фоне терапии у всех 7 пациентов ко 2-му визиту отмечено исчезновение гнойного отделяемого, в связи с чем не удалось провести оценку уменьшения микробной обсемененности места инфицирования по сравнению с исходным уровнем. Наличие отека тканей вокруг участка поражения на 1-м визите отсутствовало у 34 (97,14%) пациентов, на 2-м – у 35 (100%). Таким образом, ко 2-му визиту отек исчез полностью у всех пациентов. Гиперемия кожи вокруг раны отсутствовала у 23 (65,71%) пациентов на 1-м визите, на 2-м – у 30 (85,71%), на 3-м визите – у всех остальных. Таким образом, достижение первичной конечной точки (купирование раневой инфекции) при применении мази Левомеколь® у пациентов с вторично-инфицированными дерматозами было зарегистрировано ранее 14-го дня терапии.
По данным исследования, у всех пациентов к 7-му дню терапии отмечалась значительная положительная динамика кожного процесса в виде уменьшения площади высыпаний (рис. 15 А, Б): более чем на 90% по сравнению с исходным уровнем зарегистрировано у 11 пациентов на 2-м визите и у 14 на 3-м, что суммарно составило 25 (74%) пациентов. У пациентов с тяжелым рецидивирующим течением АтД в анамнезе сохранялась инфильтрация очагов, которая требовала последующего длительного использования топических ингибиторов кальциневрина.
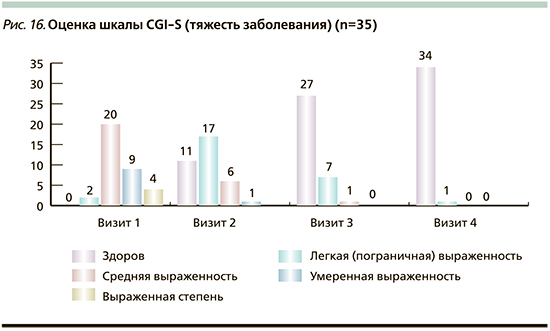
Для оценки эффективности и безопасности использования мази Левомеколь® при аллергодерматозах, осложненных вторичной инфекцией, использовалась шкала общего клинического впечатления CGI (Clinical Global Impression Scale), которая состоит из трех пунктов: тяжесть болезни (CGI-S); глобальное улучшение (CGI-I) и индекс эффективности (CGI-E) [33]. По данным статистического анализа шкалы CGI, у всех пациентов ко 2-му или 3-му визиту достигается положительная динамика кожного процесса в виде «Заметно улучшилось» или «Улучшилось очень заметно». При оценке индекса эффективности по шкале CGI-E выявляли степень терапевтического и побочных эффектов. Во всех случаях побочные эффекты отсутствовали. На 2-м визите эффект «Умеренный» отмечен у 8 (23%) пациентов, «Значимый» – у 27 (77%). На 3-м визите у 22 пациентов выявлен «Значимый» эффект, у одного – «Умеренный» от примененного лечения. При оценке индекса тяжести заболевания CGI-S состояние «Здоров» ко 2-му визиту достигнуто у 11 пациентов, к 3-му визиту – еще у 15 и к 4-му – еще у 1 пациента, что суммарно составило 27 (77%) из 35 пациентов (рис. 16). У остальных 8 (23%) пациентов осталась «легкая пограничная выраженность» (у 7 на 3-м визите и у 1 – на 4-м).
Для оценки интенсивности боли использовалась визуально-аналоговая шкала (ВАШ), где 0 – «отсутствие боли», а 10 – «сильнейшая боль, какую можно только представить» [34]. По результатам статистического анализа, уменьшение интенсивности боли в области места инфицирования (раны) по ВАШ на 50% от исходного уровня зарегистрировано у 32 (91%) пациентов: у 27 – ко 2-му, у 5 – к 3-му визиту. Уменьшение интенсивности боли на 2 балла и более от исходного уровня по шкале ВАШ зарегистрировано у 26 (74%) пациентов: у 21 – ко 2-му, у 5 – к 3-му визиту.
Таким образом, исследуемый препарат Левомеколь® продемонстрировал практически 100%-ную эффективность ко 2–3-му визитам по всем изученным критериям эффективности, а также абсолютную безопасность и хорошую переносимость пациентами.
Заключение
Известно, что при аллергодерматозах контаминирующие поражение микроорганизмы не только вызывают вторичную инфекцию, но и патогенетически поддерживают основной патологический процесс. Соответственно, предпочтение в лечении аллергодерматозов, осложненных вторичной инфекцией, отдается комбинации наружного антибактериального средства и топического ГКС. В рамках дизайна протокола исследования исследуемый препарат Левомеколь® продемонстрировал выраженное противовоспалительное действие, высокую эффективность в купировании раневой инфекции, высокий профиль безопасность и хорошую переносимость пациентами. К преимуществам сочетанного применения мази Левомеколь® и топического ГКС относят возможность селективного подбора «молекулы» ГКС (по силе, наличию/отсутствию галогенов, кратности нанесения), возможность регулирования «приоритетов»: антибиотик или ГКС, наличие метилурацила в мази Левомеколь® способствует усилению регенерации при трещинах и экскориациях, а также широкий антимикробный спектр действия хлорамфеникола. Мазь Левомеколь® широко известна пациентам и врачам, ее можно найти во многих домашних аптечках, а ее низкая стоимость составляет экономическую выгоду для практического здравоохранения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Статья подготовлена при поддержке АО Нижфарм (группа компаний Stada).



