Введение
Стремительный рост распространенности аллергических заболеваний (АЗ) и реакций на различные факторы внешней и внутренней среды; раннее начало многих АЗ, развитие которых в большинстве случаев приходится на первый год жизни ребенка, делает эту проблему одной из актуальнейших в XXI в. АЗ может существовать всю жизнь: от периода младенчества до взрослого состояния, нередко нарушая качество жизни пациента и влияя на его физическую, психологическую и повседневную активность [1].
АЗ характеризуются клиническим многообразием с вовлечением в патологический процесс многих органов и систем, выступающих как «органы-мишени» с точки зрения развития в них аллергического воспаления (см. рисунок). С возрастом происходит эволюция АЗ, т.н. аллергический марш, последовательная смена одного «органа-мишени» на другой: от кожи до верхних или нижних дыхательных путей.
Успехи, достигнутые в понимании патогенеза АЗ, позволили создать новый класс препаратов, воздействующих на аллергическое воспаление и, соответственно, клинические проявления болезни. Это лекарственные средства, воздействующие на один из ключевых медиаторов аллергического воспаления гистамин, с действием которого связано появление отека, гиперемии, зуда, спазма гладких мышц, усиление проницаемости сосудов и гиперсекреция слизи. Они получили название антигистаминных препаратов (АГП), или Н1-антагонистов. Их действие связано с блокадой Н1-гистаминовых рецепторов на клетках разных тканей. АГП широко используются в лечении таких заболеваний, как атопический дерматит (АД), аллергический ринит/конъюнктивит, крапивница, ангионевротический отек, АЗ желудочно-кишечного тракта, острые аллергические реакции. Обсуждается вопрос об их использовании в аллерген-специфической иммунотерапии детьми с бронхиальной астмой, ассоциированной с аллергическим ринитом, острой респираторной вирусной инфекцией.
На сегодняшний день зарегистрировано более 100 АГП, которые, имея структурную схожесть с гистамином, конкурентно блокируют Н1-гистаминовые рецепторы и нивелируют эффекты медиатора на клетки-мишени.

Согласно современной классификации, АГП делятся на препараты I (старого) и II (нового) поколений. К препаратам I поколения относятся хлоропирамин, клемастин, дифенгидрамин, диметиндена малеат, мебгидролин и др. К числу АГП II поколения относят лоратадин, цетиризин, эбастин, фексофенадин, дезлоратадин, левоцетиризин, механизмы действия и эффекты которых представлены в табл. 1.
За последние годы на больных различными АЗ активно изучается эффективность и безопасность АГП II поколения цетиризина, к преимуществам которого относится не только избирательная блокада Н1-гистаминовых рецепторов, но и угнетение выделения медиаторов поздней фазы аллергической реакции, способствующих миграции эозинофилов, нейтрофилов и базофилов в ответ на введение аллергена, снижение экспрессии молекул адгезии, подавление действия других медиаторов и индукторов секреции гистамина [2–5]. Цетиризин не обладает холиноблокирующим действием и практически не оказывает седативного эффекта. Препарат отличается благоприятным профилем безопасности для детей, доказанным результатами длительных двойных слепых рандомизированных исследований. При его продолжительном приеме (более 18 месяцев) не было отмечено изменений физиологических функций, в т.ч. ЭКГ, лабораторных показателей, психического состояния [12–14]. Цетиризин не менее чем на 70 % всасывается из желудочно-кишечного тракта, причем прием пищи не оказывает влияния на его абсорбцию. Максимальная концентрация в сыворотке крови достигается через час после приема, а терапевтический эффект сохраняется не менее 24 часов. Стабильный уровень в плазме крови достигается через 3-е суток после начала приема. Известно, что при систематическом применении концентрации цетиризина в коже и сыворотке крови становятся эквивалентными [6]. При длительном (более 110 недель) приеме толерантность к препарату не наблюдается. В связи с высокой эффективностью и безопасностью цетиризин разрешен к применению в педиатрической практике.

В нашей стране цетиризин зарегистрирован под 10 торговыми наименованиями, среди которых оригинальным является Зиртек, а остальные – препараты-генерики. Эффективность и безопасность цитеризина для детей изучена достаточно полно, этому вопросу были посвящены многочисленные отечественные и зарубежные исследования [7–14]. Однако известно, что генерики, несмотря на большую доступность и, как правило, меньшую стоимость, реже назначаются практическими врачами в связи с недостаточной уверенностью в терапевтическом эффекте этих средств, обусловленной малым числом исследований, подтверждающих их терапевтическую эквивалентность оригинальному препарату.
В связи с этим целью настоящего исследования было изучение эффективности и переносимости АГП цетиризина детьми с АД.
Материал и методы
Цетиризин был включен в терапию 27 детей (10 мальчиков, 17 девочек) в возрасте 2–9 лет, страдающих АД легкого и среднетяжелого течения с длительностью заболевания 3–5 лет. Дети находились на лечении, а затем под диспансерным наблюдением. У 12 детей АД сочетался с бронхиальной астмой легкого течения (3 пациента), аллергическим ринитом (5 пациентов), бронхиальной астмой и аллергическим ринитом (4 пациента). На момент включения больных в исследование сопутствующая аллергическая патология находилась в стадии клинической ремиссии и дети не получали никаких лекарственных средств.
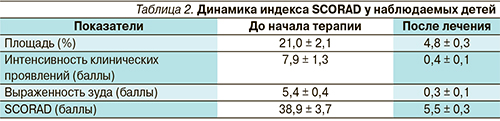
Всем больным было проведено углубленное клиническое и аллергологическое обследование, включившее исследование биохимических показателей, ЭКГ, определение уровня общего IgE в сыворотке крови, постановку кожных скарификационных проб или определение аллергенспецифических IgE-антител в сыворотке крови. Оценка выраженности симптомов АД проведена с использованием шкалы SCORAD до начала терапии и на 15-й день лечения, а далее по потребности, но не реже 1 раза в 10 дней. Общая продолжительность наблюдения составила от 2 до 4 месяцев.
При обследовании у большинства больных была выявлена поливалентная сенсибилизация. У детей в возрасте до 4 лет преобладала повышенная чувствительность к пищевым аллергенам, старше 4 лет – к пыльцевым и/или бытовым аллергенам. Давность обострения АД у наблюдаемых детей составила 4–9 дней, индекс SCORAD на момент осмотра достиг 38,9 ± 3,7 балла, что свидетельствовало об обострении средней степени тяжести.
С учетом тяжести обострения и поливалентного характера сенсибилизации всем пациентам были назначены цетиризин (по 2,5 мг 2 раза в сутки детям в возрасте 2–6 лет и по 10 мг 1 раз в день детям старше 6 лет) на 60–120 дней, а также топический глюкокортикостероид (ГКС; мометазона фуроат) в формах, соответствующих характеру и локализации очагов кожного воспаления. Помимо этого всем родителям пациентов были даны рекомендации по соблюдению гипоаллергенного окружения с устранением по возможности контакта с причиннозначимыми аллергенами, элиминационной диеты, а также по применению средств для ухода за кожей.
Результаты и обсуждение
Анализ клинических симптомов на фоне проводимого лечения (табл. 2), показал, что уже на 3-и сутки состояние детей значительно улучшилось, снизилась интенсивность зуда, улучшился сон. Достоверное сокращение площади поражения (на 30–40 %), уменьшение выраженности объективных и субъективных симптомов более чем в 2 раза было отмечено к 5-му дню терапии (р < 0,05), это позволило 9 детям младшего возраста со значительным улучшением состояния прекратить применение мометазона фуроата. На 7-е сутки обострение было купировано у 11 (40,7 %) больных, а у остальных была отмечена значительная положительная динамика, заключавшаяся в существенном сокращении площади поражения, ликвидации кожного зуда, что дало возможность исключить из терапии мометазона фуроат для всех пациентов.
Таким образом, максимальная длительность применения наружной ГКС-терапии составила 7 дней, и у 11 больных контроль над минимальными симптомами заболевания осуществлялся только посредством приема цетиризин. На 10-е сутки лечения ремиссия АД была достигнута 23 детьми, к концу 2-й недели обострение было купировано у всех пациентов. Последующее наблюдение за детьми в течение 2–4 месяцев показало, что 21 (77,8 %) больной достиг длительной ремиссии АД, а у 6 пациентов отмечено по одному эпизоду легкого обострения. Среди детей с сочетанием кожной и респираторной атопии в период наблюдения обострений аллергического ринита и бронхиальной астмы зарегистрировано не было. Это может свидетельствовать о контроле над аллергическим воспалением, однако для получения достоверных данных необходимо более длительное наблюдение за этими пациентами.
При длительном приеме цетиризин ни у одного ребенка не было отмечено нарушений функции сердечно-сосудистой системы, что было подтверждено результатами ЭКГ. Побочных реакций, значимых изменений биохимических показателей, характеризующих состояние почек и печени, зарегистрировано не было. Дополнительно к оценке динамики симптомов АД было изучено влияние терапии на качество жизни семьи и сотрудничество с врачом. Быстрое уменьшение кожного зуда, улучшение ночного сна больных, получавших терапию цетиризином и мометазона фуроатом, привело к улучшению их самочувствия и работоспособности, увеличило продолжительность сна родителей, снизило их обеспокоенность болезнью ребенка и как следствие – улучшило качество жизни. Одним из положительных моментов, отмеченных родителями, стала быстрая отмена ГКС мометазона фуроата с возможностью продолжительной монотерапии цетиризином для «закрепления» терапевтического эффекта, а также с целью профилактики обострения АД.
Таким образом, активная тактика ведения детей с обострением АД с ранним назначением короткого курса топического ГКС (мометазона фуроата) и неседативного АГП цетиризина не только позволяет быстро купировать симптомы заболевания, снизить нагрузку ГКС, но и обеспечивает длительную ремиссию кожного атопического процесса. Полученные результаты свидетельствуют о возможности достижения контроля над аллергическим воспалением. Высокая эффективность, безопасность и хороший профилактический эффект позволяют рекомендовать цетиризин в качестве базисной и противорецидивной терапии АД.


