Введение
С ростом старения населения средний возраст начала заболевания пациентов с острым коронарным синдромом (ОКС) в последние десятилетия стабильно растет [1]. Национальные и международные рекомендации по ведению пожилых людей не отличаются от таковых для более молодых пациентов [2–4].
Однако, поскольку пожилые люди недостаточно представлены в клинических испытаниях, а тактика их ведения основана на ограниченных данных, полученных в результате posthoc-анализов основных исследований и нерандомизированных ретроспективных реестров, по-прежнему имеется мало данных о том, получают ли они пользу от используемых методов лечения, включая фармакологические и инвазивные [5].
Обеспечение подхода, основанного на руководящих принципах, само по себе способствует полифармации. Влияние же физиологии старения на человека и значимость измененного метаболизма лекарственных средств (ЛС) трудно быстро оценить в условиях неотложной ситуации, такой как ОКС. Следует отметить, что наблюдательных исследований для анализа реальной тактики ведения инфаркта миокарда (ИМ) у пациентов старческого возраста в России проведено не так много [6]. Однако в большинстве таких исследований изучался непосредственный прогноз острого ИМ, а эффективность применяемого лечения оценивалась главным образом в ближайшие сроки постинфарктного периода [7, 8]. Отдельно для пациентов старших возрастных групп исходы и клиническое течение ишемической болезни сердца в более отдаленном постинфарктном периоде (6 месяцев и более) все еще недостаточно изучены, а имеющиеся литературные данные противоречивы [9, 10]. Комплекс этих аспектов стал основанием проведения настоящего исследования.
Цель исследования: изучить лекарственную терапию пациентов старческого возраста и долгожителей, перенесших ИМ, в рамках наблюдательного исследования.
Методы
Дизайн исследования: ретроспективно-проспективное наблюдательное исследование. Длительность наблюдения за пациентами – 12 месяцев. Вся информация о пациенте вносилась в ее электронную индивидуальную регистрационную форму.
В исследование были включены 92 пациента, перенесших ИМ, в возрасте от 75 до 93 лет (средний возраст – 81,6±4,2 года).
Критерии включения: возраст пациента от 75 лет, наличие документированного диагноза ИМ (на основании критериев Четвертого универсального определения ИМ Европейского общества кардиологов, 2018) [11], информированное согласие на участие в исследовании. Критерии исключения: несогласие участвовать в исследовании.
Первичная конечная точка: смерть в период пребывания больного в стационаре через 3 месяца и через 1 год. Вторичные конечные точки: госпитализация, клинически значимое кровотечение, инсульт, ОКС, декомпенсация хронической сердечной недостаточности (ХСН) в течение 3 месяцев и 1 года, доля пациентов, продолживших прием статинов, антиагрегантов и других групп ЛС через 3 и 12 месяцев.
Математическая обработка результатов исследования выполнена с использованием пакетов прикладных программ Statistica 10 (StatSoft Inc). Для проверки статистических гипотез о виде распределения были применены тесты
Колмогорова–Смирнова и Шапиро– Уилка. Описание количественных параметров при нормальном распределении проводилось с помощью подсчета средних величин и стандартного отклонения (M±σ), при распределении, отличном от нормального, – медианы и межквартального размаха. Для сравнения качественных параметров использовался критерий χ2 с поправкой на непрерывность Йейтса (при необходимости) или двусторонний точный тест Фишера. Для сравнения двух групп различия считали достоверными при уровне значимости p<0,05.
Результаты
В табл. 1 представлены основные клинико-демографические характеристики пациентов, выявленные ретроспективно после поступления в стационар по поводу ИМ.
Как следует из табл. 1, 97,8% пациентов страдали артериальной гипертонией, 40,2% уже перенесли в прошлом ИМ, у 60,9% имелись клинические симптомы ХСН. Хотя информация о наличии факторов риска в этом исследовании ограниченна (особенно в отношении наличия гиперхолестеринемии), т.к. собиралась ретроспективно на основании анализа историй болезни, она, тем не менее, свидетельствует, что 37,0% пациентов имеют указание на наличие хронической болезни почек (ХБП) в анамнезе, гиперхолестеринемия – 41,3%, ожирение (33,7%) и сахарный диабет (СД) 2 типа – 30,4%.
Частота назначений кардиологических ЛС, принимаемых пациентами до настоящего ИМ, не соответствовала имевшимся у больных сопутствовавшим сердечно-сосудистым заболеваниям (рис. 1).

Только 43,5% пациентов принимали ингибиторы ренин-ангиотензиновой системы (иРААС), бета-адреноблокаторы (ББ) – 33,7%, диуретики – 21,7%, антагонисты минералокортикоидных рецепторов (АМКР) – 10,9%, статины – 30,4%, антиагреганты – 46,7%, оральныеантикоагулянты(ОАК)–всего 5,4% человек. Среди иАПФ наиболее часто назначаемый препарат – периндоприл (принимали 19,6% пациентов), среди блокаторов рецепторов к ангиотензину 2 (БРА) – валсартан (7,6%), бетаАБ – метопролол (75,0%), среди блокаторов кальциевых каналов (БКК) – амлодипин (63,0%), среди диуретиков – торасемид (38,0%), среди статинов – аторвастатин (100%).
Каждый день принимали ЛС только 53 (57,6%) пациента, 19 (20,7%) не принимали никаких ЛС, пропускали прием 1 раз в неделю 11 (12,0%), 2 раза и более – 9 (9,8%). Снижение приверженности лечению у 13 (14,1%) пациентов связано с забывчивостью, 2 (2,2%) не хотели принимать лекарства, для 2 (2,2%) человек прием ЛС зависит от получения в рамках льготного обеспечения.
Характеристика ИМ у пациентов страрческого возраста представлена в табл. 2. У 43 (46,7%) пациентов при поступлении в стационар диагностирован ИМпST, у 49 (53,3%) – ИМбпST. Тромболизис выполнен 10 (10,9%) пациентам с ИМпST. Коронароангиография (КАГ) проведена 57 (62,0%) пациентам. Причиной невыполнения КАГ стали отказ самих пациентов в 12,3% случаев и невозможность ее проведения по причине выраженного снижения скорости клубочковой фильтрации (СКФ) у 8,8% человек. Чрескожное коронарное вмешательство (ЧКВ) осуществлено 28 (30,4%) с использованием 1 или 2 стентов без лекарственного покрытия. ЧКВ не было проведено чаще всего из-за многососудистого поражения коронарного русла и высокого пери-операционного риска.
При анализе лекарственной терапии в стационаре выявлено, что лишь 76% пациентов назначены иРААС, причем у 2 пациентов причиной послужила почечная недостаточность (острое повреждение почек и хроническая болезнь почек, 5-й стадия) и у 3 человек – гипотония; абсолютных противопоказаний к назначению ЛС данных групп среди других пациентов не установлено. В структуре назначений широко представлены статины – 100%, ББ – 88,0%, БКК – 66,3%, петлевые диуретики – 44,6%. Большинству (96,7%) больных назначены парентеральные антикоагулянты, внутривенную терапию нитратами получали 29,3% больных и 23,9% перорально, морфин в качестве обезболивания использовали в 19,6% случаев.
Двойную антиромбоцитарную терапию (ДАТТ; ацетилсалициловую кислоту+ антагонист P2Y12-рецепторов) получили 57 (62,0%) человек и 1 (1,1%) – комбинацию клопидогрела и ОАК, тройную (ДАТТ+ОАК) – 29 (31,5%), монотерапию антиагрегантом – 4 (4,3%). Большинство (83 [90,2%]) пациентов имели высокий риск кровотечения, средний балл по шкале HAS-BLED составил 3,5±0,6, по шкале PREСISE-DAPT – 30,2±8,1, по шкале CRUSADE – 42,0±12,9. Однако указания на риск кровотечения мы нашли лишь в 38% выписных эпикризов, что затрудняет определение длительности комбинированной антиагрегантной терапии в дальнейшем.
В гериатрической практике одним из наиболее часто используемых инструментов для оптимизации фармакотерапии и сокращения риска нежелательных побочных реакций являются STOPP/START-критерии для предотвращения потенциально некорректного назначения ЛС пациентам пожилого и старческого возраста [12]. Количество назначений потенциально нерекомендованных ЛС составило 35 у 29 (31,5%) человек. Количество лекарственных препаратов, которые необходимо было назначить, – 44 у 37 (40,2%) пациентов. Наиболее частые выявленные STOPP-критерии: 1) петлевые диуретики в отсутствие клинических признаков сердечной недостаточности при сопутствующем недержании мочи могут усилить недержание (31,4% от всех обнаруженных критериев STOPP); 2) вазодилататоры при гипотензии повышают риск синкопе и падений (45,7%); 3) нестероидные противовоспалительные препараты с антагонистом витамина К, прямым ингибитором тромбина, ингибитором фактора Ха или антиагрегантами без профилактики ингибитором протонной помпы (увеличение риска желудочно-кишечного кровотечения) – 22,9%. Наиболее часто выявленные START-критерии: 1) иАПФ после острого ИМ (50,0% всех обнаруженных критериев START); 2) варфарин при фибрилляции предсердий (31,8%). Нами анализировалась лекарственная терапия, которую пациенты получали в течение исследуемого периода.
На рис. 2 представлены данные о доле пациентов, принимавших основные группы ЛС, влияющих на сердечнососудистую систему.
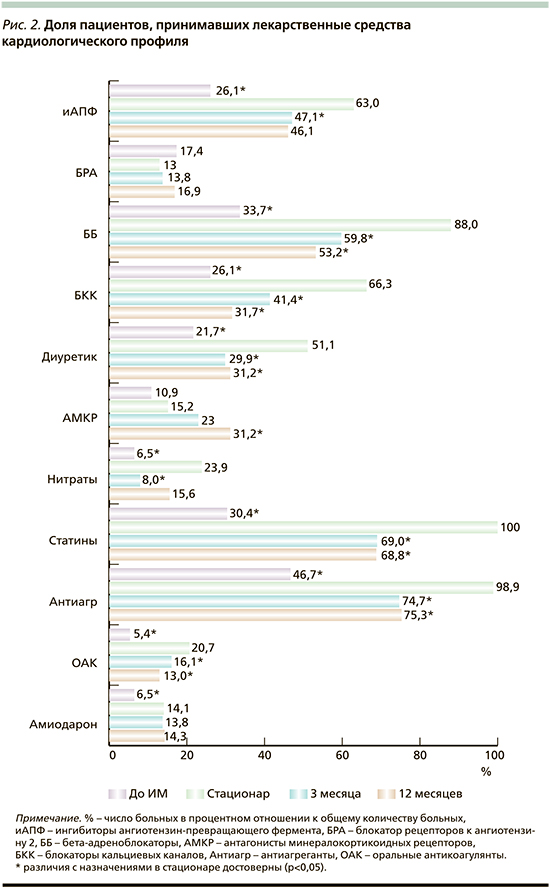
Как уже говорилось, до момента включения в исследование всего 26,1% принимали иАПФ, 17,4% – БРА, 33,7% – ББ, 30,4% – статины и антиагреганты – 46,7% пациентов. Во время стационарного лечения доля больных, получавших жизненно необходимые ЛС, увеличилась, достигнув для статинов 100%-ного назначения (р=0,000). Однако после выписки уже через 3 месяца на треть уменьшилось число пациентов, принимавших препараты, улучшающие прогноз жизни (р=0,000). Подобная тенденция (резкое сокращение приема) касается и антиангинальных средств. Так, если до госпитализации 26,1% пациентов принимали БКК, в стационаре – 64,1%, через 3 месяца – 41,4% и 37,7% через 12 месяцев (p<0,003, по сравнению со стационарным назначением). Нитраты соответственно: 6,5% – 23,9% – 8,0% – 15,6% (p<0,002).
Если оценивать полноту использования ЛС для лечения ХСН, как уже показано, 43,5% принимали иАПФ или БРА до ИМ, 33,7% – ББ, диуретики – 21,7% и 10,9% – АМКР. То есть большинство пациентов с клиническими симптомами ХСН (60,9%, согласно амбулаторным картам) не получали адекватной терапии. В момент госпитализации доля пациентов, получавших иРААС, увеличивается до 76% (p=0,000), ББ –до 88% (p=0,000), диуретики – до 51,1% (p=0,000), АМКР – до 15,2%. Через 3 месяца после ИМ наблюдается сокращение доли пациентов, которые принимают диуретики до 29,9% (p=0,003), и такая тенденция сохраняется до конца года – 31,2% (p=0,006). Наряду с этим доля пациентов, которые принимают АМКР, через 3 месяца увеличилась до 23,0%, к концу года – до 31,2% (p=0,013).
За время наблюдения доля пациентов, принимавших антиагрегантную терапию, согласно рекомендациям, в целом достоверно снизилась (p=0,000) также уже к 3-му месяцу после ИМ и составила 50,6%, а к концу 12 месяцев – 42,9% (рис. 3).
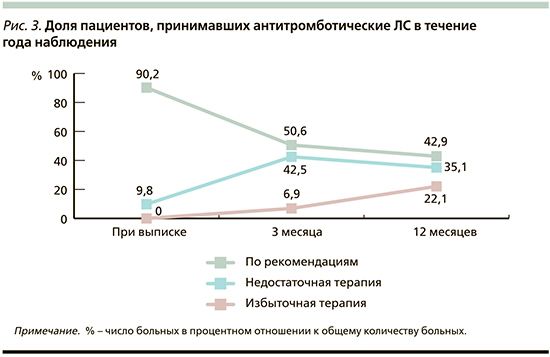
Несоблюдение рекомендаций по антитромботической терапии связано, с одной стороны, с недостаточным использованием ОАК как в составе комбинированной терапии с антиагрегантом через 3 месяца после ИМ, так и в монотерапии через 12 месяцев. С другой стороны, мы наблюдали в ряде случаев пролонгацию ДАТТ до года после ОКС, хотя, согласно рекомендациям, длительность ее у большинства пациентов не должна была превышать 6 месяцев [13]. Приверженность терапии за год значимо не изменилась. Каждый день принимали ЛС 70,1%, не принимали никаких ЛС 16,9%, 9,1% пациентов пропускали прием 1 раз в неделю, 2 раза и более – 3,9%.
Через 3 месяца со всеми пациентами, выписанными из стационара, предпринята попытка установления телефонного контакта. Всего к тому моменту умерли 5 (5,4%) пациентов, произошло 9 госпитализаций. Через 12 месяцев после включения в исследование умерли всего 15 (16,3%) человек.
Основные осложнения, в том числе фатальные, были связаны с повторными ишемическими событиями (в 29,3% случаев) или кровотечениями (4,3%). Все пациенты, имевшие геморрагические осложнения (желудочно-кишечное кровотечение, кровохарканье), на момент госпитализации с ИМ уже имели высокий риск кровотечения. В качестве рекомендованной антиагрегантной терапии они в половине случаев принимали необоснованную тройную антиагрегантную терапию, другим – своевременно не был отменен второй антиагрегант; никто не получал ингибитор протонной помпы (не был назначен). С другой стороны, риск ишемических осложнений (ОКС, в т.ч. повторного ИМ или инсульта) был связан с антиагрегантной терапией низкой интенсивности – 8 (29,6%) принимали монотерапию антиагрегантом, 5 (18,5%) не принимали никаких антиагрегантов, 12 (44,4%) больных перестали принимать статины.
Обсуждение
Проведенный анализ ведения ИМ у пациентов старческого возраста и долгожителей выявил невысокую частоту коронарной реваскуляризации, что согласуется с результатами ранее проведенных исследований. В регистре CRUSADE коронарная реваскуляризация была выполнена 40,1% пациентов 75–89 лет и 12,6% в возрасте 90 лет и старше [14]. Вместе с тем имеются данные, согласно которым инвазивная стратегия для пациентов 80–90 лет превосходит консервативное лечение по влиянию на первичную комбинированную конечную точку (ИМ, срочная реваскуляризация, инсульт и смерть) [15].
Сложности оказания помощи пациентам с ИМ связаны не только с ограниченными возможностями использования ЧКВ, но и с назначением лекарственной терапии. Использование STOPP/START-критерией для оценки адекватности назначения ЛС выявило, что 31,5% пациентов назначались потенциально нерекомендованные ЛС, а у 40,2% выявлено потенциальное упущение при назначении ЛС. Напротив, в многоцентровом проспективном когортном исследовании, включившем пожилых пациентов с обострением хронических заболеваний, у 81,5% зарегистрировано по крайней мере одно потенциально ненадлежащее назначение, а процент пациентов, которым не были назначены рекомендованные ЛС, составил 35,5 [16].
Явным недостатком реальной практики ведения пациентов старческого возраста является резкое снижение потребления жизненно необходимых ЛС после выписки из стационара после ИМ, а также несвоевременная отмена комбинированной антиагрегантной терапии, что закономерно приводит к осложнениям, в т.ч. фатальным. Напротив, анализ структуры назначаемых лекарственных препаратов больным, перенесшим ИМ, на различных этапах лечения в рамках регистра ЛИС не показал значимого изменения в терапии после госпитализации [17]. В другом исследовании высокая частота приема ЛС для вторичной профилактики у пациентов старше 60 лет также сохранялась через 1 год наблюдения и даже через 5 лет (иАПФ – 68,5 и 58,0%, ББ – 84,3 и 75,9%, антиагреганты – 95,8 и 92,7%, статины – 65,7 и 68,2%) [10].
Заключение
Полученные результаты свидетельствуют о недостаточном использовании кардиологических ЛС пациентами старческого возраста для профилактики осложнений имеющихся сердечнососудистых заболеваний.
Недостаточное использование современных методов реваскуляризации вследствие мультисосудистого поражения коронарного русла или высокого периоперационного риска делают консервативную терапию в этом возрасте еще более значимой. Вместе с тем выявленное частое назначение потенциально нерекомендуемых ЛС может быть причиной нежелательных реакций, а недостаточное применение жизненно необходимых ЛС, что особенно ощутимо в постинфарктном периоде, повышает риск неблагоприятных клинических исходов для этой категории пациентов.
Рациональный выбор препаратов, мониторирование нежелательных явлений на стационарном и амбулаторном этапах ведения, регулярный пересмотр лекарственной терапии могут способствовать длительному применению названных препаратов, оправданному с точки зрения улучшения долгосрочного прогноза.


