Введение
Хронический гастрит (ХГ) – хроническое рецидивирующее заболевание желудка, в основе которого лежит формирование диффузных или очаговых воспалительно-дистрофических изменений слизистой оболочки желудка, сопровождающееся нарушением регенерации эпителия этих отделов пищеварительного тракта, склонностью к прогрессированию, развитию атрофии, расстройствам секреторной и моторной функции [1].
Эпидемиология
Частота встречаемости ХГ в детской популяции остается неизменно высокой. В развивающихся странах выявление ХГ у детей, по разным источникам. составляет от 4 до 20%, по некоторым данным – более 50%. При этом ХГ часто сочетается с дуоденитом, в изолированном виде встречается лишь у 10–15% детей. Доля ХГ среди детей младшего школьного возраста составляет 45%, среди детей среднего школьного возраста – 73% и 65% среди старших школьников [2].
Патогенез
На сегодняшний день найдено мало данных о естественном развитии гастрита в детском возрасте. Наибольшее значение для врачей представляет атрофический ХГ, т.к. именно он дает запуск «каскаду Correa»: нормальная слизистая оболочка–поверхностный гастрит–хронический атрофический гастрит–метаплазия тонкокишечного типа–метаплазия толстокишечного типа–дисплазия–аденокарцинома. Бесспорным этиологическим фактором ХГ помимо инфекции Нelicobacter pylori (НР) служит аутоиммунное поражение. Рассматривается также роль генетических факторов, особенностей питания, образа жизни. По данным Минздрава РФ, рак желудка занимает вторую позицию в структуре смертности у мужчин и женщин, а бактериальная желудочная неоплазия является пока первой и единственной онкопатологией, ассоциированной с бактериями [1, 3, 4].
Классификация
В 1984 г. А.В. Мазурин и соавт. разработали классификацию ХГ, которая принята за основу и используется в отечественной педиатрической практике по настоящее время. Постоянно обновляющиеся данные в связи с многочисленными исследованиями, выполненными с момента открытия НР в 1983 г., требуют обновления рекомендаций для практической работы врачей-терапевтов, гастроэнтерологов, педиатров, врачей общей практики. Как российские, так и международные классификации претерпевают изменения в соответствии с полученными результатами. Классификация А.В. Мазурина пересмотрена и дополнена Союзом педиатров РФ в 2002 г. (табл. 1).
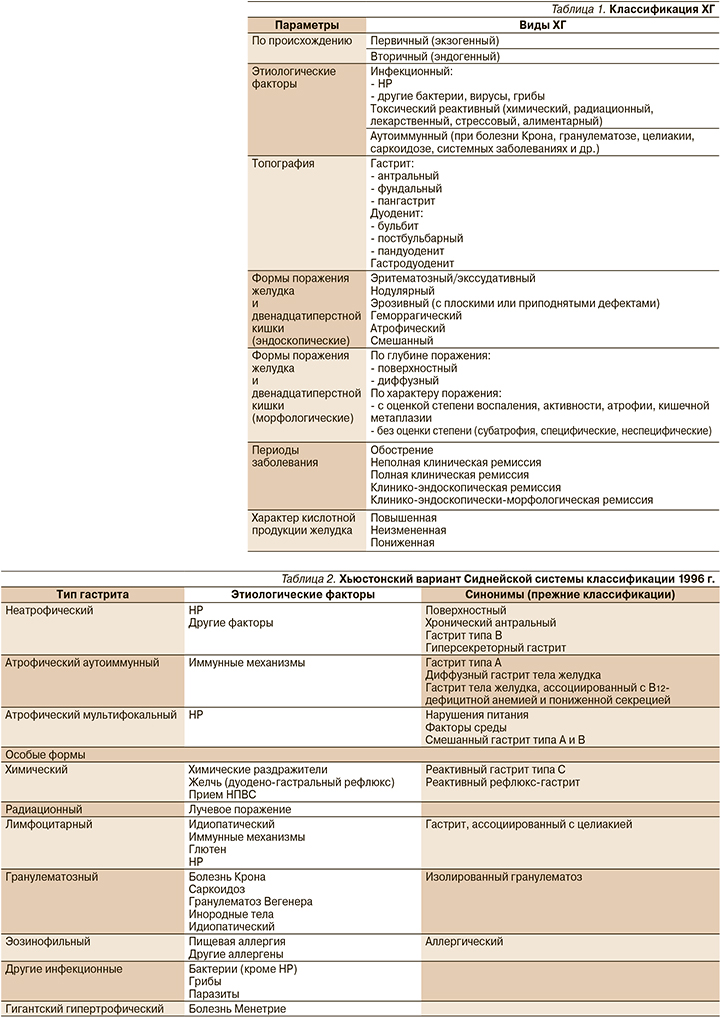
В зарубежной практике с 1990 г. пользовались Сиднейской системой классификации, модифицированной в 1996 г. (табл. 2). Диагноз ХГ формировался на основании оценки четырех признаков: этиологических факторов, локализации патологического процесса, гистологических и макроскопических изменений слизистой оболочки желудка, выявляемых при эндоскопии. Морфологические изменения описывались по визуально-аналоговой шкале с оценкой воспаления, активности процесса, атрофии, метаплазии и степени обсемененности НР. Но в данной классификации не отражались стадийность заболевания (обострение, ремиссия) и секреторная функция желудка (состояние кислотности) [3, 5].
С 2006 г. диагноз ХГ принято считать исключительно морфологическим. В связи с этим в 2008 г. взамен Сиднейской классификации разработана новая под названием OLGA (Орегаtive Link for Gastritis Assessment) с определением степеней (выраженность воспалительной инфильтрации) и стадий (выраженность атрофии) ХГ, которую используют в отношении взрослых в настоящее время. Принятой гистологической классификации ХГ в международной педиатрической практике нет [6, 7].
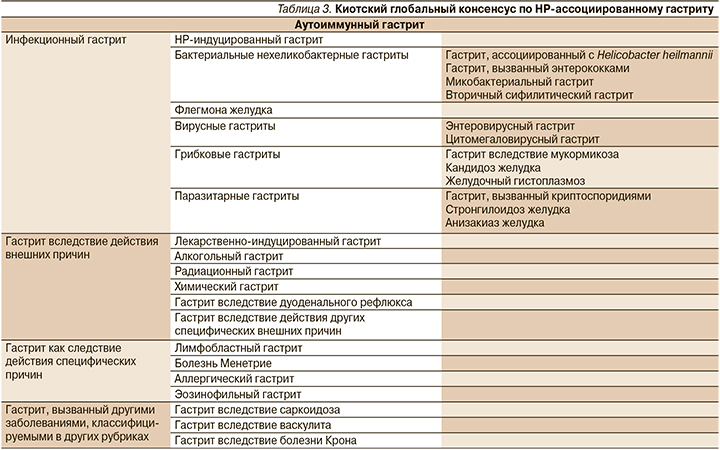
В 2015 г. принят Киотский глобальный консенсус по ведению НР – ассоциированного гастрита, который актуализировал имеющуюся информацию и обновил ее через призму рисков развития рака желудка (табл. 3). При этом авторы указывают, что это дополнение к классификациям, которое найдет отражение в Международной классификации болезней (МКБ) 11-го пересмотра. Консенсус рассматривает четыре главных вопроса: классификация гастрита в связи с продолжающимся пересмотром МКБ, функциональная диспепсия и НР-инфекция, диагностика гастрита и его лечение [8].
Клинические проявления ХГ у детей
ХГ не имеет клинического эквивалента. У большинства детей симптомы отсутствуют. К клиническим проявлениям ХГ в настоящее время применяют термин «функциональная диспепсия» (ФД). ФД – это комплекс жалоб, включающий боли, чувство жжения и переполнения в подложечной области после еды, раннее насыщение, которые отмечаются в течение 3 последних месяцев (при общей продолжительности не менее 6 месяцев) и которые не могут быть объяснены органическими заболеваниями (язвенная болезнь, опухоли, и др.). Выделяют два варианта ФД: синдром боли в эпигастральной области (язвенноподобный вариант) и постпрандиальный дистресссиндром (дискинетический вариант). О первом говорят в тех случаях, когда по меньшей мере 1 раз в неделю отмечаются умеренные или выраженные боли или чувство жжения в эпигастральной области. При этом боли не носят постоянного характера, связаны с приемом пищи или возникают натощак, не локализуются в других отделах живота, не уменьшаются после дефекации и не сопровождаются признаками дисфункции желчного пузыря или сфинктера Одди. Синдром боли в эпигастральной области может сочетаться с постпрандиальным дистресс-синдромом. Наличие постпрандиального дистресс-синдрома предполагают, когда у больного несколько раз в неделю после еды, при приеме обычного объема пищи возникает чувство переполнения в эпигастральной области или раннее насыщение [9–12].
В Киотском консенсусе отмечено, что инфекция НР сама по себе может приводить к появлению симптоматики у части больных диспепсией. В связи с этим если у НР-инфицированного пациента с диспепсией в отсутствие морфологических изменений со стороны слизистой оболочки желудка (СОЖ) после эрадикационной терапии отмечается стойкое улучшение симптоматики (в течение 6–12 месяцев), то таких пациентов рассматривают как имеющих НР-ассоциированную диспепсию. В других случаях их рассматривают как пациентов с ФД, требующих другого лечения. При проведении сравнительного анализа детей с ХГ выделено три синдрома: болевой, диспепсический и синдром хронической неспецифической интоксикации. При аутоиммунном гастрите (АГ) абдоминальные боли встречаются реже, чем при неаутоиммунном. При этом характерны длительные боли, не имеющие четкой локализации. Для неаутоиммунного гастрита боли чаще встречаются в эпигастральной области и пилородуоденальной зоне. Там же локализуются болевые пальпаторные точки. Среди проявлений диспепсического характера для АГ более характерны изжога, чувство кислоты или горечи во рту, метеоризм. Достоверно чаще при АГ отмечались субфебрилитет, лимфаденопатия. В 94,8% случаев при проведении пальпации выявлялось увеличение печени и ее некоторое уплотнение, что подтверждалось результатами ультразвукового исследования (УЗИ) брюшной полости [11, 13].
Лабораторная и инструментальная диагностика
Диагностика и лечение ХГ в РФ регламентируются Приказом Минздрава России № 1598н «Об утверждении стандарта специализированной медицинской помощи детям при гастрите и дуодените» от 28.12.2012. Она включает сбор жалоб и анамнеза заболевания, физикальное обследование, а именно пальпацию, перкуссию, аускультацию. Патогномоничных лабораторных признаков при ХГ нет. Тем не менее обязательны забор крови для клинического анализа с подсчетом скорости оседания эритроцитов, кал на яйца гельминтов и цисты лямблий, соскоб на энтеробиоз, копрологическое исследование. Необязательно, но необходимо при определенных условиях определение в крови антител к париетальным клеткам желудка и фактору Касла. Инструментальное обследование включает основополагающую фиброгастродуоденоскопию (ФГДС) с биопсией и последующим морфологическим исследованием. Для повышения частоты выявления атрофии/метаплазии на этапе эндоскопической диагностики, для повышения возможностей прицельной биопсии рекомендуется использовать ФГДС с улучшением изображения: хромоэндоскопия, эндоскопия в высоком разрешении c увеличением, что во многих регионах недоступно [1, 14].
Так как диагноз ХГ – это понятие морфологическое, то гистологическому исследованию СОЖ по праву принадлежит решающее значение. Детям оценку степени изменений СОЖ проводят так же, как и взрослым, согласно визуально-аналоговой шкале по следующим показателям: обсемененность HР, активность воспаления, атрофия и кишечная метаплазия. Первичный диагноз устанавливается на основании эндоскопического исследования с обязательным забором биопсионного материала и последующим его морфологическим изучением, бактериологическим исследованием и, возможно, ПЦР (полимеразная цепная реакция)тестом с биоптатом для определения чувствительность к антибиотикам при необходимости эрадикационной терапии хеликобактериоза. Дополнительно можно выполнить УЗИ брюшной полости. Исследование для уточнения секреторной функции желудка (рН-метрию) проводят только по показаниям после назначения гастроэнтеролога (табл. 4).
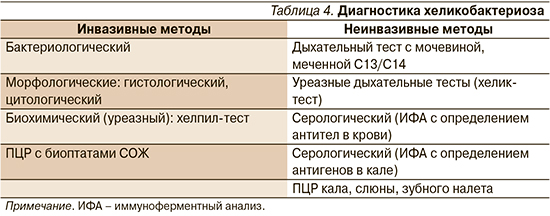
Диагностика НР-инфекции основана на использовании инвазивных и неинвазивных тестов. «Золотым» стандартом считается бактериологический метод, который позволяет не только идентифицировать микроб, но и определить его чувствительность к антибиотикам [15].
Эксперты ESPGHAN считают, что лечение детей не должно быть основано только на исследовании кала или результатов дыхательного теста, а должно быть основано на результатах гистологического подтверждения.
Медикаментозное лечение
Лечение ХГ проводится с учетом этиологического фактора, степени соответствия клинической картины результатам лабораторно-инструментального обследования. Для лечения диспепсического синдрома применяются антисекреторные препараты/ингибиторы Н+/К+-АТФазы, прокинетики (домперидон), цитопротекторы (препараты висмута), при наличии гипо/ахлоргидрии используют цитопротекторы (препараты висмута), полиферментные препараты, возможно использование заместительной терапии (пантаглюцид, натуральный желудочный сок).
Пациенту с АГ необходимо проведение эрадикационной терапии, что в 80% случаев позволяет затормозить прогрессирование атрофии [16].
Эрадикационная терапия НР при ХГ ведет к предотвращению прогрессирования процессов в СОЖ и направлена главным образом на регресс развития предраковых изменений.
Лечение НР проводится согласно рекомендациям ESPGHAN (2017) и «Маастрихту V» (Флоренция, 2015). В качестве первой линии используется тройная терапия с высокими дозами ингибиторов протонной помпы (ИПП), амоксициллином и кларитромицином в течение 14 дней. Необходимо учитывать резистентность микроба в регионе. В России отмечается высокая устойчивость НР к метронидазолу, поэтому данный препарат в тройной терапии первой линии не используется. Четырехкомпонентная терапия на основе висмута с использованием метронидазола/тетрациклина возможна в качестве терапии первой линии в странах, где лицензировано использование препаратов висмута у детей. Она используется при неэффективности тройной терапии, а также в случаях устойчивости штаммов НР к кларитромицину. В России прием препарата на основе висмута трикалия дицитрата возможен в отношении детей с 4 лет в дозе 8 мг/кг/сут. Суточную дозу разделяют на два приема. В этой схеме учитывается возраст ребенка для выбора антибиотика. Такие ИПП, как эзомепразол и рабепразол, предпочтительнее для пациентов с генотипом «быстрых» метаболизаторов, т.к. данные препараты минуют путь метаболизма через цитохром CYP2C19. Наличие активной инфекции, вызванной вирусом Эпштейна–Барр, служит противопоказанием к назначению амоксициллинов. В этом случае рекомендована замена пенициллинов на нифуратель, а также подключение к терапии противовирусных препаратов (ацикловир или валцикловир) детям старше 10 лет в дозе 500 мг 2 раза в сутки независимо от приема пищи в течение от 10 дней до трех недель. Добавление пробиотиков/ пребиотиков к схеме лечения пока не имеет сильных уровней доказательств. Для контроля проведенной терапии рекомендуют использовать уреазный дыхательный тест с мочевиной, меченной С13/С14, и моноклональный тест с определением антигенов НР в кале с интервалом после завершения терапии через 4 недели, не ранее [17].
Немедикаментозное лечение
Появление жалоб при ХГ связывают с социально-экономическими факторами (вредное производство, неполный состав семьи, неправильный режим питания), стрессами, с приемом лекарственных средств по поводу сопутствующих заболеваний. В связи с этим необходимо уменьшать воздействие неблагоприятных факторов, соблюдать режим питания 5–6 раз в день.
Рекомендуются соблюдение режима дня с обязательным дневным сном (у старших детей – дневным отдыхом), пребывание на свежем воздухе, ограничение времени просмотра телевизионных передач и занятий на компьютере.
Специальная строгая диета при ХГ не назначается. Рекомендовано щадящее воздействие на СОЖ и двенадцатиперстную кишку. Нежелательны крепкие мясные и рыбные бульоны, грибной отвар, пряности, острые блюда, маринованные и копченые продукты, раздражающие слизистую оболочку и способные повышать кислотообразование. При ХГ с повышенной секреторной функцией желудка показаны курсы дегазированных минеральных вод (боржоми, Смирновская, Славяновская, Арзни), фитотерапия (зверобой, девясил, алтей, пустырник, солодка), для купирования болевого синдрома проводится физиотерапия (индуктотермия, ЛУЧ-2 или теплолечение на эпигастральную область в отсутствие риска развития язвенной болезни). При пониженной секреторной функции желудка пьют минеральные воды: Ижевскую, Ессентуки-4 и -17, Минскую, из фитопрепаратов применяют подорожник, трилистник водяной, одуванчик, золототысячник, полынь, душицу. В качестве физиотерапии применяют тонизирующие хвойные ванны, электрофорез со спазмолитиком или ЛУЧ-2 на эпигастральную область, ультрафиолетовое облучение общее и зональное на эпигастральную зону, кислородные коктейли. Особое место в лечении детей с хроническим гастродуоденитом занимают специализированные продукты лечебного питания, поскольку современные технологии позволяют создавать специализированные пищевые продукты, обогащенные функциональными природными компонентами. Такие специализированные пищевые продукты, включенные в состав лечебно-профилактического питания, позволяют значительно расширять возможности гастроэнтерологической терапии.
Особенно широко в диетическом лечебном питании используют кисели на овсяной основе. К подобным продуктам относится пищевой продукт диетического лечебного и диетического профилактического питания для детей раннего возраста от 1 года Кисель желудочный ЛЕОВИТ. Кисель оказывает благоприятное влияние на функциональную активность различных систем организма, повышает его детоксикационные способности, благотворно воздействует на функции печени, почек, органов кроветворения. Преимуществом лечения продуктами природы является возможность длительного использования растений, продуктов животного происхождения и др. без существенных побочных эффектов, совместимость со многими лекарственными препаратами и между собой. Он рекомендован и взрослым, и детям, показал высокую эффективность [18].
Специализированный пищевой продукт диетического лечебного и диетического профилактического питания для детей раннего возраста от 1 года Кисель желудочный ЛЕОВИТ на овсяной основе содержит природные компоненты, эффективные при болезнях желудочно-кишечного тракта (ЖКТ): экстракты родиолы розовой, прополиса, зверобоя, мяты перечной, куркумы, яблоки, морковь, тыкву, овес, пищевые волокна (табл. 5).
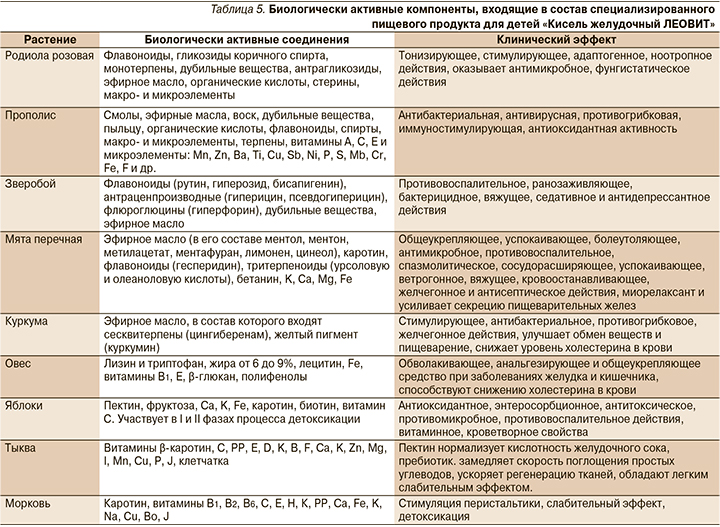
Так, например, прополис обладает мощным бактериостатическим действием и усиливает эрадикационную терапию HР [19, 20]. Противомикробным действием обладают также зверобой, мята, родиола розовая, куркума, яблоко, морковь, а дубильные вещества оказывают вяжущее действие благодаря наличию многочисленных фенольных группировок, необратимо связывающих белки в прочные соединения, с образованием на поверхности слизистой оболочки тонкой, но плотной пленки (альбуминатов), препятствующей действию раздражающих веществ на кишечник. Пленка предотвращает дальнейшее раздражение окончаний чувствительных нервов. Параллельно происходит рефлекторное сужение сосудов с понижением их проницаемости, уменьшением экссудации и ингибирования ферментов. Так происходит торможение развития воспалительного процесса. Вяжущие средства относятся к противовоспалительным (антифлогистическим) препаратам местного действия, которые понижают чувствительность окончаний афферентных нервов и препятствуют их возбуждению.
Слизистые вещества овса и гуаровой камеди также снижают чувствительность окончаний афферентных нервов, обладают противовоспалительными свойствами. Каротиноиды моркови, тыквы, а также куркума и прополис способствуют регенерации, активному ранозаживлению и эпителизации СОЖ и слизистой оболочки кишечника, прополис и мята устраняют симптомы тошноты, рвоты, изжоги [19, 21].
Такие компоненты специализированного пищевого продукта Кисель желудочный ЛЕОВИТ, как мята, зверобой и родиола розовая, обладают седативным действием. Например, родиола розовая ускоряет возвращение повышенного при стрессе уровня кортикостерона к нормальным величинам, продлевает стадию резистентности и лимитирует деструктивные проявления стадии истощения, ограничивает повышение уровня 11-ОКС в плазме, сберегает депо гликогена печени и мобилизует неэстерифицированные жирные кислоты как дополнительный энергетический резерв [17, 19].
С учетом вышеизложенного, а также многолетнего опыта использования и клинических испытаний можно сделать вывод, согласно которому специализированное питание детей старше 1 года и взрослых при болезнях ЖКТ Кисель желудочный ЛЕОВИТ (табл. 5):
- способствует снижению воспалительных процессов в ЖКТ;
- оказывает заживляющее и эпителизирующее действия на слизистую оболочку ЖКТ;
- способствует антимикробному действию, в т.ч. и на HР;
- оказывает спазмолитическое и болеутоляющее действия;
- улучшает микрофлору кишечника;
- способствует уменьшению и устранению таких симптомов, как тяжесть, дискомфорт и боли в животе, изжогу, тошноту, отрыжку, вздутие;
- улучшает аппетит, положительно влияет на моторно-эвакуаторные функции ЖКТ;
- ускоряет сроки выздоровления и способствует профилактике осложнений.
Заключение
Прием специализированного пищевого продукта диетического лечебного и диетического профилактического питания детьми раннего возраста от 1 года Кисель желудочный ЛЕОВИТ хорошо переносится детьми и взрослыми и не сопровождается побочными и аллергическими эффектами. По сути, в арсенале лечебных средств в комплексной терапии ХГ у детей специалисты-педиатры и гастроэнтерологи обладают уникальным дополнительным средством – Кисель желудочный ЛЕОВИТ, включающим природные компоненты и оказывающим системное положительное действие не только на СОЖ, но и на весь организм ребенка.


