Введение
Трансплантация гемопоэтических стволовых клеток (ТГСК) является стандартной терапией онкогематологических, онкологических, аутоиммунных, генетических заболеваний. ТГСК ассоциируется с посттрансплантационной диареей, потерей веса, энтеропатией с потерей белка, гипоальбуминемией [1–3], дефицитом макроэлементов и микроэлементов [4, 5].
При проведении ТГСК, особенно аллогенной трансплантации гемопоэтических стволовых клеток (аллоТГСК), повышается риск развития нутритивной недостаточности (НН). НН является частой клинической проблемой после аллоТГСК. НН перед аллоТГСК наблюдается у 23% пациентов, после аллоТГСК – у 75% [6, 7]. НН связана с токсичностью режимов кондиционирования (тошнотой, рвотой, мукозитом, диареей, дисгевзией, депрессией). Коррекция НН может снижать частоту инфекций, тяжелых форм острой и хронической реакции «трансплантат против хозяина» (РТПХ), улучшать гематологическое и иммунологическое восстановление, увеличивать общую выживаемость за счет снижения безрецидивной летальности [8]. В большинстве случаев регистрируется снижение массы тела (МТ) после аллоТГСК на 5–10% по сравнению с МТ до аллоТГСК [9]. НН перед аллоТГСК повышает риск длительной (в среднем до 56,4 месяца после аллоТГСК) НН у 20% пациентов [10]. Биоимпедансный анализ состава тела после аллоТГСК позволяет исключать повышение МТ за счет задержки жидкости, связанной с осложнениями ТГСК [11].
НП (нутритивная поддержка; клиническое питание) при проведении ТГСК остается непростой клинической задачей, хотя широко используется в трансплантационных центрах. Необходимость в НП возникает при аллоТГСК у 92% пациентов, при аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК) – у 37% [12].
При проведении режима кондиционирования возникает повреждение слизистого барьера желудочно-кишечного тракта (ЖКТ). Повреждение слизистого барьера ЖКТ – сложный и динамичный патобиологический процесс, который снижает качество жизни, повышает риски возникновения сепсиса, веноокклюзионной болезни, острой РТПХ и летальности. Мукозит начинается, когда завершается режим кондиционирования. Появление, продолжительность и тяжесть течения мукозита коррелируют с течением агранулоцитоза [13].
Энтеральное питание (ЭП) стимулирует продукцию гормонов кишечника, предотвращает атрофию слизистой оболочки, улучшает кровоток в слизистой оболочке и моторику ЖКТ, стимулирует образование слизи и секрецию секреторного иммуноглобулина А (sIgA), снижает бактериальную транслокацию из ЖКТ. В отсутствие тяжелого повреждения слизистого барьера ЖКТ ЭП и парентеральное питание (ПП) одинаково эффективны для поддержания нутритивного статуса [5].
Полное ПП рекомендуется пациентам, у которых ожидается длительный период (в зависимости от протокола лечения, гастроинтестинальных осложнений, тяжелых мукозитов, продолжительности агранулоцитоза, тромбоцитопении) значительного ограничения приема пищи (≥ 7–10–14 дней), чтобы восстановить отрицательный азотный и калорийный балансы [14]. При проведении аллоТГСК большинству пациентов требуется полное ПП. Продолжительность и выраженность НН при ТГСК сложно прогнозировать в клинической практике. Тяжелая НН при онкогематологических заболеваниях перед началом интенсивной противоопухолевой терапии встречается достаточно редко по сравнению с онкологическими заболеваниями. Выраженное повреждение слизистого барьера ЖКТ препятствует адекватному ЭП, приводит к НН, потере веса, мальабсорбции и дефициту питательных микроэлементов. Полное ПП способствует атрофии ворсинок, увеличивает проницаемость кишечника, снижает содержание sIgA в просвете и усиливает бактериальную транслокацию. Полное ПП улучшает отдаленные результаты (общую выживаемость, безрецидивную выживаемость, время возникновения рецидива) аллоТГСК в отличие от аутоТГСК, даже если пациенты достаточно питаются [15]. При проведении аутоТГСК пациенты не получают или получают незначительную пользу от полного ПП. Высокий индекс массы тела (ИМТ) не требует ПП [12]. Назначение ПП требует индивидуального подхода. ПП может быть более предпочтительным по сравнению с зондовым питанием при высоком риске кровотечений, инфекций. Выявление тяжелой НН до начала ТГСК и тщательный мониторинг возможности приема пищи во время ТГСК позволяют оптимально назначать ПП.
ЭП не ассоциируется с мальабсорбцией, клинически значимыми желудочно-кишечными расстройствами. Продолжительность ЭП коррелирует с улучшением нутритивного статуса (p<0,0001) [5].
ПП при ТГСК ассоциировано с более высокой частотой осложнений по сравнению с ЭП, например возникновением экзокринной недостаточности поджелудочной железы, более выраженной гипоальбуминемией, более частой и продолжительной диареей, фебрильной лихорадкой [5, 16, 17]. Существует значимая корреляция между продолжительностью ПП и продолжительностью диареи (р<0,0001) [5]. При хорошей переносимости ЭП имеет преимущества в коррекции НН по сравнению с ПП.
Эффективная НП снижает риски возникновения НН, улучшает нутритивный статус, непосредственные и отдаленные результаты, переносимость ТГСК, качество жизни [18]. Несмотря на многолетний накопленный опыт проведения аутоТГСК и аллоТГСК, в настоящее время не существует четких клинических рекомендаций высокого уровня доказательности по назначению методов, начала, продолжительности НП при ТГСК. При назначении НП трансплантационные центры используют внутренние протоколы, разработанные с учетом действующих рекомендаций ASPEN (American Society of Parenteral and Enteral Nutrition/ Американского общества парентерального и энтерального питания), ESPEN (European Society for Clinical Nutrition and Metabolism/Европейской ассоциации клинического питания и обмена веществ), экспертных рекомендаций, собственного клинического опыта.
Метаболические/катаболические нарушения
При ТГСК резко увеличивается энергетическая потребность, нарушается метаболизм белков, липидов, глюкозы, микронутриентов, в результате усиливаются процессы катаболизма. Катаболизм тканей опосредован выбросом цитокинов и контррегуляторных гормонов (кортизол, глюкагон, адреналин, гормон роста). Следствием метаболических, катаболических нарушений являются прогрессирующее снижение МТ, общей тощей (клеточной) массы тела, НН; дефицит общего белка, снижение эффективности НП. Белково-энергетическая недостаточность ухудшает исходы ТГСК (восстановление, летальность, осложнения) [19]. Поэтому оценка риска развития и наличия НН, применение оптимального ЭП и/или ПП обязательны при проведении ТГСК. НП корригирует недостаточность калорий, макронутриентов, микронутриентов, гиперметаболические нарушения.
Скрининг и клиническая оценка нутритивной недостаточности
ASPEN и ESPEN рекомендуют проводить скрининг и клиническую оценку НН для всех пациентов при поступлении на ТГСК и применять ЭП или ПП при НН или ожидаемой длительной недостаточности питания [14]. В настоящее время нет единого мнения в отношении оценки НН при проведении ТГСК. Трансплантационные центры, как правило, разрабатывают внутренние протоколы НП, основанные на действующих рекомендациях ASPEN, ESPEN, экспертных рекомендациях, собственном клиническом опыте.
Для скрининга и оценки НН разработаны универсальные специальные шкалы для клинического применения.
Шкалы скрининга и оценки НН:
1. Шкала MUST (Malnutrition Universal Screening Tool)
В шкале MUST (универсальный скрининг недоедания) учитываются снижение МТ, ИМТ, тяжесть заболевания, снижение потребления пищи. В зависимости от наличия или отсутствия этих факторов подсчитываются баллы, которые затем суммируются и на основании релевантных значений принимается решение относительно назначения НП [20].
2. Шкала NRS-2002 (Nutritional Risk Screening)
Шкала NRS-2002 (скрининг нутритивного риска) учитывает снижение МТ за последние 3 месяца, ИМТ, тяжесть заболевания, общее состояние. Нутритивный риск определяется ≥3 баллов. Шкала NRS-2002 ESPEN признана оптимальной для скрининга НН. По рекомендациям ESPEN все пациенты, которым планируется ТГСК, имеют риск возникновения НН. Клиническая оценка НН проводится каждые 3 дня по шкале NRS-2002 [21].
3. Шкала MST (Malnutrition Screening Tool)
Шкала MST (скрининг недоедания) включает снижение МТ, аппетит. Шкала MST надежная и удобная для клинического применения [22].
Для физической оценки НН используют основные критерии стандартизированной классификации ASPEN/ AND (Academy of Nutrition and Dietetics/Академия питания и диетологии): снижение потребления энергии, МТ, скелетной мышечной массы и функции мышц (саркопения), подкожного жира, силы сжатия кисти, накопление жидкости (локализованное или общее) [23, 24]. НН определяется при наличии ≥2 критериев.
Расчет калорийности
Основная (базовая) энергетическая потребность пациентов после ТГСК независимо от вида трансплантации рассчитывается по формуле Харриса– Бенедикта и составляет 30–35 ккал/кг/ день. Пациентам без дефицита питания достаточно 25–30 ккал/кг/день. У тяжелых пациентов энергетическая потребность повышается до 30–35 ккал/кг/ день [24–26]. Суточная потребность в белках повышена и составляет 1,5– 2,0 г/кг/день (20% от суточной энергетической потребности), в жирах – 30%, в углеводах не более 50% от суточной энергетической потребности. Потребность в белках повышается сразу после ТГСК при проведении терапии кортикостероидами. Потребность в белках корректируется при почечной недостаточности, печеночной энцефалопатии. Суточная поддерживающая потребность в жидкости составляет 1,5 л/м2, повышается при диарее, почечной недостаточности, применении нефротоксических препаратов. На протяжении всех этапов ТГСК предпочтение отдается пероральному питанию, чтобы сохранить МТ, мышечную массу, возможно, снизить риск развития РТПХ [27]. Своевременная коррекция осложнений ТГСК и НП повышают возможности адекватного перорального питания. Также важно поддерживать физическую активность на всех этапах ТГСК.
Применение полного парентерального питания
Миелоаблативные режимы кондиционирования осложняются тяжелыми мукозитами, анорексией, тошнотой, рвотой, диареей, эти осложнения ухудшают нутритивный статус, значительно ограничивают пероральное питание в ранний период после ТГСК. Назначение полного ПП на этот тяжелый период имеет преимущества. Полное ПП показано при выраженной недостаточности питания при поступлении, длительном периоде значительного ограничения приема пищи (7–10–14 дней), потере на ≥10% МТ, при потреблении ≤50% основной нормы калорий в течение ≥3 дней, при тяжелых гастроинтестинальных осложнениях продолжительностью более 5 дней при применении режимов кондиционирования, содержащих мелфалан, бусульфан, и режимов, включающих облучение всего тела [14, 28]. Рекомендуемая энергетическая потребность при ПП составляет 25–30 ккал/ кг/день (20–30% ккал за счет жиров), суточная потребность в белках – 1,5 г/кг/день [29]. Минимальное количество жиров составляет 4–8% от общего количества потребляемой энергии. Симптомы дефицита незаменимых жирных кислот появляются через 1–2 недели. При применении полного ПП важны тщательный контроль и коррекция уровня триглицеридов, глюкозы. При повышении уровня триглицеридов натощак более 500 мл/дл следует прекращать введение жиров. Витамин С рекомендуется в дозе 500 мг в день. При диарее назначается цинк в дозе 1 мг/100 мл. В смеси для ПП при необходимости добавляют витамины и микроэлементы. При ПП также важно учитывать наличие сахарного диабета, печеночной и почечной недостаточности.
При возобновлении перорального питания ПП снижается до 50% потребности в калориях. При потреблении более 50% основной нормы калорий в течение 2 дней ПП отменяется, при необходимости пациент может быть переведен на ЭП [19].
Применение энтерального питания
В настоящее время не существует оптимального протокола НП. При проведении аллоТГСК НН возникает быстро, если не проводится своевременная НП [7, 30].
Предпочтительным методом НП первой линии при возможности проведения является раннее естественное ЭП. При необходимости проводится зондовое ЭП, назогастральный зонд предпочтительно устанавливать после завершения режима кондиционирования, но до возникновения мукозита, в Д+1 [31, 32]. Эффективное зондовое ЭП позволяет значительно уменьшать потребность в ПП и снижать частоту осложнений, связанных с ПП [33]. Только при невозможности практического проведения или недостаточности ЭП назначается полное или добавочное ПП до клинического улучшения. Оптимальной стратегией НП для наиболее тяжелых пациентов является раннее комбинированное применение ЭП и добавочного ПП для достижения целевой суточной потребности в калориях и белке.
Преимущества ЭП по сравнению с полным ПП связаны со снижением риска возникновения катетер-ассоциированных инфекций, венозных тромбозов, метаболических нарушений, бактериальной транслокации из ЖКТ, риска развития тяжелой острой РТПХ [27, 31]. При переходе на ЭП учитывают нутритивный статус, общее состояние пациента, переносимость ЭП, риск развития синдрома перекармливания, наличие почечной недостаточности. Коррекция ЭП проводится с учетом восстановления естественного питания, при достижении целевой суточной нормы потребления в калориях и белке ЭП можно отменить. Тщательный мониторинг нутритивного статуса определяет необходимость возобновления ЭП.
Особенности нутритивной поддержки при аутологичной трансплантации гемопоэтических стволовых клеток
Клиническая оценка нутритивного статуса должна контролироваться на всех этапах ВДХТ с аутоТГСК. Также оценка нутритивного статуса должна проводиться перед ТГСК. ИМТ ниже нормы перед проведением ТГСК ассоциируется с увеличением числа рецидивов [34], безрецидивной летальностью (NRM – non-relapse mortality) [35, 36], снижением общей выживамости [34, 35, 37]. Актуальность определения сывороточного альбумина и преальбумина в качестве первичных диагностических показателей НН ограниченна [22, 38].
НН при проведении аутоТГСК ассоциируется с неблагоприятными клиническими исходами. Потерю мышечной массы (саркопению) перед аутоТГСК связывают с увеличением частоты осложнений, более длительной госпитализацией [39], риск возникновения НН – с более длительной госпитализацией, увеличением времени до приживления тромбоцитов, увеличением частоты инфекционных осложнений, обусловленных грамположительными бактериями, повышением одногодичной летальности [40, 41].
Высокий риск возникновения значительной НН отмечается при проведении аутоТГСК с миелоаблативными режимами кондиционирования, содержащими мелфалан, бусульфан, и режимов, включающих облучение всего тела. Сроки начала НП после ТГСК варьируются в разных центрах: в первый день после аутоТГСК или в течение первой недели, когда прием пищи составляет менее 50% от расчетной потребности в питании. Ранняя НП (до значительного ограничения приема пищи) не влияет на потерю МТ после госпитализации, мышечной массы, качество жизни, восстановление кроветворения, на продолжительность госпитализации. Ранняя НП по сравнению с обычной НП поддерживает МТ в период госпитализации. НП следует начинать при применении режимов кондиционирования с высоким риском гастроинтестинальной токсичности, если НН прогрессирует или прогнозируется длительное субоптимальное ограничение приема пищи. Эти подходы неприменимы при проведении аллоТГСК из-за более высокого риска гастроинтестинальной токсичности и РПТХ [8, 14].
Влияние стандартизированной нутритивной поддержки на риск развития нутритивной недостаточности при трансплантации аутологичных гемопоэтических стволовых клеток у пациентов с лимфомой Ходжкина: собственный опыт
В настоящее время нет единого стандарта проведения НП для пациентов с ЛХ во время проведения аутоТГСК. Каждый отдельный центр разрабатывает собственные протоколы проведения НП [EBMT, 2021], поэтому в нашем исследовании мы решили обратить внимание на группу пациентов с ЛХ во время проведения аутоТГСК.
Материал и методы
На базе отделения гематологии и химиотерапии с палатой реанимации и интенсивной терапии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России проведено нерандомизированное исследование с ретроспективным анализом с целью изучения влияния НП на риск развития гипопротеинемии и гипотрофии при проведении аутоТГСК.
В исследование были включены пациенты старше 18 и моложе 70 лет с диагнозом ЛХ, ECOG статус не выше 2, которым показано проведение аутологичной трансплантации в качестве консолидации эффекта после противорецидивной терапии.
Всего были включены 138 пациентов с ранним или поздним рецидивом ЛХ после первой линии химиотерапевтического лечения либо пациенты с первично рефрактерным течением заболевания, разделенные на 2 группы (табл. 1). В группу контроля вошли 68 пациентов, которым выполнялась аутоТГСК с использованием только ПП в случае снижения уровня общего белка и альбумина. В исследуемую группу вошли 70 пациентов, которым была назначена НП на весь период лечения с применением ЭП и ПП. Энтеральные смеси пациенты начинали получать с (-6-го) дня ВДХТ. Расчет калорийности энтерального сиппинга и его дозирование производились с учетом суточной потребности 35 ккал/кг МТ пациента. На подготовительном этапе лечения пациенты самостоятельно выбирали необходимую смесь для ЭП, исходя из индивидуальных вкусовых предпочтений. ПП с использованием трехкомпонентных смесей назначалось с (+2-го) дня после проведения инфузии аутологичных стволовых клеток крови независимо от уровня общего белка и альбумина.
Оценка нутритивного статуса пациента проводилась по данным историй болезни. Оценивался ИМТ, уровень общего белка и альбумина.
Конечными точками исследования были частота развития гипопротеинемии, а также частота развития гипотрофии у пациентов при проведении ВДХТ с аутоТГСК в исследуемых группах. Гипопротеинемия диагностировалась при уровне общего белка ниже 60 г/л согласно критериям CTCAE 5.0. Снижение уровня ИМТ ниже 20 считалось гипотрофией. Развитием НН считалось развитие гипопротеинемии и гипотрофии.
Статистический анализ
Для определения нормальности распределения использовались критерии Шапиро–Уилка и Колмогорова– Смирнова. Для нормально распределенных величин использовали методы параметрической статистики. При нормально распределенных переменных проверяли равенство дисперсий тестом Ливеня в испытуемых группах. При равенстве дисперсий применялся t-критерий Стьюдента, при неравенстве дисперсий применялся критерий Уэлча. При ненормально распределенных переменных использовали методы непараметрической статистики (U-критерий Манна–Уитни).
Результаты
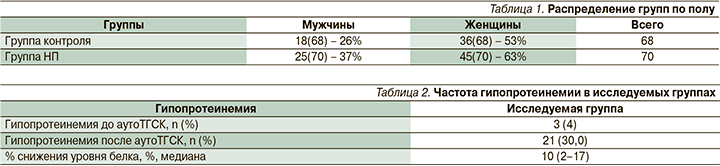
Гипопротеинемия до проведения ВДХТ с аутоТГСК диагностирована в 3 (4%) случаях в группе как без комбинированной НП, так и с комбинированной НП. После проведения ВДХТ и аутоТГСК в группе контроля у 48 пациентов встречалась гипопротеинемия (70%), в группе с комбинированной НП у 21 пациента (30%; р<0,001). Медиана снижения уровня общего белка в группе составила 16%, в группе с комбинированной НП 10%, при р=0,005 (табл. 2).
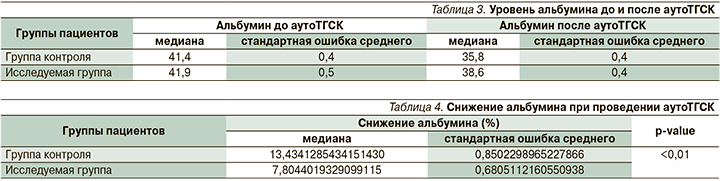
Медиана уровня альбумина составила 41,4 г/л в группе контроля, в исследуемой группе – 41,9. При оценке уровня альбумина в день приживления трансплантата оказалось, что медиана альбумина составила 35,8 г/л в группе контроля и 38,6 г/л в исследуемой группе. Процент снижения уровня альбумина за время аутоТГСК оказался статистически значимо ниже в исследуемой группе. Медиана снижения составила 7,8% в исследуемой группе против 13,4 в группе контроля, при р<0,01 (табл. 3, 4, рис. 1).
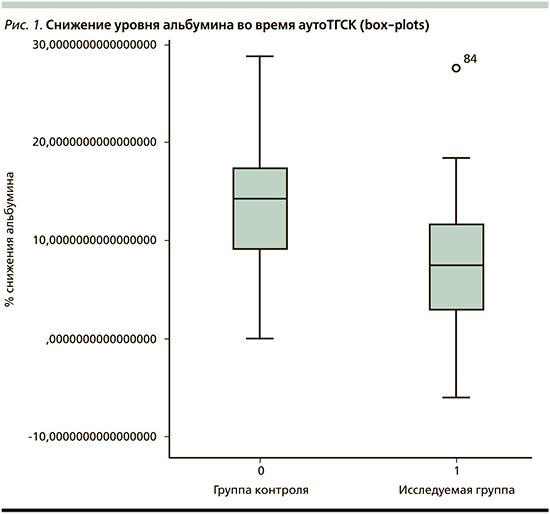
При сравнении нутритивного статуса пациента до и после проведения ВДХТ с аутоТГСК оказалось, что статистически достоверно в группе контроля частота развития гипотрофии, определяемой по уровню ИМТ, выше по сравнению с экспериментальной группой: 34 против 15% соответственно (p<0,01). Достоверность различий установлена по критерию χ2 Пирсона.
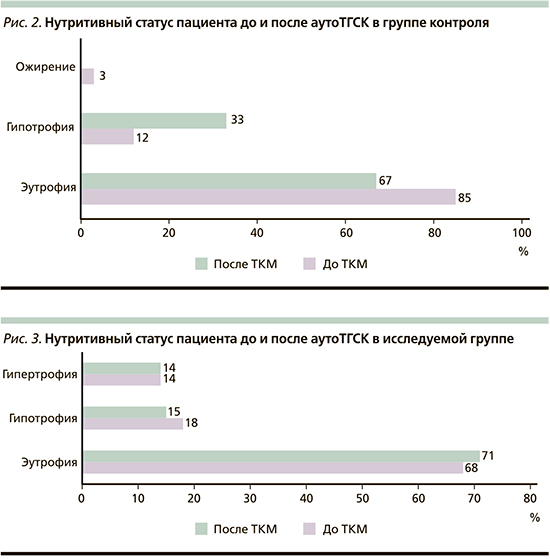
При внутригрупповом анализе частота понижения нутритивного статуса (из состояния как эутрофии в гипотрофию, так и из гипертрофии в эутрофию) в группе контроля составила 19%, в экспериментальной группе – 10% (p=0,02). При этом события, когда нутритивный статус пациента улучшался в контроле, не встретились, в группе НП такое событие встретилось у двух пациентов, однако это различие статистически не достоверно (рис. 2, 3). Данные проведенного нами анализа показали положительное влияние комбинированной нутритивной поддержки на снижение риска развития гипотрофии и гипопротеинемии при проведении ВДХТ с аутоТГСК у пациентов с ЛХ. Потенциально стандартизированный подход к НП у пациентов с ЛХ при аутоТГСК также может влиять на время приживления трансплантата, время восстановления гемопоэза, а также на потребность в гемотрансфузиях. Это объясняет необходимость проведения дальнейшего изучение роли, стандартизированной НП, с использованием ЭП и ПП на восстановление пациентов с ЛХ при проведении аутоТГСК.
Заключение
При проведении ТГСК рекомендуются ранняя и адекватная НП (ЭП и/или ПП) и физическая активность [41]. Необходимо проводить скрининг и клиническую оценку НН на всех этапах ТГСК. При выявлении НН важно сразу же начинать НП.
НП является обязательным компонентом лечения при проведении ТГСК. Своевременная и адекватная НП служит независимым фактором улучшения клинических исходов ТГСК, прогноза (общая выживаемость), снижения частоты инфекционных и иммунологических осложнений, уменьшения сроков приживления нейтрофилов, продолжительности госпитализации [9, 26, 41]. Выявление риска развития и наличия НН должно проводиться как можно раньше, чтобы проводить раннюю оптимальную НП при ТГСК.
Современные протоколы НП должны быть адаптированы для каждого пациента при проведении ТГСК, содержать четкие клинические рекомендации по срокам назначения и продолжительности ЭП и ПП.
Предпочтительным методом НП является ЭП по сравнению с ПП.
ПП назначается в качестве основного метода при невозможности или непереносимости ЭП. Раннее полное ПП рекомендуется при тяжелых мукозитах, тяжелой диарее, неукротимой рвоте, тяжелой мальабсорбции, РТПХ с поражением ЖКТ [42]. Преимущества ЭП связаны со снижением риска возникновения в первую очередь инфекционных осложнений [27, 31, 42]. Согласно международным рекомендациям ЭП с добавочным ПП или без ПП, показано в первой линии НП при аллоТГСК. ЭП ассоциируется со значимо меньшей частотой и тяжестью острой РТПХ, в частности III–IV степеней, острой РТПХ с поражением кишечника. При ЭП наблюдаются более быстрое восстановление эубиоза кишечника, разнообразие кишечной микробиоты, повышенная продукция короткоцепочечных жирных кислот после аллоТГСК. ПП ассоциируется с инфекционными, метаболическими осложнениями, нарушением функции печени, дисбиозом и атрофией слизистой оболочки кишечника. При этом во многих трансплантационных центрах продолжает применяться ПП в первой линии НП в период нейтропении после аллоТГСК, в основном из-за постоянного доступа к центральным венам, инвазивности зондового питания, непереносимости ЭП, предпочтения ПП медицинским персоналом, желудочно-кишечных симптомов, тромбоцитопении [42, 43].
Особенности НП при проведении ТГСК все еще изучены недостаточно. Обзор исследований НП при проведении ТГСК с 2009 по 2019 г. подтверждает необходимость дальнейших исследований для оптимизации протоколов НП [43] и ее влияния на выживаемость [9].
В большинстве трансплантационных центров используются внутренние протоколы скрининга НН, НП, нейтропенической диеты, а также протоколы НП с предпочтением ПП на раннем этапе при проведении аллоТГСК [44]. В последние годы современные стратегии НП поддерживают раннее назначение ЭП и добавочного ПП тяжелым пациентам для достижения целевой суточной потребности в калориях и белке.
Эффективная, своевременная НП позволяет улучшать результаты ТГСК за счет уменьшения инфекционных осложнений, объема переливания эритроцитов и тромбоцитов, периода приживления, сокращения сроков госпитализации в отделении трансплантации костного мозга, улучшения выживаемости [26, 45]. Исследования, показавшие эти результаты, проведены на неоднородной группе пациентов с различными диагнозами, что требует дальнейшего изучения влияние НП на исход аутоТГСК на однородных выборках.
Определение нутритивных факторов риска, оптимальных стратегий НП с применением раннего ЭП у пациентов с ослабленным иммунитетом может улучшать непосредственные и отдаленные результаты ТГСК.


