Актуальность
Нутритивная недостаточность (недостаточность питания; НН) – это состояние, развивающееся в связи с недостаточным поступлением, потреблением или усвоением пищевых веществ, что приводит к изменению массы и состава тела, изменению иммунологической резистентности, снижению физического и психомоторного развития, ухудшению клинических исходов заболевания. Недостаточность питания является неблагоприятным преморбидным фоном и представляет собой, по образному выражению некоторых экспертов, «скрытую угрозу» для больных как в развивающихся, так и в развитых странах [1, 2].
Несмотря на широкую распространенность НН у госпитализированных детей, она достаточно часто недооценивается врачами, не корригируется, что влияет на эффективность терапии и затраты на лечение. Ряд исследователей отмечают, что распространенность НН в педиатрических стационарах колеблется от 15 до 30% в зависимости от критериев, используемых для ее определения, нозологии, возраста пациентов и спектра их заболеваний [3]. Несмотря на достижения в области оказания медицинской помощи за последние 20 лет, распространенность НН среди госпитализированных детей не уменьшилась, в то время как основные усилия исследователей направлены на изучение причин роста избыточной массы тела и частоты ожирения в детской популяции [3].
К нарушениям нутритивного статуса больного ребенка могут привести следующие факторы:
- заболевания, при которых повышена потребность в пищевых веществах и снижено их потребление;
- диагностические и лечебные процедуры, выполняемые натощак;
- возраст менее 24 месяцев;
- лихорадка;
- диспепсические нарушения (абдоминальная боль, тошнота, рвота, снижение аппетита);
- продолжительность госпитализации более 5 дней [1, 4].
Нутритивная поддержка (НП) предусматривает обеспечение поступления пищевых веществ за счет использования специализированных смесей при невозможности удовлетворения потребностей в нутриентах с помощью обычных продуктов питания или лечебного рациона [1–6].
В связи с этим задачами врача-специалиста являются выявление признаков НН, ее профилактика или адекватная терапия. Для обеспечения эффективного решения данных задач необходим поэтапный подход, предусматривающий как диагностику имеющихся нарушений, так и выявление пациентов группы риска. По мнению экспертов, предупредить легче, чем лечить.
Основные этапы нутритивной поддержки
Первым этапом должен быть скрининг, предполагающий своевременную диагностику НН, выявление пациентов, нуждающихся в назначении НП, и больных группы риска.
Обследование на этом этапе должно быть быстрым и доступным. Для скрининга НН в педиатрической практике используются:
- общеклинические показатели: осмотр состояния кожных покровов, слизистых оболочек, волос, ногтей, зубов, мышечной ткани, подкожно-жирового слоя, а также оценка микросимптоматики возможной витаминной и минеральной недостаточности;
- массоростовые показатели: индекс массы тела (ИМТ; отношение фактической массы тела [кг] к длине тела [м²]); окружность плеча (ОП; на уровне средней трети плеча нерабочей руки); толщина кожно-жировой складки над трицепсом (КЖСТ); окружность мышц плеча (ОМП= ОП – КЖСТ).
ИМТ является ориентировочным показателем, поскольку не отражает изменения различных фракций состава тела (тощей и жировой массы). Наиболее информативными в этом плане являются данные биоимпедансометрии, отражающие состав тела и позволяющие анализировать изменения массы тела (объем жировой и мышечной ткани), что весьма важно в клинической практике. Антропометрические показатели оцениваются по таблицам центильных величин, рекомендованных ВОЗ [7].
Более детальное обследование должно предусматривать также анализ некоторых биохимических показателей, таких как общий белок, альбумин, короткоживущие белки (трансферрин, преальбумин и др.), креатинин, мочевина.
С позиции метаболизма белка наиболее значимыми, хотя и неспецифичными в плане диагностики нутритивного статуса, критериями являются преальбумин и трансферрин, имеющие наиболее короткий период обмена: 2 и 7 дней соответственно. Изменения уровня альбумина отражают достаточно длительные нарушения нутритивного статуса и менее информативны при острых состояниях.
В качестве иммунных маркеров рекомендуются: абсолютная лимфопения, снижение соотношения CD4+/CD8+, задержка тестов гиперчувствительности (показатели клеточного иммунитета), а также снижение уровня иммуноглобулинов, характеризующих состояние гуморального иммунитета. Эти показатели лишь частично отражают нарушение нутритивного статуса, но имеют прогностическое значение.
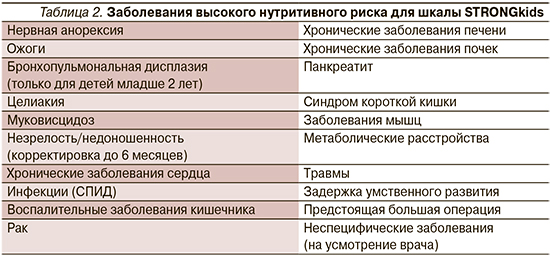
В настоящее время в качестве скрининга нутритивного риска у детей в мировой практике широкое распространение получило применение определенных шкал-опросников: педиатрическая шкала оценки нутритивного риска (SPNRS) [8], скрининговая шкала оценки риска недостаточности питания (STRONGkids) [9], скрининг недостаточности питания в педиатрии (STAMP) [10], детская Йоркхиллская шкала недостаточности питания (PYMS) [11]. Хотя эти методики используют разные вводные данные, они позволяют выявить аналогичные категории риска.
По данным разных исследователей, скрининговая шкала STRONGkids демонстрирует наибольшую среди названных шкал чувствительность в отношении выявления нутритивных нарушений у госпитализированных детей [12–14] (табл. 1).

Далее в зависимости от полученных баллов определяются степень риска НН и дальнейшие действия (табл. 3).
Показания к назначению пациентам НП:
- высокий риск формирования НН, обнаруженный при скрининге;
- клинически выраженная недостаточность питания (неадекватные прибавки роста/веса в течение более 1 месяца у детей младше 2 лет и более 3 месяцев у детей старше 2 лет; нарушение центильного коридора более чем на 2 интервала; снижение скорости роста более 2 см/год от долженствующего для раннего и среднего пубертата);
- быстропрогрессирующая потеря массы тела (более 2% за неделю, 5% за месяц или 10% за 3 месяца;
- гипопротеинемия, гипоальбуминемия;
- отсутствие возможности оптимального естественного питания (невозможность обеспечить 60–80% рациона более 10 дней у детей старших возрастных групп, более 5 дней у детей раннего и дошкольного возраста и более 3 дней до 1 года; общее время кормления более 4 часов в день);
- возросшие потребности вследствие имеющих место явлений гиперкатаболизма [15–17].

Оценка нутритивного статуса и риска развития НН служат основанием для консультации диетолога и разработки протокола НП: выбор смеси, расчет питания, способ введения, критерии оценки.
Вторым этапом при назначении НП является выбор оптимального способа доставки и вида специализированной лечебной смеси для проведения коррекции нутритивных нарушений.
НП может осуществляться следующими методами: прием энтерального питания дополнительно к основному или лечебному рациону – сиппинг (как напиток глотками или через трубочку; проведение сиппинга возможно при сохранении глотательной функции и желании пациентов принимать смесь; в виде зондового питания (назогастральный, назоеюнальный зонды; гастро- и еюностомы), которое назначается при выраженной анорексии, нарушении проходимости верхних отделов пищеварительного тракта, затруднении сознания. При невозможности доставки питательных веществ в необходимом количестве через зонд, или когда ребенок по той или иной причине не может (не должен) получать питание энтеральным путем, назначается парентеральное питание (периферическое или центральное) в полном объеме с сохранением минимального трофического или сочетанного энтерально-парантерального питания [15–17].
В настоящее время в арсенале практического врача имеется широкий ассортимент смесей для НП у детей: полимерные стандартные, гиперкалорийные, в т.ч. с пищевыми волокнами; элементные и полуэлементные, фармаконутриентные, метаболически ориентированные, модульные. Смеси могут быть преимущественно сывороточными или казеиновыми, жидкими и сухими, дифференцированными по возрасту [18].
Выбор смеси для НП проводится с учетом нутритивного статуса, состояния здоровья ребенка, состояния желудочно-кишечного тракта (ЖКТ). При нормальном функционировании ЖКТ может быть назначена стандартная полимерная или гиперкалорийная смесь. При нарушении процессов метаболизма пищевых веществ, развитии явлений синдрома мальабсорбции следует отдать предпочтение полуэлементным или даже элементным смесям [18].
НП должна проводиться как в период пребывания пациента в стационаре, так и в амбулаторно-поликлинических условия при подготовке к госпитализации, плановому оперативному лечению, при проведении циклов полихимиотерапии и других ситуациях, связанных с риском развития НН.
Принцип выбора лечебной смеси данной категорией пациентов может быть следующим:
- При пролонгировании НП назначается смесь, которую ребенок ранее получал в стационаре, методом сиппинга, дополнительно к основному рациону в объеме 10–15% от рекомендуемой возрастной нормы.
- При первично назначаемой НП с учетом состояния здоровья и нутритивного статуса пациента могут быть рекомендованы стандартная (1 ккал/мл) или гиперкалорийная (1,5 ккал/мл) смеси, также в количестве 10–15% от рекомендуемой возрастной нормы.
Назначать смеси следует в соответствии с возрастом, для которого они предназначены (вводить постепенно, с учетом переносимости пациентом).
В контексте оптимизации нутритивного статуса пациентов в стационаре следует также обратить внимание на прием пищи перед оперативным вмешательством. Традиционно в отечественной педиатрической практике имеет место достаточно длительный интервал «голодной паузы» между последним приемом пищи и началом операции. По мнению зарубежных специалистов, этот интервал не должен превышать 6 часов [5, 6, 17, 19].
В послеоперационном периоде в настоящее время также рекомендуется достаточно раннее назначение энтерального питания. Возможность использования в качестве критерия для назначения энтерального питания отхождения стула или газов, по мнению экспертов, не доказана. Полное парентеральное питание следует назначать только при невозможности проведения энтерального питания (табл. 4).
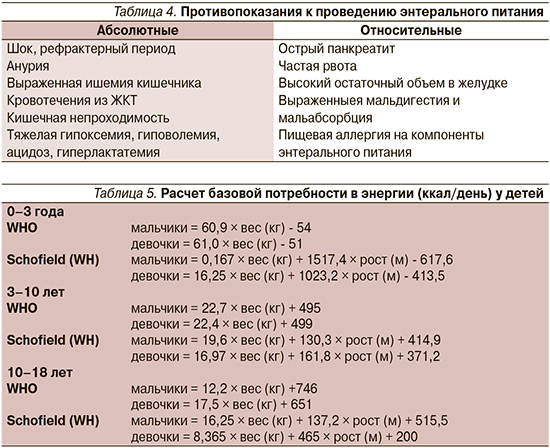
Таким образом, во всех случаях, когда это возможно, выбор способа НП должен склоняться в сторону энтерального питания.
Третий этап предусматривает расчет потребностей пациентов в питательных веществах.
Этот расчет осуществляется с учетом основного обмена пациента (базовая энергетическая потребность), к которой добавляются поправочные коэффициенты (табл. 5, 6).
Определение базовой энергетической потребности проводится методами прямой и непрямой калориметрии с использованием метаболографа, что, безусловно, наиболее точно отражает потребности ребенка, а также расчетными методами.
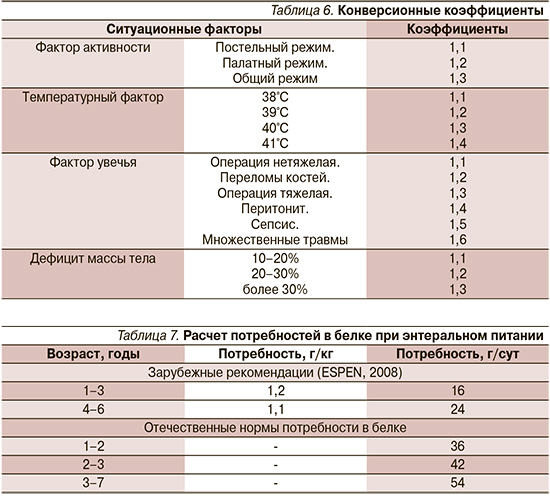
Наиболее часто используются рекомендации ВОЗ (табл. 5), кроме того, предлагаются и другие варианты расчета – Schofield, Harris-Benedict и др. [20].
После определения базовой энергетической потребности добавляются конверсионные коэффициенты, соответствующие конкретной ситуации в зависимости от фактора активности ребенка, дефицита массы тела, фактора роста и заболеваемости (табл. 6).
После расчета энергетической ценности рациона для пациента проводится расчет потребности в белке (табл. 7).
При тяжелых метаболических нарушениях следует использовать рекомендации Комитета по энтеральному и парентеральному питанию, которые существенно ниже [17].
Избыточное потребление белка оказывает чрезмерную нагрузку на ферментные системы, функцию почек, что может усилить имеющиеся метаболические нарушения и вызвать гипертермию. Существует мнение, будто в период заболевания, когда отмечается усиленный катаболизм белка, пациент и так перегружен белковыми метаболитами, а дополнительное введение белка может переориентировать его метаболизм, приводить к кетозу и анаболизму [4, 5, 16, 17].
Расчет потребностей в энергии и белке при энтеральном питании вначале должен осуществляться на фактическую массу тела, а после адаптации к нутритивной нагрузке – постепенно переходить к расчету на долженствующую массу тела. При критических состояниях расчет суточного объема НП идет преимущественно на уровне базовой энергетической потребности. Избыточная алиментация может ухудшить состояние пациента.
Количество получаемых ребенком пищевых веществ (за счет различных подходов к коррекции его питания) должно быть отражено в истории болезни или протоколе НП, который каждый стационар разрабатывает самостоятельно [21].
Длительность НП определяется терапевтической эффективностью – до нормализации пищевого статуса.
Четвертый этап включает обязательный мониторинг качества и эффективности проводимой НП:
- общий белок сыворотки крови 1 раз в 5–7 дней;
- альбумин сыворотки крови 1 раз в 5–7 дней;
- гемоглобин 1 раз в 5–7 дней;
- лимфоциты периферической крови 1 раз в 5–7 дней;
- масса тела и ИМТ тела 1 раз в 7–10 дней.
Частота исследования данных показателей может изменяться вьзависимости от конкретной клинической ситуации [15–17].
Пятый этап должен предусматривать профилактику и коррекцию возможных осложнений, что может быть обеспечено при проведении НП с учетом вышеизложенных подходов.
Наиболее тяжелым осложнением НП является «сидром возобновленного кормления» (рефидинг-синдром), развивающийся при возобновлении питания пациентов с исходной НН и характеризующийся метаболическими и патофизиологическими нарушениями, приводящими к тяжелой полиорганной недостаточности. Следует отметить, что рефидинг-синдром возникает при всех видах питания – пероральном, энтеральном и парентеральном [22]. Данный синдром часто остается нераспознанным или имеет субклиническое течение. Так, в исследовании, в котором питание было возобновлено после 48 часов голодания, у 34% пациентов выявлялись нарушения в виде «рефидинг-гипофосфатемии» [23].
К группе риска развития рефидинг-синдрома относят пациентов, у которых наблюдаются следующие состояния: нервная анорексия; онкологические заболевания; периоперационный период; хронические инфекции (например, ВИЧ или туберкулез); декомпенсированный сахарный диабет; хроническая нутритивная недостаточность – маразм, длительное голодание, синдром мальабсорбции; критическое состояние без адекватного питания; длительный прием антацидов; длительный прием диуретиков [22, 23].
Клинические проявления рефидинг-синдрома могут включать следующие симптомы:
- со стороны сердечно-сосудистой системы – аритмии, сердечная недостаточность, внезапная смерть;
- респираторные симптомы – слабость дыхательных мышц, острая дыхательная недостаточность;
- метаболические расстройства – гипергликемия, метаболический ацидоз, метаболический алкалоз, респираторный алкалоз;
- со стороны нервной системы – слабость, парестезии, тремор, атаксия, делирий, острая энцефалопатия, кома, синдром Гийена-Барре, центральный понтинный миелинолиз;
- со стороны скелетно-мышечной системы – слабость, миалгии, рабдомиолиз, остеомаляция;
- со стороны ЖКТ – анорексия, боли в животе, запоры, рвота;
- другие симптомы, такие как острый тубулярный некроз, острая печеночная и почечная недостаточность [22, 23].
При развитии рефидинг-синдрома следует уменьшить количество вводимой смеси до безопасного объема или приостановить питание, увеличить дозв вводимых фосфатов, калия, магния, а также проводить коррекцию развивающейся полиорганной недостаточности по общепринятым методам [15–17, 22].
Другими возможными осложнениями при проведении энтерального питания могут быть:
- желудочно-кишечные осложнения (30–38% от всех возможных): спастические боли и метеоризм, тошнота и рвота, эзофагиальный рефлюкс, диарея, синдром мальабсорбции, кишечное кровотечение;
- механические осложнения (2–10%): ринит, отит, паротит, фарингит, эзофагит, легочная аспирация, эрозия пищевода, смещение зонда, закупорка зонда, прободение;
- метаболические и инфекционные осложнения: нарушения метаболизма кальция, магния, фосфора; нарушение баланса жидкости, гиперосмолярные состояния; гипер- и гипогликемия; микробная контаминация, колонизация и инвазия [17].
Обсуждение
Таким образом, рутинный скрининг недостаточности питания у детей должен быть неотъемлемым инструментом в работе врача-специалиста, поскольку отдаленные последствия НН негативно влияют на показатели физического, психомоторного, интеллектуального развития ребенка, а также формируют предрасположенность к хроническим заболеваниям. Своевременная и адекватная коррекция НН является залогом сохранения здоровья и повышения качества жизни детей и их семей.
Профилактика возможных осложнений от проведения НП в условиях стационара должна базироваться на принципе этапности: лечебный рацион; дополнение рациона смесями методом сиппинга; зондовое питание; сочетанное энтерально-парантеральное или полное парентеральное питание и осуществляться в зависимости от тяжести НН педиатром, диетологом или группой НП [21].
Заключение
В настоящее время методические подходы к назначению НП, шкалы-опросники по выявлению нутритивного риска у детей разработаны и внедряются во многих стационарах, в т.ч. в ГБУЗ «Морозовская детская городская клиническая больница» ДЗМ.
Накопленный опыт применения, обсуждение некоторых дискуссионных вопросов позволят разработать и утвердить наиболее оптимальные алгоритмы проведения НП в отечественной педиатрической практике.


