Введение
У больных хронической болезнью почек (ХБП) часто выявляют нарушение функционального состояния щитовидной железы (ЩЖ) [1]. По литературным данным известно, что нарушение функции ЩЖ у больных ХБП связано с нарушением выведения йода с мочой. В условиях ХБП потенцируется эффект Вольфа-Чайкова: подавляются процессы органификации йода и синтеза гормонов щитовидной железы, нарушается периферическая конверсия тироксина (Т4) в трийодтиронин (Т3) в тканях, что в большинстве случаев приводит к снижению функциональной активности ЩЖ [2]. В условиях снижения функциональной активности ЩЖ у больных ХБП развиваются гипонатриемия, снижение экскреции воды, уровня мочевой кислоты, снижение расчетной скорости клубочковой фильтрации (рСКФ) и усиление прогрессирования ХБП [2-4].
У больных ХБП достаточно часто встречается атерогенная дислипидемия, ассоциированная с высокой частотой неблагоприятных исходов у них [5]. В условиях ХБП формирование атерогенной дислипидемии происходит за счет изменений качественного и количественного составов липидов, а именно повышения уровней аполипопротеина B (апоВ), липопротеина (a), липопротеинов средней и очень низкой плотности (ремнантные частицы) [5-7]. Все эти изменения характеризуют липидный профиль у больных ХБП как более атерогенный [8, 9]. Гипотиреоз, вероятно, также вносит свой вклад в формирование атерогенных дислипидемий у больных ХБП. Тиреоидные гормоны регулируют активность ключевых ферментов липидного метаболизма. Известно, что в условиях гипотиреоза формируется нарушение катаболизма атерогенных фракций липидов, в частности липопротеидов низкой плотности (ЛПНП) [7, 10].
Все пациенты с ХБП относятся к категории высокого и очень высокого сердечно-сосудистого риска, поэтому у всех этих больных есть показания к гиполипидемической терапии [10]. Однако назначение статинов ограничено уровнем рСКФ <30 мл/мин. Поэтому в большинстве случаев пациенты с ХБП получают терапию статинами off-label.
Рекомендации по лечебной тактике субклинического гипотиреоза и гиполипидемической терапии больных ХБП не разработаны [11, 12]. Поэтому представляется важным изучение функционального состояния ЩЖ у больных ХБП, вклада тиреоидной дисфункции в формирование атерогенной дислипидемии и прогрессирования ХБП. Полученные данные позволят в дальнейшем персонифицировать лечебную тактику в отношении больных ХБП с субклиническим гипотиреозом (СГ) и атерогенной дислипидемией.
Цель исследования: оценка влияния заместительной терапии левотироксином на показатели липидного спектра крови и рСКФ у больных СГ (и различными стадиями ХБП).
Методы
Исследование проводилось на базе Первого Санкт-Петербургского государственного университета им. академика И.П. Павлова НИИ нефрологии. Исследование одобрено на заседании локального этического комитета ПСПбГМУ им. И.П. Павлова (протокол № 8 от 29.11.2019). Все пациенты, принимавшие участие в исследовании, подписали информированное согласие. Проведено одномоментное поперечное исследование по изучению функционального состояния ЩЖ у больных ХБП. Выполнено скрининговое определение уровня тиреотропного гормона (ТТГ) у больных (n=457) с гломерулопатиями без клинически значимых заболеваний сердечно-сосудистой системы с сохранной фракцией выброса (>55% по Simpson) по данным эхокардиографии (Эхо-КГ). По результатам скринингового обследования выявлены группы больных с низким уровнем ТТГ (<0,4 мМЕ/л), с нормальным уровнем ТТГ (0,4-3,5 мМЕ/л) и с СГ (ТТГ >3,5 мМЕ/л). В группе больных СГ (n=72) проведено открытое рандомизированное проспективное исследование по изучению эффективности заместительной терапии левотироксином. Оценены исходные показатели тиреоидного статуса пациентов, рСКФ, липидного спектра крови; показатели белкового и азотистого обмена. Больные СГ были рандомизированы в две группы: 1-я - группа наблюдения (n=36) и 2-я - группа лечения (n=36). В группе лечения всем больным назначена заместительная терапия левотироксином. Доза левотироксина определялась индивидуально в зависимости от возраста, рСКФ и составляла от 12,5 до 25 мкг/сут. с последующей титрацией до достижения целевого значения ТТГ (0,4-2,5 мМЕ/л) [13]. Через 6 месяцев в обеих группах выполнен контроль показателей тиреоидного статуса, рСКФ, показателей белкового и азотистого обменов, липидного спектра крови.
Для исследования показателей липидного спектра проводился забор венозной крови утром натощак через 12 часов после последнего приема пищи.
Концентрации общего холестерина (ОХС), триглицеридов (ТГ), липопротеинов высокой плотности (ЛПВП), ЛПНП определялись в сыворотке крови ферментным методом реактивами «Vital» (Россия) на автоматическом биохимичеком анализаторе «AU-680» (Beckman, США); единицы измерения — ммоль/л. Референсные интервалы: ОХС - 3,10-5,20 ммоль/л, ХС ЛПВП >1,55 ммоль/л, ХС ЛПОНП - 0,60-1,10 ммоль/л, ХС ЛПНП - 1,684,53 ммоль/л, ТГ- 0,40-,54 моль/л, коэффициент атерогенности <3,0. В соответствии с клиническими рекомендациями Евразийской Ассоциации кардиологов (ЕАК)/Национального общества по изучению атеросклероза (НОА, Россия) по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза [14] целевыми значениями считали ОХС <4,5 ммоль/л, ТГ <1,7 ммоль/л. У больных с рСКФ >30 мл/ мин целевыми значениями считали ЛПНП <2,5 ммоль/л, а для больных с рСКФ <30,0 мл/мин - ЛПНП <1,8 ммоль/л. ЛПОНП рассчитывали по формуле Фридвальда при уровне ТГ до 4,5 ммоль/л - ЛПОНП = ТГ/5. При уровне ТГ больше 4,5 ммоль/л использовали формулу Wilson et al. - ЛПОНП = ТГ*0,166. Определение уровня ТТГ проводили методом ИФА с использованием анализатора Beckman Coulter, определение уровней свободного тироксина (свТ4), свободного трийодтиронина (свТ3) проводили методом ИФА ACCESS® IMMUNOASSAY SYSTEMS. Референсный интервал для свТ4 был 7,8-14,3 пмоль/л, для свТ3 - 3,5-6,4 пмоль/л.
Статистический анализ проводился с использованием программы StatTech v. 2.6.1 (разработчик - ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50). Количественные показатели, имевшие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1-Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). При сравнении количественных показателей, распределение которых отличалось от нормального, в двух связанных группах использовался критерий Уилкоксона. При сравнении трех и более зависимых совокупностей, распределение которых отличалось от нормального, использовался непараметрический критерий Фридмана с апостериорными сравнениями с помощью критерия Коновера-Имана с поправкой Холма. Значимым считался уровень р<0,05.
Результаты
Обследованы 457 больных, среди них 261 (57,1%) женщина и 196 (42,9%) мужчин. Возраст больных составил от 18 до 89 полных лет, медиана возраста - 52 полных года. Уровень ТТГ был от 0,001 до 17,202 мМЕ/л, медиана ТТГ - 1,959 (1,300-3,000) мМЕ/л. При анализе уровня ТТГ у мужчин и женщин не удалось выявить статистически значимых различий (p=0,356). По уровню ТТГ обследованных больных распределили по группам: группа I c низким уровнем ТТГ (<0,4 мМЕ/л) - 2,8% (n=13); группа II с нормальным уровнем ТТГ (0,4-3,5 мМЕ/л) - 81,2% (n=371); группа III с СГ (>3,5 мМЕ/л) - 16,0% (n=73). Значимые различия по полу в группах больных по уровню ТТГ выявлены не были (р=0,451). В зависимости от стадии ХБП по рСКФ пациенты распределились следующим образом: ХБП С1 - 80 (17,5%) человек, ХБП С2 - 99 (21,7%), ХБП С3а - 73 (16,0%), ХБП С3б - 82 (17,9%), ХБП С4 - 85 (18,6%), ХБП С5 - 38 (8,3%). Значимые гендерные различия у больных с разными стадиями ХБП выявлены не были (р=0,748). СГ был выявлен у 12 (15,0%) пациентов с ХБП С1, у 9 (9,1%) с ХБП- С2, у 12 (16,4%) с ХБП-С3а, у 15 (18,3%) с ХБП С3б, у 20 (23,5%) с ХБП-С4 и у 5 (13,2%) с ХБП-С5. Корреляция между уровнем ТТГ и рСКФ не выявлена (р= -0,049, p=0,292). Анализ группы с нормальным уровнем ТТГ и группы с СГ по сравниваемым показателям представлен в табл. 1.

Таким образом, в группе больных СГ наблюдались более выраженные нарушения белкового обмена за счет снижение уровней общего белка и альбумина, значимое увеличение суточной протеинурии, снижение общего кальция, повышение фосфора неорганического, хлоридов. По показателям липидного спектра крови пациентов с СГ уровень ЛПВП был значимо выше. Среди обследованных больных (n=457) только 13,1% (n=60) получали терапию статинами. Большая часть этих больных страдали нефротическим синдромом. Целевых показателей липидного спектра достигнуто не было.
Для изучения влияния гипотиреоза на формирование дислипидемии у больных ХБП представлялось целесообразным выделить группу пациентов с низконормальным ТТГ (0,42,5 мМЕ/л) и группу больных с ТТГ >7,0 мМЕ/л. Так, по данным крупного мета-анализа, 18 исследований с обследованием 73 тыс. больных [15], показано, что пороговое значение ТТГ >7,0 мМЕ/л ассоциировано с высоким риском сердечно-сосудистых осложнений и формированием атерогенных дислипидемий. Обследованных больных разделили на две группы: 1-я с низконормальным ТТГ (0,4-2,5 мМЕ/л) - n=281, 2-я группа (n=14) - ТТГ больше 7,0 мМЕ/л. Результаты анализы групп по показателям липидограммы представлены в табл. 2.
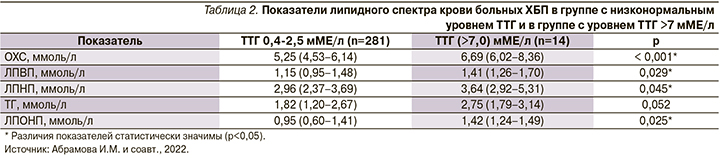
Таким образом, в группе больных с уровнем ТТГ>7,0 мМЕ/л выявлены значимо большие уровни ОХС, ЛПВП, ЛПНП, ЛПОНП по сравнению с группой с низконормальным уровнем ТТГ.
Для лечения больные СГ (n=72) были рандомизированы в две группы без значимых различий по половому и возрастному составу. Данные по исходным показателям в группе лечения и группе наблюдения представлены в табл. 3.
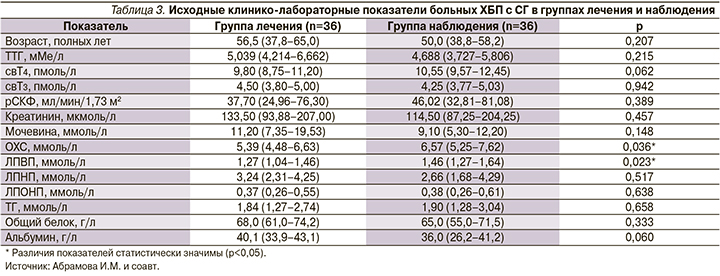
Таким образом, исходно в группе лечения и в группе наблюдения значимые различия по возрасту, показателям тиреоидного статуса, рСКФ, азотистому и белковому обменам выявлены не было. Были выявлены более высокие значения исходных ОХС и ЛПВП в группе сравнения по сравнению с группой лечения (р=0,036 и р=0,023 соответственно).
В группе лечения (n=36) пациенты получали заместительную терапию левотироксином в индивидуальных дозах от 12,5 до 25 мкг/сут. до достижения целевых значений ТТГ. Другая группа являлась группой наблюдения (n=36). Через 6 месяцев пациенты были приглашены для оценки ранее проанализированных показателей в динамике. В группе лечения в исследовании продолжили участие 34 пациента, в группе наблюдения - 32. Анализ динамики лабораторных показателей в группах представлен в табл. 4.
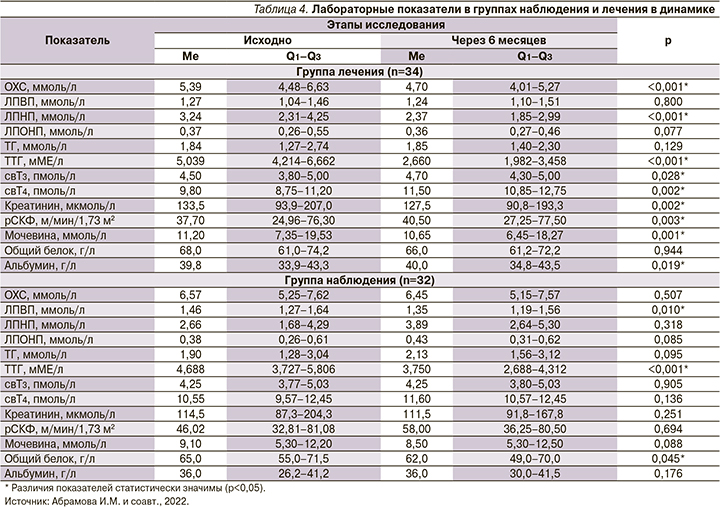
В группе наблюдения через 6 месяцев целевые значения ТТГ достигнуты 7 (20,6%) пациентами, в группе лечения - 15 (46,9%) (р=0,024). Данное наблюдение можно объяснить тем, что у пациентов с ХБП заболевание в подавляющем большинстве случаев обусловлено неиммунными механизмами [16]. У части больных возможно спонтанное восстановление уровня ТТГ. В группе лечения в динамике через 6 месяцев наблюдалось значимое снижение уровней ТТГ, ОХС, ЛПНП, креатинина, мочевины и повышение уровней свТ3, свТ4, рСКФ, альбумина. В группе наблюдения в динамике отмечалось значимое снижение уровней ЛПВП, ТТГ и общего белка.
Обсуждение
Работа посвящена изучению функционального состояния ЩЖ у больных разными стадиями ХБП. Больные ХБП относятся к группе высокого сосудистого риска. Известно, что СГ вносит вклад в формирование атерогенной дислипидемии и в прогрессирование ХБП.
При сравнении групп больных ХБП выявлено, что СГ ассоциирован с выраженными отклонениями показателей белкового, азотистого и липидного метаболизма. Поэтому представляется целесообразным проведение скринингового определения тиреоидной функции всем больных ХБП. Также представлялось важным обосновать целесообразность заместительной терапии с использованием препаратов левотироксина у больных ХБП с СГ. В работе показано, что заместительная терапия левотироксином для таких пациентов эффективна, приводит к замедлению прогрессирования ХБП, улучшению показателей липидограммы и белкового обмена.
Заключение
В проведенном исследовании СГ у больных ХБП ассоциирован с нарушениями белкового и липидного метаболизма, отклонениями в уровне электролитов. У пациентов с СГ наблюдалось снижение уровней общего белка и альбумина, повышение концентрации кальция, фосфора и хлоридов, увеличение суточной протеинурии и соотношения альбумин/креатинин в моче. Показатели ОХС, ЛПНП, ЛПОНП у больных с СГ и ХБП были значимо выше, чем у больных ХБП с нормальной функцией ЩЖ.
Заместительная терапия левотироксином больных СГ и ХБП привела к значимому улучшению показателей липидного спектра крови, рСКФ, к снижению уровней креатинина, мочевины, к повышению концентрации альбумина.
Вклад авторов. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации, несут ответственность за целостность всех частей статьи.



