На рубеже ХХ в. мировое сообщество столкнулось с глобальной проблемой, имеющей не только медицинское, но и огромное социально-экономическое значение, – пандемией неинфекционных хронических болезней внутренних органов, среди которых хроническая болезнь почек (ХБП) заняла «достойное» место [11]. В 2002 г. Национальным почечным фондом США была сформулирована концепция, согласно которой повреждение почек и/или снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2 в течение 3 месяцев и более определена как ХБП [13]. Признаки повреждения почек и/или снижение СКФ выявляют как минимум у каждого десятого человека. При этом сопоставимые цифры были получены как в индустриальных странах с высоким уровнем жизни, так и в развивающихся со средним и низким доходами населения [11]. Согласно данным ВОЗ, осложнения ХБП входят в двадцатку лидирующих причин смертности в мире [19].
Крупных исследований, позволяющих оценить распространенность ХБП в Российской Федерации (РФ), не проводилось [10]. Однако, по различным данным, признаки ХБП отмечаются более чем у 26% больных при наличии сердечно-сосудистых заболеваний. Чаще снижение функции почек наблюдается у лиц в возрасте старше 60 лет (36%), а у пациентов трудоспособного возраста – в 16% случаев [1, 3, 8]. Ежегодный рост терминальной стадии ХБП в РФ составляет более 50 больных на 1 млн населения, а распространенность достигает 250 больных на 1 млн [17].
Лечение пациентов с ХБП, как правило, сводится к проведению заместительной почечной терапии – диализу и трансплантации почки, жизненно необходимой пациентам с терминальной почечной недостаточностью, развивающейся в исходе нефропатий различной этиологии [11].
В последнее время число больных, впервые начавших лечение диализом, увеличилось по сравнению с предыдущими годами и составило 7376 человек, что соответствует 51,3 больного на 1 млн населения. Из них 6713 (91%) человек начали лечение программным гемодиализом и 663 (9%) – перитонеальным диализом [2]. Проведение заместительной почечной терапии требует высоких материальных затрат: по ориентировочным оценкам, во всем мире на проведение программы диализа ежегодно тратится более 75 млрд долл. [1, 9, 15, 22, 24].
В то же время в конце ХХ в. развитие медицины и фармакологии заложило основы для разработки новых высокоэффективных и доступных методов профилактики, позволяющих существенно замедлять прогрессирование ХБП, отсрочивать ввод в диализ, снижать риск развития осложнений и затраты на их лечение, а также оказывать помощь инкурабельным больным, которым противопоказаны активные методы терапии [11].

ХБП, особенно на поздних стадиях, характеризуется накоплением таких веществ, как электролиты, гормоны и токсины (низкомолекулярные водорастворимые, среднемолекулярные и белок-связывающие). В последнее годы активно изучаются белок-связывающие уремические токсины индол и р-крезол, обладающие провоспалительным действием и повышающие риск развития сердечно-сосудистых осложнений, предшественники которых образуются в желудочно-кишечном тракте (ЖКТ) в процессе ферментации белков кишечной микрофлорой [21]. Сегодня четко установлено, что детоксикация организма через ЖКТ возможна тремя путями: кишечным диализом, приемом внутрь сорбентов (пероральные сорбенты и энтеросорбенты) и бактериальными ферментами, усиливающими переработку азотистых соединений [7].
Одним из методов коррекции уремии у пациентов с ХБП на додиализном этапе является использование энтеросорбентов, связывающих конечные токсические продукты микробного метаболизма в ЖКТ и как следствие – способствующих снижению их уровня в крови [21]. Однако по сей день вопрос о применении энтеросорбентов остается дискутабельным, хотя в экспериментах неоднократно была обоснована и клинически подтверждена целесообразность их применения в качестве неспецифических компонентов комплексного лечения почечной недостаточности [7].
За рубежом чаще используются сорбенты AST-120 и севеламер, состоящие из углерода (диаметр частиц – 0,2–0,4 мм), способные связывать различные вещества, в т.ч. индола cульфат, р-крезола сульфат [14, 16, 18, 20].
В России и странах СНГ одним из наиболее широко применяемых энтеросорбентов является Энтеросгель, созданный на основе гидрогеля метилкремниевой кислоты, обладающий высокой сорбционной активностью и избирательностью по отношению к среднемолекулярным токсическим метаболитам в организме [5, 7].
Энтеросгель при применении внутрь оказывает детоксицирующее действие, адсорбируя при прохождении через ЖКТ токсические вещества и продукты незавершенного метаболизма, предотвращая их всасывание. Важно отметить, что Энтеросгель не уменьшает всасывание витаминов и микроэлементов. Благодаря высокой гидрофобности он не проникает во внутреннюю среду организма через кишечный барьер и через 7 часов выводится из ЖКТ вместе с поглощенными им токсическими веществами, не влияя при этом на двигательную функцию кишечника [7]. Высокая биосовместимость Энтеросгеля позволяет применять его в отличие от других сорбентов долго – в течение нескольких месяцев. Возможность длительного приема делает препарат незаменимым детоксикантом для больных ХБП, поскольку включение его в комплексную терапию эффективно купирует не только интоксикационный синдром, но и другие проявления болезни – абдоминальный, дизурический [4, 6, 7, 23].
В экспериментах, проведенных T. Sanaka и соавт. в лабораторных условиях, Энтеросгель проявлял небольшую поглотительную емкость по отношению к уремическим метаболитам (мочевина, креатинин, мочевая кислота), а также слабо разобщал комплекс белок-связанных уремических токсинов. Однако работа М.О. Колесник и соавт., посвященная клиническому применению Энтеросгеля больными ХБП II–III стадий в дозе 90 г/сут в течение 3 месяцев, демонстрирует существенное снижение уровня азотемии у 35% пациентов, а еще у 30% предупреждалось ее нарастание [5].
В исследовании О.И. Осадчей и соавт. было доказано, что развитие пиелонефрита у детей связано с формированием вторичного иммунодефицитного состояния, развивающегося вследствие накопления токсинов бактериального происхождения. Включение Энтеросгеля в схему комплексного лечения привело к значительному уменьшению концентрации токсинов средних и малых размеров в плазме крови, что способствовало снижению токсической нагрузки на фагоцитирующие и иммунокомпетентные клетки, а также сохранению иммунологической реактивности на субкомпенсаторном уровне и снижению аутосенсибилизации данной категории больных [12].
В работе М.Ф. Валентис и соавт. показано, что назначение Энтеросгеля больным ХБП в течение 6 месяцев и более уже через 4 дня после начала терапии способствовало улучшению общего состояния, уменьшению выраженности азотемии и метаболического ацидоза, а также дало возможность увеличить суточное потребление белка.
Экспериментальные и клинические результаты работы В.Г. Николаева и соавт. продемонстрировали возможности Энтеросгеля в профилактике и лечении заболеваний ЖКТ. Так, десятидневный его прием клинически здоровыми лицами без патологии почек приводил к позитивным изменениям состава кишечной микрофлоры за счет увеличения титров бифидобактерий и лактобацилл при снижении количества условно-патогенных организмов, что создавало комфортные условия для регенерации эпителия слизистой оболочки и приводило к более полному восстановлению поврежденного эпителия [5].
В нашем исследовании, проведенном на базе кафедры внутренних болезней и нефрологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова под руководством проф. В.Г. Радченко, изучалась клиническая эффективность и безопасность Энтеросгеля для пациентов с ХБП на додиализном этапе.
Материалы и методы. В исследовании приняли участие 30 больных ХБП, 13 мужчин и 17 женщин, средний возраст которых составил 36±3,7 года. Критериями включения пациентов в исследование были наличие верифицированной ХБП, отсутствие диализа, возраст 18 лет и старше; подписание формы информированного согласия.
Критерии исключения: беременность или кормление грудью; невозможность или нежелание дать информированное согласие на участие в исследовании или на выполнение требований исследования; прием любых других препаратов, обладающих сорбционными свойствами в течение 14 дней до получения первой дозы исследуемого препарата; клинически значимые отклонения лабораторных параметров, указывающих на наличие неизвестного заболевания или требующих дополнительного клинического обследования (по оценке исследователя); признаки острых воспалительных заболеваний; наличие значимых аллергических реакций в анамнезе; наличие тяжелых клинически значимых неврологических, сердечно-сосудистых, желудочно-кишечных, печеночных, иммунных и прочих заболеваний в анамнезе; психические заболевания, в том числе ранее перенесенные, которые, по мнению исследователя, делают неприемлемым участие пациента в исследовании; наркомания в течение года до включения в исследование; тяжелые судорожные расстройства в анамнезе; пациенты, склонные к отказу от исследования и выполнения предписаний врача; участие в других клинических испытаниях.
В зависимости от терапии пациенты были разделены на 2 группы по 15 человек: 1-я группа получала Энтеросгель внутрь по 1 дозе 3 раза в день за 60 минут до еды 4 недели, 2-я группа получала стандартную терапию ХБП без сорбентов. Все 30 пациентов благополучно завершили участие в исследовании. В процессе проведения исследования исключений из наблюдения пациентов не было.
Для оценки эффективности и безо-пасности применения Энтеросгеля использовались расспрос пациентов, клинический анализ крови, биохимический анализ крови, общий анализ мочи, опросник SF-36, шкала Спилбергера–Ханина, шкала астенического состояния.
Расспрос пациентов был стандартизирован с акцентом на нефрологические жалобы.
Клинический анализ крови проводился с определением гемоглобина, содержания эритроцитов, лейкоцитов, лейкоцитарной формулы, тромбоцитов, цветового показателя. Исследование выполнялось по общепринятым методикам. Биохимический анализ крови проводился с оценкой общего белка, мочевины, креатинина, калия (К), магния (Mg), натрия (Na), кальция (Ca), железа (Fe), фосфора (P), холестерина, глюкозы, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), общего билирубина. Результаты оценивали на приборе «Спектрум» фирмы «Abbot» и аппарате «Technicon». Уровень билирубина определяли по методу Илька с применением уксусного ангидрида. Содержание глюкозы крови оценивали с помощью глюкозооксидазного метода по окислению фенолфталеина. Концентрацию электролитов (К, Mg, Na, Ca, P) и железа в плазме изучали методом фотометрии пламени. Уровень общего белка сыворотки крови оценивался унифицированным методом по биуретовой реакции.
Качество жизни пациента оценивалось с помощью опросника SF-36 по следующим показателям: физическое функционирование, ролевое функционирование, обусловленное физическим и эмоциональным состоянием, интенсивность боли, общее состояние здоровья, жизненная активность, социальное функционирование, психическое здоровье.
Физическое функционирование (Physical Functioning – PF), отражающее степень, в которой физическое состояние ограничивает выполнение физических нагрузок (самообслуживание, ходьба, подъем по лестнице, переноска тяжестей и т.п.). Низкие показатели по этой шкале свидетельствуют о том, что физическая активность пациента значительно ограничивается состоянием его здоровья.
Ролевое функционирование, обусловленное физическим состоянием (Role-Physical Functioning – RP), – влияние физического состояния на повседневную ролевую деятельность (работу, выполнение повседневных обязанностей). Низкие показатели по этой шкале свидетельствуют о том, что повседневная деятельность значительно ограничена физическим состоянием пациента.
Интенсивность боли (Bodily pain– BP) и ее влияние на способность заниматься повседневной деятельностью, включая работу по дому и вне дома. Низкие показатели по этой шкале свидетельствуют о том, что боль значительно ограничивает активность пациента.
Общее состояние здоровья (General Health – GH) – оценка больным своего состояния здоровья в настоящий момент и перспектив лечения. Чем ниже балл по этой шкале, тем ниже оценка состояния здоровья.
Жизненная активность (Vitality – VT) подразумевает ощущение себя полным сил и энергии или, напротив, обессиленным. Низкие баллы свидетельствуют об утомлении пациента, снижении жизненной активности.
Социальное функционирование (Social Functioning – SF) определяется степенью, в которой физическое или эмоциональное состояние ограничивает социальную активность (общение). Низкие баллы свидетельствуют о значительном ограничении социальных контактов, снижении уровня общения в связи с ухудшением физического и эмоционального состояния.
Ролевое функционирование, обусловленное эмоциональным состоянием (Role-Emotional – RE), предполагает оценку степени, в которой эмоциональное состояние мешает выполнению работы или другой повседневной деятельности (включая большие затраты времени, уменьшение объема работы, снижение ее качества и т.п.). Низкие показатели по этой шкале интерпретируются как ограничение в выполнении повседневной работы, обусловленное ухудшением эмоционального состояния.
Психическое здоровье (Mental Health – MH) характеризует настроение наличие депрессии, тревоги, общий показатель положительных эмоций. Низкие показатели свидетельствуют о наличии депрессивных, тревожных переживаний, психическом неблагополучии.
Оценка уровня ситуационной и личностной тревожности выполнена с помощью шкалы Спилбергера-Ханина.
Оценка выраженности астении проводилась с помощью шкалы астенического состояния (ШАС).
Статистическая обработка данных проводилась с помощью программы «SPSS Statistics 17.0» (компания «SPSS Inc.», США). Перед началом статистического сравнения проводилась проверка изучаемых показателей на соответствие нормальному распределению. В связи с обнаружением выраженных отклонений анализируемых данных от нормального распределения использование параметрических методов обработки данных было признано некорректным и исключено из методов статистического анализа результатов данного исследования. Таким образом, для статистического анализа были использованы методы непараметрической статистики. Алгоритм статистического сравнения основной группы (группа 1) и контрольной группы (группа 2) пациентов был следующим: расчет изменения параметра в результате проведенного лечения (динамики значения параметра) в основной группе и в контрольной группе; оценка статистической значимости различий между динамикой значения параметра в основной группе и динамикой значения параметра в контрольной группе с помощью критерия Манна–Уитни (критерий для непарных выборок).
Для более подробной оценки влияния проводимого лечения на динамику показателей внутри каждой из групп использовался непарный критерий Вилкоксона. Различия между показателями расценивались как статистически значимые и достоверные, если значение p составляло менее 0,05.
Оценка эффективности лечения Энтеросгелем проводилась по следующим показателям: по быстроте исчезновения субъективных клинических симптомов, динамике показателей качества жизни. Оценку безопасности исследуемого препарата проводили посредством мониторирования субъективного состояния пациентов в течение периода наблюдении и согласно динамике физикальных данных, клинических и биохимических показателей крови, динамике анализов мочи.
Результаты исследования и обсуждение. Основными жалобами пациентов всех групп были на слабость, повышенную утомляемость, боли в животе, поясничной области и голове, тошноту, периодическую рвоту, дизурические явления (табл. 1).
При объективном обследовании у всех находившихся под наблюдением пациентов манифестация заболевания сопровождалась клиническими признаками интоксикации, которые выражались слабостью, тошнотой, гипертермией, болями в животе и пояснице, тошнотой, периодической рвотой и головными болями. На фоне проводимой терапии пациенты первой группы, получавшие Энтеросгель, отмечали улучшение состояния по всем показателям в отличие от пациентов 2-й группы (табл. 1). У всех пациентов, находившихся под наблюдением, в течение 28 дней не отмечено значимых физикальных изменений со стороны жизненно важных органов и систем. Отмечалась стабильность артериального давления, частоты сердечных сокращений, частоты дыханий.
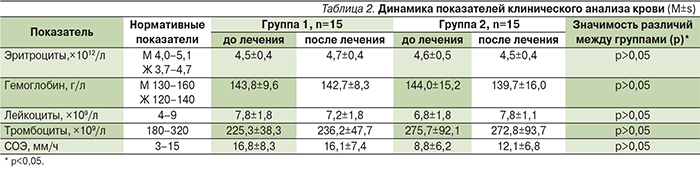
Как видно из представленных данных (табл. 2), у всех пациентов обеих групп значимой динамики показателей клинического анализа крови до и после проводимой терапии обнаружено не было. Статистически значимых различий между группами не выявлено.
На фоне проводимой терапии у пациентов 1-й группы была отмечена нормализация показателей фильтрационной функции почек: за счет снижения уровня общего белка, мочевины, креатинина и повышения СКФ. Остальные значения показателей (АЛТ, АСТ, глюкоза, холестерин, билирубин, К, Mg, Na, Са, Fe, Р), в т.ч. витаминов А, Е, D, как до, так и после лечения находились в пределах допустимых (табл. 3). Отсутствие изменений биохимических показателей крови, характеризующих функцию печени, свидетельствует о безопасности Энтеросгеля, при использовании которого в стандартных дозах токсического воздействия на основные системы организма получено не было.
По результатам исследования мочи у пациентов всех групп наблюдалось снижение удельного веса мочи и, напротив, увеличение таких показателей, как лейкоциты, бактерии, белок. На фоне проводимой терапии в группе, получавшей Энтеросгель, регистрировалась положительная динамика по всем показателям (табл. 4).
Полученные данные могут являться подтверждением улучшения состояния функции почек и как следствие – анализов мочи.
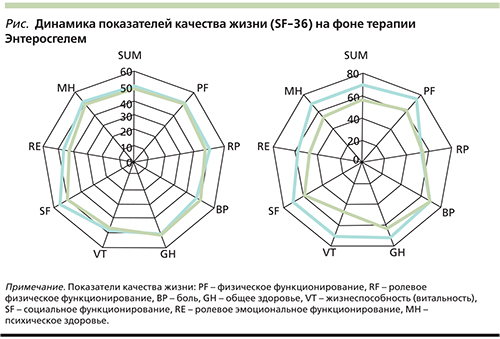
При оценке качества жизни с помощью опросника SF-36 до лечения у всех (100%) пациентов отмечалось снижение показателей, характеризующих физический и психологический компоненты здоровья.
После проведенного лечения выявлено достоверное (р<0,05) улучшение показателей, характеризующих физический компонент здоровья: повышение уровня физического функционирования (PF), снижение интенсивности болевого синдрома (BP), жизненной активности VT, социальное функционирование SF и психическое здоровье MH, за счет изменения которых отмечено повышение уровня ролевого функционирования, обусловленного физическим состоянием (RP), и соответственно, повышение уровня общего состояния здоровья (GH) (см. рисунок).
До начала лечения у всех пациентов была выявлена ситуационная тревожность: у 22 (73,3%) – умеренная ситуационная тревожность, у оставшихся 8 (26,7%) пациентов – высокая ситуационная тревожность. После курса лечения каких-либо изменений по результатам тестирования обнаружено не было.
До начала лечения личностная тревожность отсутствовала у 4 (13,3%) пациентов, у 26 (86,7%) пациентов была выявлена высокая личностная тревожность. После курса лечения изменений также обнаружено не было.
По результатам применения опросника астения легкой степени обнаружена у четырех пациентов 1-й группы, включенных в исследование, после окончания лечения – только у одного. У остальных пациентов астеническое состояние диагностировано не было.
Полученные данные подтверждают тесную взаимосвязь патологии почек и психоэмоционального статуса пациентов и улучшении данных показателей при стабилизации клинической картины заболевания.
В процессе наблюдения и по результатам лабораторных методов исследования нежелательных явлений и серьезных нежелательных явлений у пациентов, находившихся под наблюдением, зарегистрировано не было. Все пациенты, получавшие курс терапии с Энтеросгелем, по окончании лечения отметили хорошую переносимость и очевидный положительный эффект на клинические симптомы заболевания.
Результаты проведенного исследования свидетельствуют об эффективности Энтеросгеля, назначаемого внутрь по 1 дозе 3 раза в день за 60 минут до еды в течении 4 недель при лечении больных ХБП, находящихся на додиализном этапе, т.к. способствовало положительному клиническому эффекту у всех наблюдаемых пациентов.
На фоне проведенного лечения Энтеросгелем у находившихся под наблюдением пациентов был купирован болевой синдром в животе и пояснице, у большинства наблюдаемых пациентов исчезли явления астении, эндоинтоксикации и дизурические проявления. Также отмечалось улучшение психоэмоционального состояния и тенденция к улучшению показателей качества жизни. Прием Энтеросгеля в течение четырех последовательных недель безопасен для пациентов, что подтверждается данными субъективных, физикальных и лабораторных исследований. Энтеросгель при использовании в течение четырех недель не вызывает нежелательных явлений. Энтеросгель может быть использован в комплексной терапии больных ХБП, находящихся на додиализном этапе.
Выводы. Энтеросгель оказывает положительное влияние на клиническую картину заболевания у пациентов с ХБП, находящихся на додиализном этапе, обладает сорбционным действием, что способствует уменьшению эндоинтоксикации и улучшению функции почек, при его использовании улучшаются показатели качества жизни, психоэмоционального состояния, имеет хорошую переносимость, безопасен, улучшает функциональное состояние почек и может быть рекомендован в составе комплексной терапии больным ХБП, находящимся на додиализном этапе, в количестве по 1 дозе 3 раза в день за 60 минут до еды в течении 4 недель.
Энтеросорбенты – одно из высокоэффективных и доступных средств профилактики, позволяющее существенно замедлять прогрессирование ХБП, отсрочивать ввод в диализ, снижать риск развития осложнений и затраты на их лечение, а также оказывать помощь инкурабельным больным, которым противопоказаны активные методы терапии.



