Введение
Гипертриглицеридемия (ГТГ), включая хиломикронемию, является этиологическим фактором (от 1 до 12%) острого панкреатита (ОП) [1], занимая третье место после его билиарной и алкогольной этиологии [2]. По данным многоцентрового ретроспективного исследования отмечено увеличение распространенности гипертриглицеридемического ОП за последние 20 лет [3, 4]. По сравнению с ОП, связанным с этиологическими факторами, такими как алкоголизм и билиарная патология, развитие ОП на фоне ГТГ характеризуется формированием большего количества осложнений и более высоким уровнем смертности [5]. Кроме того, чаще развивается деструктивный ОП [6].
Гипертриглицеридемический ОП часто протекает с развитием тяжелых осложнений, формированием обширных очагов панкреонекроза, а также полиорганной недостаточности [7, 8].
Согласно американским и европейским рекомендациям, риск развития ОП увеличивается при уровне триглициридов (ТГ) более 10 ммоль/л [9-11], а инициация профилактической гиполипидемической терапии рекомендуется при уровне ТГ более 5,65 ммоль/л [12]. Шведское проспективное когортное исследование [13] с участием 33 346 человек и шотландское исследование [14], включившее 67 269 человек, показали, что риск развития ОП увеличивается в 1,5 раза при уровне ТГ более 1,6-1,7 ммоль/л.
В развитии гипертриглицеридемического панкреатита (ГТГП) большое значение имеют метаболические (сахарный диабет, ожирение), гормональные (гипотиреоз), генетические, алиментарные (употребление жирной пищи, алкоголя) факторы [15-19]. Несмотря на то что основным источником ТГ является пища, наиболее частой причиной ГТГ служит нарушение регуляции эндогенной продукции липопротеидов очень низкой плотности (ЛПОНП), богатых ТГ. Это может вызывать либо повышение только ЛПОНП при гиперлипидемии IV типа, либо ЛПОНП и хиломикронов при гиперлипидемии V типа. Эндогенная ГТГ, как правило, связана с гиперинсулинемией и инсулинорезистентностью, чаще всего вызванной ожирением, приемом жирной пищи и/или алкоголя, а также применением определенных лекарств (экзогенные эстрогены, тамоксифен, ретиноиды, тиазиды, хлорталидон, в-адреноблокаторы (неселективные и кардиоселективные), ингибиторы протеаз (особенно ритонавир), инфузии пропофола) [20].
Особенностью патогенеза ГТГП является развитие ишемии и ацидоза ткани поджелудочной железы в результате повреждения сосудистого эпителия большим количеством свободных жирных кислот, мицелярными структурами, а также эмболизации капилляров из-за повышенной вязкости плазмы. Ишемия и ацидоз поджелудочной железы приводят к внутрипротоковой активации трипсиногена [21].
В результате рецидивирующего течения панкреатита разрушается паренхима поджелудочной железы с развитием фиброза, с течением времени приводящая к экзокринной и эндокринной недостаточности поджелудочной железы [22].
В лечении ГТГП помимо общепринятых методов (инфузионная дезинтоксикационная, симптоматическая терапия) [23-25] необходимо проведение мероприятий, направленных на снижение уровня ТГ в сыворотке [26]. В настоящее время нет установленных руководств по лечению ГТГП, хотя различные методы лечения, такие как терапия инсулином, гепарином, антигиперлипидемическими препаратами, включая фиброевые кислоты и омега-3 жирную кислоту, проведение сеансов плазмафереза, были успешно применены для снижения уровня ТГ в сыворотке у пациентов с ГТГ [27, 28].
Для успешного лечения необходимы соблюдение диеты, исключение употребления алкоголя, снижение массы тела, прекращение приема лекарств, способствующих ГТГ, медикаментозный контроль сахарного диабета и гипотиреоза [29, 30]. Два мета-анализа показали значительную корреляцию между снижением массы тела и уровнем ТГ в плазме [31, 32]
Для снижения и поддержания уровня ТГ в референсных значениях необходимо проведение патогенетической терапии, направленной на уменьшение выработки ЛПОНП и предотвращение развития тяжелой ГТГ. Производные фибриновой кислоты или фибраты (гемфиброзил, фенофибрат, клофибрат) представляют собой класс препаратов, которые снижают уровень ТГ в плазме и одновременно повышают уровень липопротеидов высокой плотности. Это препараты первого ряда для лечения первичной ГТГ [20]. Производные фибриновой кислоты действуют через различные механизмы, снижая уровни ТГ. Фибраты снижают синтез ТГ в печени, индуцируя поглощение жирных кислот в печени, увеличивают элиминацию частиц ЛПНП, уменьшают обмен нейтральных липидов между ЛПОНП и ЛПВП, а также стимулируют обратный транспорт холестерина [33].
Другой группой препаратов, которые используются для лечения ГТГП, являются статины, тормозящие синтез холестерина. К доступным в настоящее время статинам относятся аторвастатин, симвастатин, правастатин, ловастатин и флувастатин. Мета-анализ рандомизированных контролируемых исследований показал, что использование статинов способствует снижению риска ОП у пациентов с нормальным или несколько повышенным уровнем ТГ [34]. Кроме того, для достижения дополнительного синергетического эффекта наиболее эффективно комбинированное использование фибратов и статинов [35].
Клиническое наблюдение
Представляем клиническое наблюдение случая рецидивирующего панкреатита на фоне ГТГ. Наблюдение демонстрирует влияние метаболических нарушений на тяжесть течения ОП, а также необходимость тщательного изучения анамнеза заболевания и комплексного обследования пациента.
Пациент 30 лет в августе 2019 г. был госпитализирован в отделение патологии поджелудочной железы и желчевыводящих путей Московского клинического научно-практического центра (МКНЦ) им. А.С. Логинова с жалобами на периодические интенсивные боли в левом подреберье, появляющиеся на фоне погрешности в диете (в частности, после употребления жирной пищи), а также на периодические боли в области первого пястно-фалангового сустава правой стопы, усиливающиеся при ходьбе.
Из анамнеза известно, что пациент с юношеского возраста имел избыточную массу тела (ИМТ 29,4 кг/м2). С 2013 г. пациента беспокоят интенсивные боли в верхних отделах живота, рвота после приема жирной пищи. Неоднократно получал стационарное лечение. При обследовании по результатам инструментальных исследований (УЗИ, МСКТ брюшной полости) определялись признаки острого панкреатита, однако показатели амилазы крови и мочи были в пределах референсных значений. В мае 2019 г. появились интенсивные боли в верхних отделах живота после употребления жареной пищи. Бригадой СМП госпитализирован в стационар. По данным УЗИ, мультиспиральной компьютерной томографмм, отмечены признаки панкреонекроза, постнекротических кист хвоста поджелудочной железы. Лабораторно выявлена гипертриглицеридемия 9,08 ммоль/л, гипергликемия до 9 ммоль/л, повышение диастазы мочи до 20 тыс. ЕД/л. После проведенной консервативной терапии болевой синдром купирован. Амбулаторно выполнена лабораторная диагностика экзо- и эндокринной функций поджелудочной железы: анализ крови на инсулин — 22,2 мкЕД/мл (референсные значения — 2,6-22,9), С-пептид - 4,28 нг/мл (референсные значения - 1,10-4,4), анализ кала на панкреатическую эластазу - 500 мкг/г (референсные значения более 200). Также стоит отметить, что у пациента имелся отягощенный наследственный анамнез: у отца атеросклероз коронарных артерий, сахарный диабет 2 типа, подагра.
При объективном осмотре пациент удовлетворительного питания, ИМТ - 24,9 кг/м2 на момент госпитализации в МКНЦ им. А.С. Логинова. Отмечалась болезненность при пальпации в эпигастрии и левом подреберье. По другим органам и системам без особенностей.
В биохимическом анализе крови выявлена ГТГ до 12,66 ммоль/л (в норме до 1,70 ммоль/л), гиперхолестеринемия 6,03 ммоль/л, при этом показатели ЛПВП и ЛПНП были в пределах референсных значений, также отмечено повышение уровня мочевой кислоты до 571,6 мкмоль/л (табл. 1). По данным УЗИ визуализированы постнекротические кисты в проекции сальниковой сумки, экстрапанкреатические скопления жидкости забрюшинно и инфильтративные изменения парапанкреатической клетчатки, выраженный билиарный сладж в желчном пузыре. При МСКТ брюшной полости с внутривенным контрастированием - состояние после панкреонекроза, картина формирующихся постнекротических кист поджелудочной железы (в области головки 50^56 и 68*43 мм, на уровне хвоста 36*33 мм), при сравнении с МСКТ отмечено уменьшение их размеров, признаки гепатомегалии, спленомегалии, холецистита (рис. 1а, б). По результатам ЭГДС - недостаточность кардии, поверхностный гастрит; данных за эрозивно-язвенные изменения верхних отделов желудочно-кишечного тракта не получено.
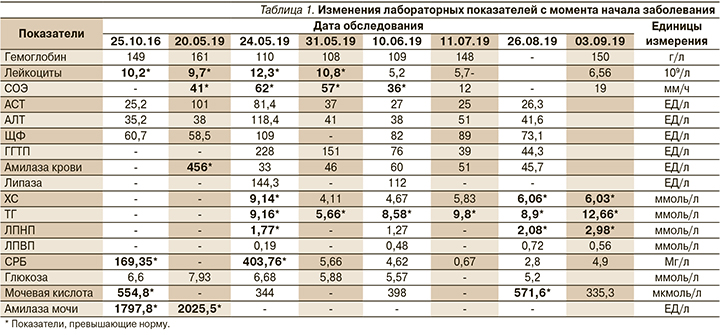
Принимая во внимание результаты УЗИ и МСКТ, по данным которых отмечена положительная динамика в виде уменьшения размеров постнекротических кист поджелудочной железы и инфильтрации парапанкреатической клетчатки, отсутствие скоплений свободной жидкости, проведение хирургического лечения на тот момент не было показано, продолжена консервативная терапия.
Помимо абдоминальных болей пациента беспокоили боли в пястно-фаланговом суставе первого пальца стопы при ходьбе. Из анамнеза также известно, что неоднократно отмечалось повышение уровня мочевой кислоты и имеется отягощенный наследственный анамнез — отец страдает подагрой. Связь повышения уровня мочевой кислоты с характерным воспалением I пястно-фалангового сустава стопы позволила установить диагноз «подагра, подагрический артрит»; к лечению добавлен аллопуринол и нестероидные противовоспалительные препараты (НПВП).
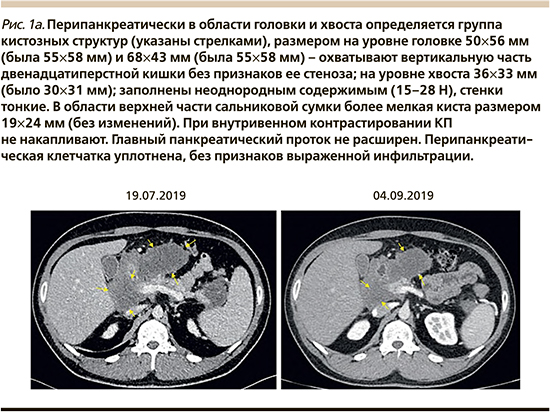

В связи с выявленным повышением уровней холестерина и триглицеридов и с учетом наследственного анамнеза диагностирована наследственная гипертриглицеридемия 4-го типа, назначена терапия фибратами (фенофибрат 145 мг 1 раз в день) и статинами (розувастатин 10 мг 1 раз в день).
Амбулаторно пациент продолжил прием ферментных препаратов, фибратов, статинов, аллопуринола и НПВП.
В феврале 2020 г. пациент был повторно госпитализирован в отделение патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова с целью динамического наблюдения. При поступлении активно жалоб не предъявлял, в течение полугода обострений панкреатита у пациента не отмечено. При обследовании в биохимическом анализе крови отмечена нормализация уровней ТГ, холестерина и мочевой кислоты (табл. 2). По данным визуализации (УЗИ, МСКТ) отмечается уменьшение размеров постнекротических кист (в области головки 50*35 и 58*37 мм, на уровне хвоста 35*27 мм) по сравнению с описательной КТ-картиной от 03.09.2019 (рис. 2а, б), сохранялись УЗ-признаки билиарного сладжа. После выписки пациент начал принимать препараты урсодезоксихолевой кислоты в суточной дозе 1000 мг на ночь и продолжил ранее рекомендованную терапию (ферментные препараты, фибраты, статины, аллопуринол).
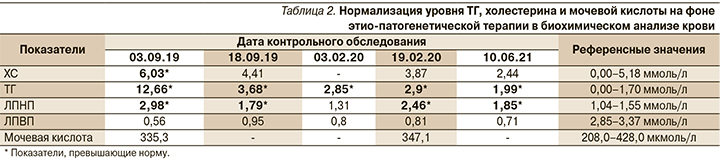
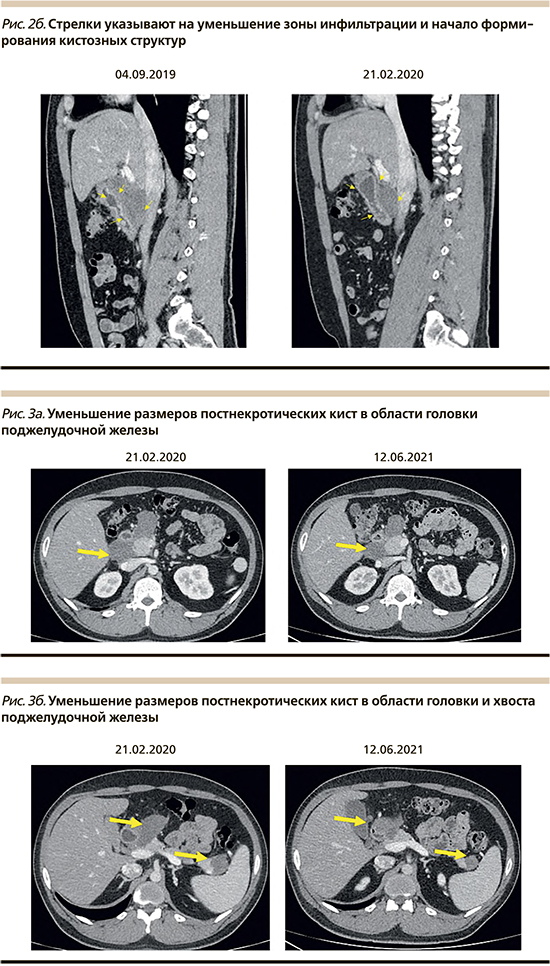
Очередная госпитализация пациента в МКНЦ им. А.С. Логинова в июне 2021 г. При поступлении активно жалоб не предъявлял, отметил снижение массы тела на 6 кг за 12 месяцев на фоне строгого соблюдения диеты. По данным лабораторно-инструментального обследования отмечена положительная динамика в виде стабилизации уровней ТГ и холестерина в референсных значениях (табл. 2), уменьшения выраженности билиарного сладжа в желчном пузыре при УЗИ, дальнейшее уменьшение размеров постнекротических кист в области головки — 44^27 и 46x31 мм (рис. 3а, б), на уровне хвоста - 26x22 мм (рис. 3б) по данным МСКТ.
Таким образом, у пациента диагностирован хронический панкреатит 1-й стадии средней степени тяжести 13 баллов по M-ANNHEIM, перенесенный панкреонекроз в 2013 и 2019 гг. с формированием постнекротических кист поджелудочной железы, который развился на фоне ГТГ 4-го типа, а также сопутствовавшая патология - подагра, подагрический артрит.
Обсуждение
ГТГ считается редкой причиной хронического панкреатита. Развитию тяжелых осложнений при ГТГП способствует высокий уровень ТГ. Наибольшую предрасположенность к развитию ГТГП имеют пациенты мужского пола, немаловажную роль играют ожирение, стеатоз печени и сахарный диабет [17-19]. В исследовании Cao et al. 90 пациентов с ГТГ ОП из 111 были мужского пола в возрасте до 45 лет и имели относительно высокий ИМТ [36]. ГТГ ОП чаще встречается у молодых мужчин, что может быть связано с нерациональным питанием, которое включает большое количество жиров, перееданием и чрезмерным употреблением алкоголя [37].
В представленном нами наблюдении молодой мужчина с юношеского возраста страдал ожирением, а также регулярно употреблял жирную пищу. Тяжесть течения ОП, лабораторно-инструментальная картина с каждым новым эпизодом обострения все больше усугублялись, и последний сопровождался лейкоцитозом и выраженной гиперамилазурией. При анализе лабораторных данных в динамике с 2016 по 2019 г. отмечено, что повышение маркеров воспаления, увеличение уровня амилазы в крови и моче были характерны для эпизодов ОП. Кроме того, данные эпизоды сопровождались изменением липидного спектра, в частности повышением уровня холестерина и ТГ. Трудность в постановке диагноза ГТГП данному пациенту заключалась в сочетании умеренной
гиперхолестеринемии с высоким уровнем ТГ и неизмененными показателями амилазы крови и мочи в период обострения. По данным литературы, несмотря на развивающийся ОП, уровни амилазы в сыворотке и моче могут быть в пределах нормальных значений у более чем 50% пациентов [38-40].
Следует заметить, что ГТГ служит независимым фактором риска гиперурикемии [41, 42], а отягощенный наследственный анамнез усугубляет развитие и тяжесть нарушений пуринового обмена. В связи с наличием коморбидной патологии и высоким риском развития тяжелых осложнений панкреатита необходим мультидисциплинарный подход к ведению больных ГТГП.
Лечение и профилактика обострений ГТГП заключаются в исключении влияния этиологического фактора, т.е. в соблюдении гипохолестериновой диеты и длительной/постоянной гиполипидемической терапии.
В представленном случае можно проследить положительную динамику на фоне соблюдения рекомендаций по питанию и медикаментозной терапии. Проведение этиопатогенетического лечения привело к улучшению самочувствия пациента, регрессу эпизодов обострения, нормализации показателей липидного профиля и мочевой кислоты.
Заключение
Таким образом, данный клинический случай демонстрирует сочетание влияния пищевых факторов и дислипидемии на развитие хронического панкреатита, а также важность комплексного подхода к лечению больных ГТГП.
Согласие пациента: отсутствует.


