Введение
Острые респираторные вирусные инфекции (ОРВИ) представляют наиболее распространенную форму острой патологии, в т.ч. 80–90% из всех регистрируемых в РФ инфекций. Как минимум 1 раз в год заболевание переносит каждый житель страны [1]. Этому способствует как разнообразие видового состава возбудителей (вирусы парагриппа, гриппа, адено-, рино-, энтеровирусы и т.д., всего известно более 200 таких возбудителей), так и генетическая лабильность и высокая контагиозность многих из них [1]. Одновременное коинфицирование несколькими возбудителями приводит к более тяжелому течению заболевания, трудностям в диагностике и терапии таких вариантов патологического процесса.
Для различных форм ОРВИ предусмотрены следующие коды в Международной классификации болезней 10-го пересмотра:
- J00. Острый назофарингит.
- J02. Острый фарингит.
- J04. Острый ларингит и трахеит.
- J04.0. Острый ларингит.
- J04.1. Острый трахеит.
- J04.2. Острый ларинготрахеит.
- J06. Острые инфекции дыхательных путей множественной и неуточненной локализации.
- J06.0. Острый ларинготрахеит.
- J06.9. Острая инфекция верхних дыхательных путей неуточненная.
Основу лечения ОРВИ составляет симптоматическая и элиминационная терапия, цель которой – разжижение секрета, удаление слизи, восстановление проходимости носовых ходов и дыхательных путей, в т.ч. с помощью деконгестантов (до 12 лет только топические).
К сожалению, возможности противовирусной терапии ОРВИ в настоящее время достаточно ограничены [2, 3].
В некоторых случаях не позднее 1–2-го дня болезни можно рассмотреть целесообразность назначения препаратов α-интерферонов (назальные формы, ректальные суппозитории) или интерфероногенов [4, 5]. Антибактериальные препараты, как правило, не показаны при неосложненных формах ОРВИ, отсутствии иммунокомпрометации и хронической патологии легких. Если заболевание имеет вирусную этиологию, антибиотики могут быть показаны только в случае наличия иммунодефицита с риском развития бактериального процесса, а также при хронической патологии легких. При доказанной роли бактериальной флоры могут быть использованы также топические формы антибактериальных препаратов [4].
Развитие инфекций рассматривается в неотрывной связи от состояния иммунной системы пациента [6, 7], а различные варианты иммунотропной терапии – в качестве патогенетического лечения при инфекционных заболеваниях дыхательных путей [6–9]. Заключение, сделанное экспертами Cochrane Collaboration, свидетельствует: использование иммуностимуляторов у часто болеющих детей на 40% снижает эпизоды респираторных инфекций [6, 7, 10].
Дискутабелен вопрос о целесообразности назначения при ОРВИ препаратов цинка, витамина D3, гомеопатических средств и т.д., относящихся к категории средств с недоказанной эффективностью (не является эквивалентом доказанной неэффективности) [11, 12], традиционно в лечении больных ОРВИ различного возраста используются растительные препараты.
Методы т.н. комплементарной медицины с позиций современной науки не имеют исчерпывающих объяснений механизма действия препаратов, однако повсеместное массовое их применение в последние годы требует проведения серьезных исследований с соблюдением методологии, принятой в клинических исследованиях аллопатических средств. Следует иметь в виду, что биологически активные молекулы растительного сырья традиционно используются в качестве предшественников известных лекарственных средств (кофеин, сердечные гликозиды, β-каротин и т.д.), что в целом привело к появлению термина «фитоцевтика». Кроме того, в некоторых случаях использование растительных препаратов целесообразнее с экологических позиций [13]. Вместе с тем следует также учитывать, что имеющиеся препараты изучены в различной степени, поэтому при описании группы препаратов следует избегать обобщенных характеристик.
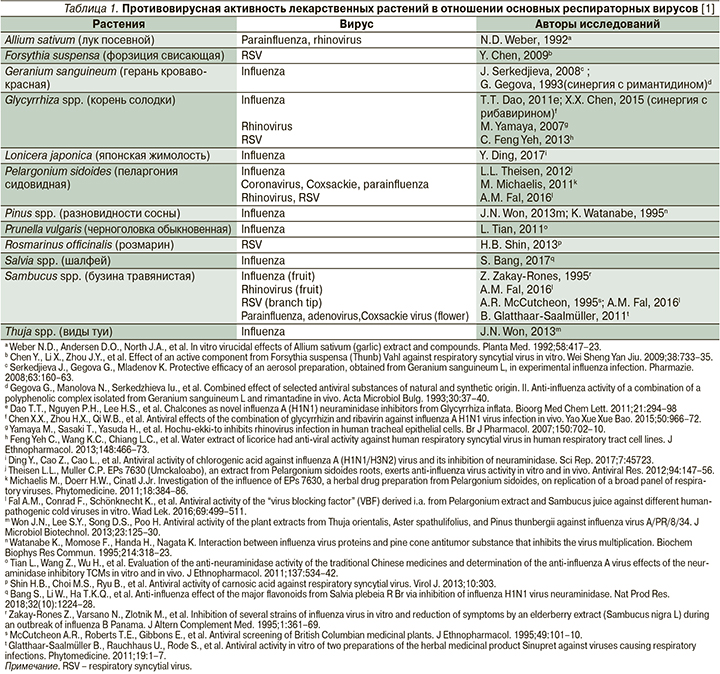
Возможность использования при лечении ОРВИ препаратов растительного происхождения диктуется помимо муколитических и отхаркивающих свойств наличием у некоторых из них способности вмешиваться в адсорбцию и репродуктивный цикл респираторных вирусов (табл. 1), а также противовоспалительными и иммунотропными свойствами (табл. 2). Последнее представляется особенно актуальным, поскольку именно иммунопатогенетические механизмы в значительной степени ответственны за развитие симптомов ОРВИ [1].

Наиболее изученные растительные препараты при ОРВИ – это препараты плодов пеларгонии сидовидной (Pelargonium sidoides), андрографиса метельчатого (Andrographis paniculata), бузины черной (Sambucus nigra); некоторым пациентам с профилактической целью могут также быть рекомендованы препараты женьшеня: Panax ginseng (Asian red ginseng), Panax quinquefolius (American ginseng), ромашки (Camellia sinensis), лука посевного (Allium sativum).
Пеларгония сидовидная (P. sidoides), препараты которой традиционно используются в лечении ОРВИ, принадлежит вместе с другими представителями к семейству Geraniaceae, однако в отличие от других растений, в частности Geranium sanguineum, обладает также противовирусной активностью (табл. 2) [1].
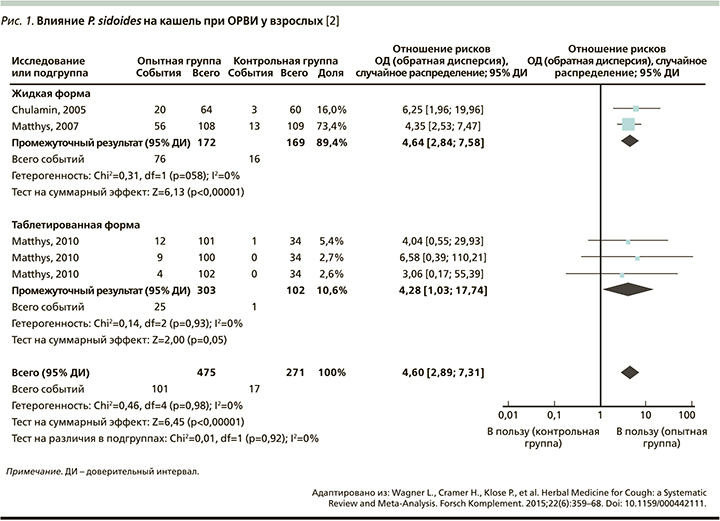
Перспективы изучения препаратов P. sidoides (Умкалор) при ОРВИ определяются разнонаправленным действием пеларгонии сидовидной на патогенез и симптомы заболевания. Как видно из сведений, представленных в табл. 1 и 2, препарат обладает одновременно неспецифической противовирусной активностью, что в условиях крайнего разнообразия этиологии ОРВИ представляется его несомненным достоинством, иммунотропным действием со стимуляцией механизмов врожденного и приобретенного иммунитета, а также секретомоторным действием. Систематический обзор и мета-анализ 11 исследований эффективности препаратов P. sidoides при ОРВИ продемонстрировали достоверный, хотя и умеренный, эффект в отношении улучшения симптомов заболевания [14].
Все исследования за исключением одного продемонстрировали улучшение симптомов ОРВИ, в т.ч. при оценке тяжести кашля, лихорадки, боли в горле, слабости, что сопровождалось улучшением качества жизни. Для оценки тяжести симптомов использовалась система BSS (Bronchitis Severity Score), включившая 5 симптомов, в т.ч. кашель. Качество жизни оценивалось с помощью опросников EQ-VAS (EuroQol Visual Analogue Scale), EQ-5D (EuroQol 5D), IMOS (Integrative Medicine Outcome Scale) и IMPSS (Integrative Medicine Patient Satisfaction Scale).
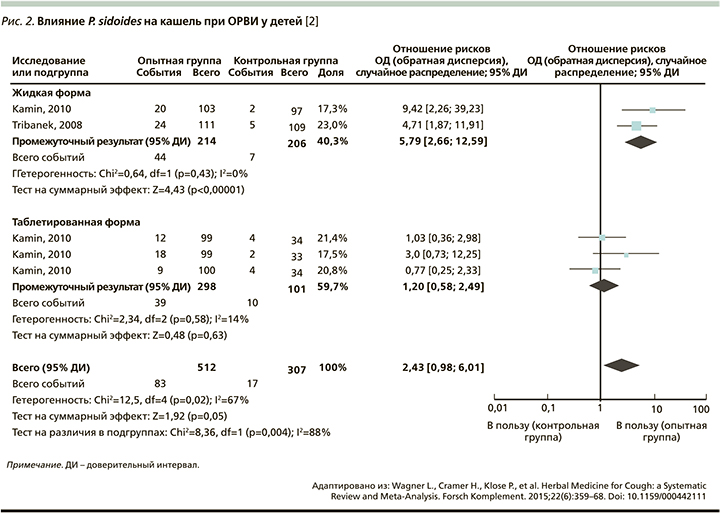
В целом результаты мета-анализа этих исследований демонстрируют умеренную эффективность препаратов P. sidoides (Умкалор) относительно группы контроля как для взрослых (относительный риск [ОР]=4,60, 95% доверительный интервал [ДИ]: 2,89–7,31; р=0,00001), так и для детей (ОР=2,43, 95% ДИ: 0,98–6,01; р=0.05). При этом, по данным W. Kamin [15], побочные эффекты встречались с одинаковой частотой как в основной группе, так и в группе сравнения. Достоверного улучшения относительно группы сравнения по шкале BSS в группе, получавшей P. sidoides, только в одном исследовании не было получено [16].
Кашель является одним из симптомов, в наибольшей степени ухудшающих качество жизни при респираторных инфекциях. Анализ данных 2871 пациента (в 7 исследований включались только взрослые пациенты, в 4 – дети и подростки 1–18 лет), получавших пероральные формы препарата в возрастной дозе [17–21]. На рис. 1, 2 приведены результаты мета-анализа исследований препаратов P. sidoides (Умкалор) на выраженность кашля.
Двойное слепое рандомизированное исследование, в ходе которого 40 взрослых и детей с подвержденным диагнозом «грипп В» получали сироп плодов бузины черной или плацебо показало сокращение продолжительности симптомов ОРВИ в основной группе на 1,3 дня [22]. Аналогичные результаты (сокращение тяжести и продолжительности симптомов при гриппе А и В) в двойном слепом плацебо-контролируемом рандомизированном исследовании, включившем 60 человек, показаны в исследовании Z. Zakay-Rones et al. [23]. Сокращение продолжительности и тяжести симптомов ОРВИ также продемонстрировано для 2-недельного профилактического курса препарата в рамках рандомизированного исследования E. Tiralongo в Австралии в 2016 г. [24].
Результаты систематического анализа данных об эффективности препаратов эхинацеи в настоящее время признаны недостаточными для рекомендации препаратов. Отчасти это обусловлено разнообразием видового состава (Echinacea angustifolia, Echinacea pallida, Echinacea purpurea), крайне различающимся дизайном исследований, большими различиями в изучаемых дозах (включая сверхмалые) [1].
Заключение
С учетом вышеизложенного и принимая во внимание наличие убедительной доказательной базы об эффективности и высоком профиле безопасности препарата Умкалор представляется возможным рекомендовать его в качестве базового средства для лечения ОРВИ у детей в возрасте 1 года и старше.



