Обоснование
Колоректальный рак (КРР) считается актуальной проблемой современной онкологии. Заболеваемость раком ободочной кишки (РОК) с каждым годом растет как в нашей стране, так и в мире. За последние 10 лет в Российской Федерации численность контингента больных РОК на 10 тыс. населения в структуре онкологической заболеваемости выросла с 102,3 до 157,7 [1]. При оценке выявленных стадий все чаще стали диагностироваться ранние стадии РОК. Вероятнее всего, это связано с внедрением раннего скрининга КРР. Так, в 2009 г. на I–II стадиях выявлены 38,6% пациентов, в 2019 г. – 50%. Таким образом, все чаще пациентам стала назначаться адъювантная химиотерапия (АХТ). По имеющимся в настоящий момент стандартам, АХТ проводится всем пациентам с IIВ-, IIС- и III-стадиями РОК. Спорным остается вопрос при IIА-стадии РОК, т.к. при назначении АХТ у данной группы пациентов оцениваются прогностические факторы, не специфичные и не универсальные для всех пациентов с РОК. Так, сейчас клиницисты пользуются следующими известными прогностическими факторами: низкая степень дифференцировки, наличие лимфоваскулярной/периневральной инвазии, R+, операция в условиях кишечной непроходимости / перитонита, операция с неадекватным объемом лимфодиссекции – изучено менее 12 лимфоузлов, РЭА (раковый эмбриональный антиген) >2,35 нг/мл после операции. Отдельно рассматриваются пациенты с микросателлитной нестабильностью (MSI-H), т.к. течение заболевания у таких пациентов крайне благоприятно и не требует назначения АХТ [2]. Однако, несмотря на выявление ранних стадий заболевания, проведение комплексного лечения, часть пациентов быстро прогрессируют – в течение первых 2–3 лет, а некоторые находятся в длительной ремиссии. Данное наблюдение заставляет задуматься над тем, что известных в настоящий момент прогностических факторов недостаточно и, вероятнее всего, есть еще неизученные факторы, которые могут помочь нам в выборе тактики лечения пациентов с РОК. Так, известными предикторами течения заболевания при метастатическом КРР в настоящий момент являются мутации в генах RAS [4, 5], индекс пролиферации опухоли Ki-67 [3].
Но все чаще поиск дополнительных маркеров основывается на биологии опухолевого роста и изучении основных веществ, которые принимают непосредственное участие в метастазировании опухоли. Так, после выпуска в 2011 г. Д. Ханаханом и Р. Вайнбергом продолжения своей «исторической» статьи, в которой список обязательных характеристик опухолевых клеток пополнился новыми пунктами: адаптацией стромальных компонентов к потребностям опухолевого роста, воспалением (активацией провоспалительных генов и провоспалительных цитокинов) и ускользанием от иммунного надзора, особое внимание уделено цитокинам, а именно их подклассу – хемокинам [6], впервые изученным в 1977 г. [7].
Основным механизмом действия хемокинов является индуцирование хемотаксиса ряда клеток, также они участвуют в межклеточных взаимодействиях в иммунологическом ответе.
В настоящее время хемокины представлены в основном четырьмя большими семействами: СХС(а), СС(в), С(у) и СХ3С (8). Хемокины каждого из них взаимодействуют со своими поверхностными рецепторами – CXCR, CCR, CR, CX3CR [8]. Хемокиновый рецептор CXCR4 экспрессируется многими опухолями, ассоциируется с резким усилением ангиогенеза и более агрессивным течением опухолевого процесса [9, 10].
В нашем исследовании мы решили наряду с имеющимися факторами прогноза оценить влияние индекса пролиферации Ki-67, KRAS мутации и экспрессии хемокиновых рецепторов на безрецидивную выживаемость (БРВ) пациентов с РОК после радикального лечения и, таким образом, постараться выявить новые прогностические факторы, что крайне актуально в настоящее время.
Цель исследования: оптимизация адъювантного противоопухолевого лечения и увеличение БРВ у больных РОК путем анализа их клинико-морфологических характеристик.
Методы
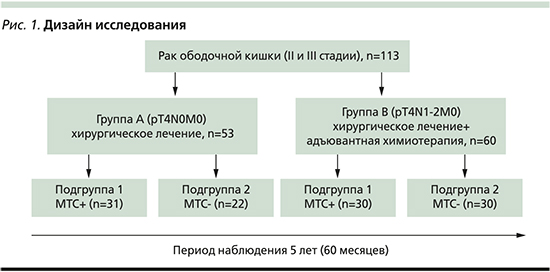
В открытое проспективное нерандомизированное исследование в параллельных группах в период с 2010 по 2016 г. были включены 113 пациентов, у которых после проведенного радикального хирургического лечения верифицирована аденокарцинома ободочной кишки II (T4N0M0) или III стадии (T любое N1-2M0).
В зависимости от стадии заболевания все пациенты были разделены на 2 группы: группа А (53 пациента) – пациенты с выявленной II стадией заболевания (Dukes B), группа Б (60 пациентов) – пациенты с выявленной III стадией заболевания (Dukes C). Всем пациентам проведено лечение по имеющимся на тот момент стандартам (2010–2016). Так, пациентам группы А проведено только хирургическое лечение, пациентам группы В – комплексное лечение (хирургическое лечение+АХТ). АХТ проводилась пациентам группы В в течение 6 месяцев после хирургического лечения по стандартным схемам FOLFOX4 и De Gramont.
После проведенного лечения все пациенты находились под динамическим наблюдением и им выполнялись диагностические процедуры, согласно стандартам наблюдения пациентов, имевших РОК в течение 5 лет после хирургического вмешательства.
Медиана наблюдения за пациентами составила 60 месяцев. С момента наблюдения у пациентов в различные сроки были выявлены отдаленные метастазы, в связи с чем все пациенты групп А и Б были разделены на подгруппы. У пациентов подгруппы 1 каждой группы в течение 60 месяцев не было зарегистрировано отдаленных метастазов при использовании стандартных методик наблюдения; у пациентов подгруппы 2 зарегистрировано прогрессирование процесса в виде появления отдаленных метастазов при использовании стандартных методик наблюдения.
Следовательно, дизайн нашего исследования выглядел следующим образом (рис. 1).
Далее были оценены клинические характеристики всех пациентов (возраст, пол, локализация первичной опухоли, характер выполненной операции) и морфологические характеристики опухоли, для этого гистологические блоки всех пациентов были направлены на иммуногистохимическое исследование с целью определения уровня экспрессии Ki-67; наличия и уровня экспрессии самых распространенных типов хемокиновых рецепторов CCRX 4 и CCR 10 и молекулярно-генетический анализ (определение мутации в гене KRAS, 12-й, 13-й кодоны).
Уровень экспрессии хемокиновых рецепторов определялся по шкале, выделенной нами самостоятельно, и дифференцировался интенсивностью окраски в процентом выявлении рецепторов хемокинов в аденокарциноме толстой кишки: низкий (0–30%), средний (30–70%), высокий (70–100%) [12].
Статистический анализ выполнен с использованием статистических пакетов MedCalc (ver. 19.4.1), MicroSoft Exel (ver. 16.16.22). Расчет объема выборки производили с помощью программы Pass 11.0.7.
Результаты
Оценка клинических факторов прогноза у больных РОК со II стадией T4N0M0 (Dukes B) (группа А)
Клиническая характеристика пациентов группы А представлена в табл. 1.
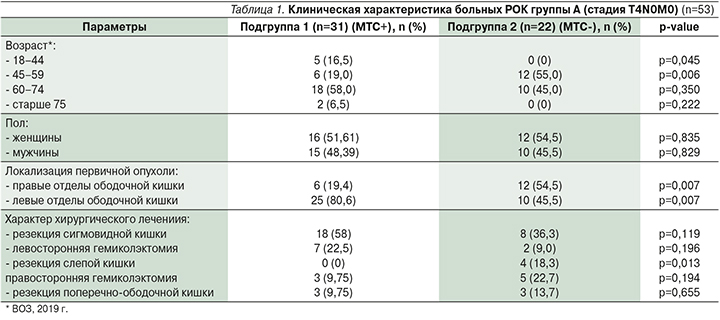
Сравнительный анализ демографических характеристик пациентов обеих подгрупп позволил определить, что в 1-й подгруппе достоверно чаще встречались пациенты более молодого возраста – от 18–44 лет (16,5 против 0%; р=0,045).
У всех пациентов группы А гистологически верифицирована аденокарцинома с различной локализацией первичной опухоли.
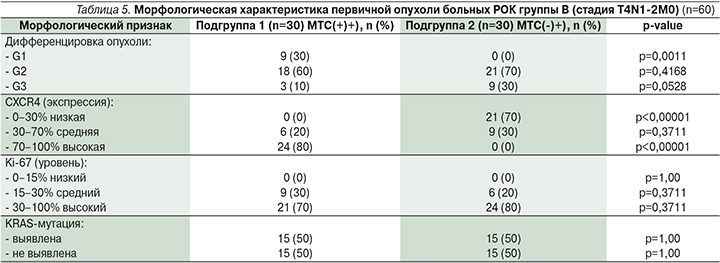
С учетом последних данных изученной литературы локализация первичной опухоли служит важным прогностическим критерием с точки зрения показателей БРВ. Так, правосторонняя локализация опухоли – один из факторов раннего метастазирования (МТС) и агрессивности опухоли ободочной кишки [11]. Как показано в табл. 1, в 1-й подгруппе пациентов (МТС+) правосторонняя локализация опухоли выявлялась только у 6 (19,4%) пациентов, во 2-й (МТС-) – у 12 (54,5%) . Таким образом, в нашем исследовании мы не отметили высокой значимости данной опухолевой характеристики, возможно, в связи с небольшой выборкой в группах (р=0,007).
Хирургическое лечение представлено различными операциями в каждой подгруппе в соответствии с локализацией первичной опухоли в радикальном объеме. Резекция сигмовидной кишки чаще проводилась у пациентов 1-й подгруппы – 58 против 36,3% соответственно (р=0,119). Левосторонняя гемиколэктомия (р=0,196), правосторонняя гемиколэктомия (р=0,194), резекция поперечно-ободочной кишки (р=0,655) одинаково часто были проведены в обеих подгруппах.
У всех 53 (100%) пациентов группы А не наблюдалось повышения уровня РЭА более 5 нг/мл в послеоперационном периоде.
При последующем динамическом наблюдении у пациентов 1-й подгруппы группы А выявлено прогрессирование опухолевого процесса в промежутке от 1 до 44 месяцев.
Оценка морфологических факторов прогноза у больных РОК cо II стадией T4N0M0 (Dukes B) (группа А)
Морфологическая характеристика первичной опухоли пациентов группы А представлена в табл. 2.
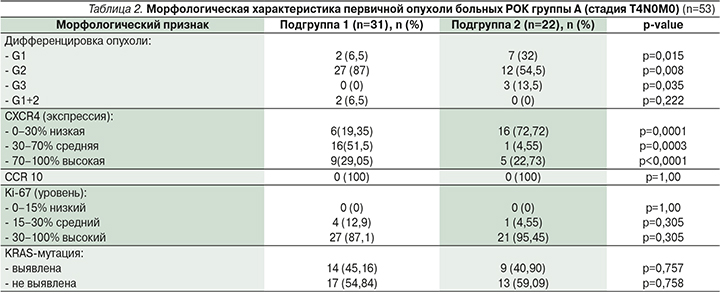
Проведенный сравнительный анализ показал, что у пациентов 2-й подгруппы достоверно чаще выявлялась опухоль высокой (р=0,015) и низкой (р=0,035) дифференцировки. В подгруппе 1 большинство пациентов имели умеренную дифференцировку опухоли (р=0,008). Сочетание высокой и умеренной дифференцировки встречалось только в подгруппе 1, но число зарегистрированных случаев достоверно не отличалось от такового подгруппы 2 (р=0,222).
В подгруппе 1 выявлена экспрессия хемокинового рецептора CXCR4 в первичной опухоли со средним значением 50±29,01% (95% доверительный интервал [ДИ] от 39,36 до 60,64%). Более чем у половины (51,6%) пациентов в опухоли определялась экспрессия в пределах 30–70% и почти у трети (29,1%) – более 70%. Низкий уровень экспрессии рецептора CXCR4 выявлен лишь в опухоли 6 пациентов, что составило 19%.
При исследовании экспрессии хемокинового рецептора CXCR4 во 2-й подгруппе среднее значение данного показателя составило 27,73+7,58% (95% ДИ от 11,97 до 43,49%), что почти в 2 раза меньше, чем в подгруппе 1.
Таким образом, при сравнении двух подгрупп по уровню экспрессии CXCR4 с использованием критерия Манни–Уитни в подгруппе 1 уровень экспрессии изучаемого рецептора оказался достоверно выше, чем в подгруппе 2 (U=201,50; Z=2,535; р=0,011), что служит показателем высокого метастатического потенциала опухоли и неблагоприятного прогноза у больных РОК.
При иммуногистохимическом исследовании презентации хемокиновых рецепторов CCR10 на поверхности опухолевой клетки, экспрессии изучаемого рецептора выявлено не было ни в одном из случаев. На сегодняшний день этот факт подтверждается как зарубежными, так и отечественными авторами, которые отмечают, что в эпителиальных клетках толстой кишки выявляется экспрессия только одного хемокина – CXCR4.
При анализе индекса пролиферации Ki-67 ни в одной из подгрупп не был зарегистрирован низкий уровень пролиферации (<15%), что в целом характерно для аденокарцином ободочной кишки.
При сравнении уровня индекса пролиферации Ki-67 с использованием критерия Манни–Уитни в подгруппе 1 уровень этого показателя оказался достоверно ниже, чем в подгруппе 2 (U=96,50; Z=4,482; р<0,0001).
Таким образом, в нашем исследовании показано, что чем ниже уровень пролиферативной активности раннего РОК, тем выше метастатический потенциал опухоли. Однако использовать его в качестве единственного прогностического маркера не рекомендуется в связи с тем, что, согласно многочисленным наблюдениям, показатели пролиферативной активности не коррелируют с частотой метастазирования.
Одним из известных факторов агрессивности течения РОК является наличие мутации в гене KRAS.
При оценке этого показателя в изучаемых подгруппах пациентов группы А с использованием критерия Манни–Уитни статистической разницы выявлено не было: 14 против 9 соответственно (U=315,50; Z=0,524; р=0,6001).
Таким образом, при изучении влияния клинико-морфологических характеристик на частоту метастазирования у больных РОК стадии II pT4N0M0 (Dukes B) после радикального хирургического лечения были выделены факторы неблагоприятного прогноза – экспрессия хемокинового рецептора CXCR4 выше 30% с достоверностью р=0,011 и пролиферативная активность Ki-67 ниже 30% с достоверностью р<0,0001.
Оценка клинических факторов прогноза у больных РОК с III стадией T4N1-2M0 (Dukes С) (группа В)
Клиническая характеристика пациентов группы В представлена в табл. 3.
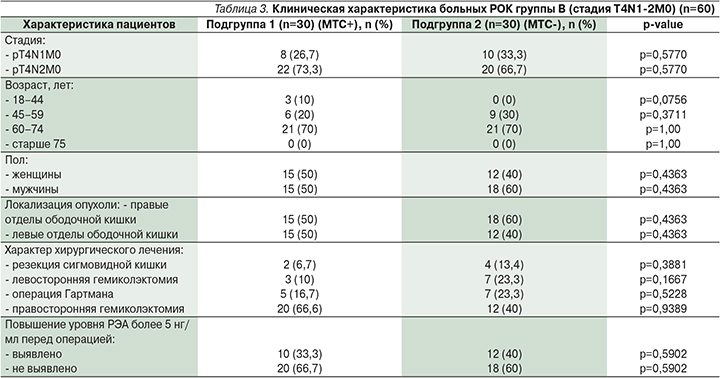
Проведенный сравнительный анализ демографических характеристик пациентов обеих подгрупп показал, что в подгруппе 1 достоверно чаще встречались пациенты в возрасте 18–44 лет (10 против 0%; р=0,0756). По гендерному признаку пациенты обеих групп были сопоставимыми (р=0,4363 и р=0,4363).
В подгруппах 1 и 2 бόльшая часть пациентов – 73,3 и 66,7% соответственно – имели стадию заболевания T4N2M1, при сравнительном анализы подгруппы были сопоставимыми (р=0,5770).
У всех пациентов группы В гистологически верифицирована аденокарцинома с различной локализацией первичной опухоли. Как и у пациентов группы А, была проанализирована встречаемость поражения левого и правого флангов ободочной кишки. При сравнении достоверно значимых отличий выявлено не было, поражение правого и левого флангов было сопоставимым (р=0,4363). По поводу первичного диагноза, как и в группе А, всем пациентам проведено радикальное хирургическое лечение.
В отличие от группы пациентов А пациенты данной группы в послеоперационном периоде имели повышение уровня РЭА в 33,3% случаев в подгруппе 1 и в 40% случаев в подгруппе 2, при сравнительном анализе подгруппы были сопоставимыми (р=0,5902).
В обеих подгруппах бόльшая часть пациентов получали в качестве АХТ схему FOLFOX4 – 66,7 и 60% соответственно, при сравнительном анализе значимых отличий выявлено не было (р=0,5902). При последующем динамическом наблюдении у пациентов 1-й группы выявили прогрессирование опухолевого процесса в промежутке от 2 до 60 месяцев.
Оценка морфологических факторов прогноза у больных РОК с III стадией T4N1-2M0 (Dukes С) (группа В).
С учетом полученных результатов в группе А экспрессия хемокинового рецептора CCR10 в опухолевых блоках у пациентов группы В не изучалась.
Морфологическая характеристика первичной опухоли пациентов группы В представлена в табл. 5.
Проведенный сравнительный анализ показал, что у пациентов подгруппы 1 достоверно чаще встречались опухоли высокой дифференцировки (р=0,0011), у пациентов подгруппы 2 чаще выявлялись опухоли низкой дифференцировки (р=0,0528).
В подгруппе 1 выявлена экспрессия хемокинового рецептора CXCR4 в первичной опухоли со средним значением 67,00±8,95% (95% ДИ от 46,75 до 87,25%).
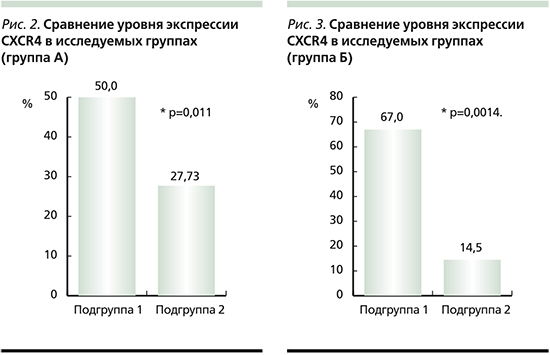
При исследовании экспрессии хемокинового рецептора CXCR4 у пациентов подгруппы 2 среднее значение данного показателя составило 14,50±5,29% (95% ДИ от 2,52 до 26,48%), что значительно меньше, чем в подгруппе 1 (рис. 3).
При сравнении двух подгрупп по уровню экспрессии CCRX4 с использованием критерия Манни–Уитни в подгруппе 1 уровень экспрессии, как и у пациентов группы А, оказался достоверно выше, чем в подгруппе 2 (U=8,00; Z=3,193; р=0,0014).
При анализе индекса пролиферации Ki-67 ни в одной из подгрупп, идентичной группе А, не был определен низкий уровень пролиферации (<15%).
В подгруппе 1 среднее значение данного показателя составило 42,50±6,38% (95% ДИ от 28,07 до 56,93%), в подгруппе 2 – 44,00±6,18% (95% ДИ от 30,01 до 57,99%).
При сравнении уровня индекса пролиферации Ki-67 с использованием критерия Манни–Уитни статистически достоверной разницы между исследуемыми группами не получено (U=46,50; Z=0,266; р=0,7903).
При молекулярно-генетическом исследовании мутации в гене KRAS у 15 (50%) пациентов подгрупп 1 и 2 мутация обнаружена (р=1,00).
При сравнении двух подгрупп по уровню определения KRAS мутации с использованием критерия Манни–Уитни группы были абсолютно идентичными (U=50,0; Z=0,000; р=1,0000).
Таким образом, у пациентов группы В, как и у пациентов группы А, экспрессия хемокинового рецептора CXCR4 в опухолевой ткани выше у пациентов подгруппы 1 (МТС+), что позволяет нам сделать вывод: экспрессия CXCR4 выше 30% в опухолевой ткани РОК – это показатель неблагоприятного прогноза больных РОК после радикального хирургического лечения как при II, так и при III стадиях.
Чтобы с достоверностью утверждать о влиянии экспрессии хемокинового рецептора CXCR4 на течение РОК, далее мы в своей работе посмотрели зависимость БРВ от уровня экспрессии CXCR4.
Из табл. 6 наглядно видно, что пациенты подгруппы 1 имели более высокую медиану БРВ и, как сказано выше, имели низкую экспрессию хемокинового рецептора CXCR4 в опухолевой ткани. Таким образом, медиана БРВ зависит от уровня экспрессии хемокинового рецептора CXCR4 в опухолевой ткани.

Обсуждение
В настоящее время по рекомендациям Ассоциации онкологов России при РОК IIА-стадии, отсутствии факторов неблагоприятного прогноза и/или наличии микросателлитной нестабильности (MSI-H) рекомендовано динамическое наблюдение после проведенного радикального лечения, в остальных случаях рекомендовано проведение АХТ, однако до сих пор не выделены группы благоприятного и неблагоприятного прогнозов, т.к. в настоящее время нет универсального прогностического фактора, который бы помог дифференцировать пациентов по риску возникновения рецидива заболевания, позволить подобрать максимально эффективный режим и длительность АХТ.
Планируя дизайн нашего исследования, мы изначально решили не только посмотреть и сравнить 2 подгруппы пациентов со II стадией заболевания, но и взять и сравнить 2 подгруппы пациентов с III стадией заболевания, чтобы результаты лечения и полученные нами выводы мы могли отнести в принципе ко всем пациентам с РОК.
Проведенный анализ 113 пациентов, проходивших лечение по поводу РОК, позволил сделать выводы, которые, на наш взгляд, помогут оптимизировать адъювантное лечение пациентов с РОК после проведенного радикального лечения.
Так, одним из наших предложений является не назначать пациентам с РОК II стадии, в опухолевой ткани которых мы определили низкую экспрессию хемокиного рецептора CXCR4, АХТ и, наоборот, пациентам со II стадией заболевания, у которых выявляется экспрессия хемокинового рецептора выше 30%, интенсифицировать лечение, добавить оксалиплатин к лечению, увеличить длительность лечения с 3 до 6 месяцев.
Отдельную группу больных составляют пациенты с сопутствующей патологией – сахарным диабетом и болезнями нервной системы на фоне лечения оксалиплатином, у которых может усугубиться уже имеющаяся периферическая невропатия. По результатам исследования MOSAIC, 3-я степень нейротоксичности отмечена у 12%, в исследовании NSABP C-07-2 4-я степень нейротоксичности выявлена у 30,4% пациентов. У больных же с имеющейся изначальной периферической невропатией проведение химиотерапии с оксалиплатином может усугублять течение сопутствующей патологии и приводить к отмене назначенной терапии. Таким образом, при планировании лечения пациентов данной группы также можно использовать дополнительный диагностический маркер – экспрессию хемокиного рецептора, и пациентам, у которых будет выявлена низкая экспресссия данного маркера, АХТ не назначать, а пациентам со средней и высокой экспрессией данного рецептора назначать АХТ по показаниям, но только 5-фторурацилом.
Безусловно, данный прогностический маркер предлагаем использовать наряду с уже имеющимися.
Заключение
Анализ клинико-морфологических характеристик пациентов с РОК перед назначением адъювантного лечения позволит оптимизировать данное лечение и увеличить БРВ.



