Введение
Несмотря на успехи, связанные с лечением септических пациентов, уровень летальности среди них остается высоким, а средняя продолжительность пребывания в стационаре по меньшей мере в 3 раза превышает таковую для несептических больных [1, 2]. Причем при латентном течении сепсиса летальность в 1,5 раза выше (52–56%), чем при клинически очевидных проявлениях синдрома (34,7–36,9%) [3]. Особенности развития и трудности диагностики септического процесса обусловлены сложностью своевременного распознавания перехода локального инфекционного процесса в генерализованный, в ряде случаев (до 21%) установить очаг так и не удается, что еще в большей степени усложняет диагностику. Полиморфизм клинических проявлений сепсиса зависит от источника инфекции (абдоминальный, респираторный, ангиогенный, мочевой, ожоговый и т.д.), вирулентности микроорганизмов и состояния макроорганизма [4, 5]. Клинический и биологический фенотипы сепсиса могут видоизменяться под воздействием предшествовавших острых и хронических заболеваний, медикаментозного лечения и интервенционных вмешательств [6–8].
На 3-м Международном консенсусе определений сепсиса и септического шока в 2016 г. были пересмотрены некоторые термины и критерии диагноза [9, 10]. Согласно современным представлениям, сепсис определяется как жизнеугрожаемая острая органная дисфункция, возникающая в результате нарушения регуляции ответа макроорганизма на инфекцию. То есть развитие сепсиса обусловлено не прямым цитоповреждающим эффектом микроорганизма и/или их токсинов, а особенностями активации эндогенного ответа на инфекционный агент с повреждением собственных тканей в результате прогрессирующего воспаления [8]. Именно поэтому важным фактором риска септического процесса служит отягощенный преморбидный фон: злокачественные новообразования, сахарный диабет, хроническая болезнь почек, цирроз печени, конкурентные повреждения (включая хирургию), агрессивная медикаментозная терапия. Инфекция служит пусковым механизмом, а отягощенный преморбидный фон повышает восприимчивость организма к инфекции, извращая ответ на нее, значимо ухудшая течение и прогноз заболевания. Тяжесть органной дисфункции может быть измерена с помощью шкал APACHE III, SOFA или qSOFA. Поскольку начальные проявления, вызванные сепсисом, могут быть не столь явными и маскироваться симптомами основного заболевания, вероятность органной дисфункции необходимо рассматривать у каждого пациента с инфекционным процессом. Следует отметить, что эти рекомендуемые шкалы не являются изолированным критерием сепсиса [11]. Ключевой в их практическом применении является возможность выявления признаков повреждения при проведении тщательного обследования с целью исключения септического очага. Кроме того, количественная оценка полиорганной недостаточности в динамике позволяет оценивать не только тяжесть состояния, но и эффективность проводимой терапии.
Следует подчеркнуть, что синдром системного воспалительного ответа (ССВО) был частью дефиниций сепсиса до 2016 г. [12, 13]. Показатели ССВО в определенной степени отражают выраженность воспаления, но не позволяют определять жизнеугрожаемость ситуации. Кроме того, сам ССВО нередко играет компенсаторную роль, сдерживая патологический процесс и органно-системные повреждения. Не следует забывать, что некоторые пациенты принимают лекарства, влияющие на частоту сердечных сокращений, дыханий или температуру тела, следовательно, симптомы, отвечающие критериям ССВО, нивелируются, несмотря на наличие инфекции и недостаточности органов [13]. И наконец, в клинической практике встречаются случаи септического процесса без признаков ССВО. Ввиду низкой специфичности этого критерия в настоящее время он не считается основным в диагностике сепсиса [14].
Клинический случай
Пациентка Б. 57лет (30.05.2016) госпитализирована в отделение травматологии. На протяжении предшествовавших 1,5 месяцев ее беспокоил болевой синдром в области левого тазобедренного сустава (ТБС; в анамнезе эндопротезирование этого сустава [2015] по поводу коксартроза). Вышеописанные жалобы появились после серии вывихов, свершавшихся при опоре на чрезмерно согнутую в ТБС ногу с последующим самопроизвольным вправлением. В тот же период отмечала появление озноба, однако температуру тела не контролировала, самостоятельно принимала нестероидные противовоспалительные препараты (НПВП). При обращении за медицинской помощью (за пределами РФ, выписной эпикриз не представлен) после проведения рентгенологического исследования органов грудной клетки (ОГК) была диагностирована пневмония, назначен курс левофлоксацина (5 дней) с клиническим улучшением. 30.05.2016 произошло развитие очередного вывиха левого протезированного ТБС без самостоятельного вправления, в связи с чем пациентка госпитализирована в отделение травматологии. 31.05.2016 под внутривенной анестезией выполнено закрытое вправление вывиха левого эндопротеза, наложена деротационная шина. С 07.06.2016 жалобы на учащенное, болезненное мочеиспускание, окрашивание мочи в красный цвет (с 31.05 по 05.06 выполнялась катетеризация мочевого пузыря), озноб, повышение температуры тела до 38,6°С. В общем анализе мочи протеинурия – 0,438 г/л, эритроцитурия – 40–50–60 в п/зр. Клинический анализ крови: эритроциты –3,39×1012/л, Hb – 87,8 г/л, лейкоциты – 3,89×109/л, п/я – 5%, с/я – 72%, лимфоциты – 13%, моноциты – 8%, эозинофилы – 1%, базофилы – 1%, тромбоциты – 90,0×109/л; по данным ультразвукового исследования (УЗИ) почек и мочевого пузыря: патологических изменений, конкрементов не выявлено. Рентгенография ОГК – в нижней доле правого легкого определялся инфильтрат с реакцией плевры. Полученные данные были расценены как правосторонняя нижнедолевая пневмония, назначен амоксициллин/клавулановая кислота. 10.06.2016 на фоне повышения температуры тела до 37,6°С выполнен забор крови на стерильность и чувствительность к антибиотикам.
К концу третьих суток антибактериальной терапии произошла нормализация температуры тела, в контрольном клиническом анализе крови лейкоциты 6,51×109/л, СОЭ – 66 мм/ч, в общем анализе мочи сохранялись эритроцитурия и протеинурия. 15.06.2016 снята иммобилизирующая шина с расширением двигательного режима, антибактериальная терапия продолжалась.
В анамнезе у пациентки хронический токсический стеатогепатит, цирротическая стадия (класс «С» по Child–Turcotte–Pugh) с синдромами портальной гипертензии (спленомегалия, гиперспленизм, отечно-асцитический синдром, варикозно расширенные вены пищевода) и печеночно-клеточной недостаточности (печеночная энцефалопатия 1-й ст., снижение протромбинового индекса, альбумина, холестерина). В январе 2016 г. находилась на лечении по поводу тромбоза воротной вены, на фоне терапии (фондапаринуксом) неполная ее реканализация. В возрасте 25 лет верифицированы диффузный узловой зоб, тиреотоксикоз. Длительное время принимала тиамазол в дозе 5 мг с последующей самостоятельной отменой. При обследовании в настоящую госпитализацию субклинический тиреотоксикоз, аутоимунная офтальмопатия.
17.06.2016 пациентка была переведена в отделение терапии с жалобами на выраженную общую слабость, повышенную потливость, одышку смешенного характера в покое, увеличение живота в объеме, отеки нижних конечностей, боль в области протезированного сустава. Объективно на момент перевода: состояние тяжелое, сознание заторможено, температура тела – 37,9°С. Кожные покровы и видимые слизистые оболочки бледные, субиктеричные. Отеки голеней. Гематома по наружной поверхности левого бедра на уровне ТБС размером 5,0×5,0 см, там же старый послеоперационный рубец. Пульс симметричный, 100 ударов в минуту, ритмичный. Артериальное давление – 90/60 мм рт.ст. Тоны сердца приглушены, систолический шум на верхушке, не проводится. Частота дыхательных движений – 28 в минуту, в акте дыхания участвует вспомогательная мускулатура. Дыхание жесткое, в нижнебоковых отделах резко ослаблено, там же выслушиваются разнокалиберные влажные хрипы. При пальпации живот мягкий, безболезненный, притупление перкуторного звука в отлогих отделах, увеличение в объеме за счет асцита. Печень не выступает из-под края реберной дуги. Селезенка: нижний полюс плотный, выступает из-под края реберной дуги на 2 см.
На контрольной рентгнограмме ОГК на фоне сохранения участка затенения справа над диафрагмой появление застойных явлений в легких с элементами интерстициального отека. По данным УЗИ органов брюшной полости: правосторонний гидроторакс, асцит++. Зарегистрировано нарастание уровня креатинина до 150 мкмоль/л (исходно 60), общего билирубина – до 44,9 мкмоль/л (исходно 22,4). В клиническом анализе крови менее чем за сутки развитие лейкемоидной реакции со сдвигом влево, появление токсической зернистости (см. рисунок).
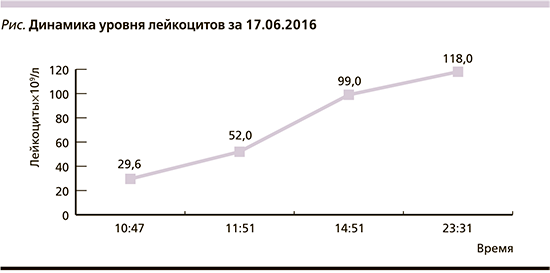
Получены результаты посева венозной крови от 10.06.2016: Staphylococcus aureus, чувствительный к ципрофлоксацину, клиндамицину, линкомицину, гентамицину, ванкомицину.
С целью поиска очага инфекции дополнительно выполнены:
1. Эхо-КГ: изменений на клапанном аппарате, регургитаций не выявлено, сократительная функция миокарда сохранна, легочная гипертензия – 55 мм рт.ст.
2. Спиральная КТ ОГК: двусторонние распространенные интерстициальные изменения, вероятно, отек легких, минимальный правосторонний организующийся плеврит.
3. Спиральная КТ ОБП: плотность печени понижена, воротная вена диаметром 1 см, внутрипеченочные желчные протоки не расширены. Селезенка – 240×62 мм. Асцит+.
4. Спиральная КТ ТБС: состояние после эндопротезирования левого ТБС. КТ-картина застарелого раскалывающегося перелома бедренной кости вокруг ножки эндопротеза.
Полученные клинико-лабораторные данных расценены как генерализованный септический процесс у пациентки с двусторонней полисегментарной стафилококковой пневмонией. С учетом тяжести состояния, сопутствующей патологии пациентка переведена в отделение реанимации и интенсивной терапии. Произведена замена проводимой антибактериальной терапии на ванкомицин и цефтриаксон. К 19.30 отрицательная динамика: нарастание явлений дыхательной недостаточности, оглушение сознания до сопора, кислотно-основное состояние – компенсированный метаболический ацидоз, гипотония (артериальное давление – 70/40 мм рт.ст.), тахикардия (100 ударов в минуту), анурия. Выполнена интубация, начаты искусственная вентиляция легких, инфузия растворов, внутривенное введение дофамина, фуросемида. Несмотря на проведенную комплексную интенсивную терапию, в 07.00 констатирована биологическая смерть.
Из заключения патологоанатомического вскрытия: непосредственной причиной смерти стала прогрессирующая полиорганная, преимущественно легочно-сердечная, а также печеночно-клеточная и почечная недостаточность, осложнившая течение сочетанных заболеваний.
В проекции протеза левого ТБС выявлен тотальный септический аутолиз организующейся гематомы (4,0×2,0×1,5 см). Что в условиях бактеремии привело к развитию сепсиса с развитием синдрома диффузного альвеолярного повреждения легких, лейкемоидной реакции и проявлениям геморрагического синдрома. Смешанный (моно-, мультилобулярный), преимущественно мелкоузловой атрофический цирроз печени. Индекс гистологической активности (по Knodell) – 7, стадия (по Desmet V.) – 4.
Осложнение основного заболевания: формирующаяся ацинарная бронхопневмония. Легочно-сердечная недостаточность: интерстициальный отек легких. Портальная гипертензия: варикозное расширение вен пищевода, асцит (500 мл), гиперспленизм (масса – 1850 г). Печеночно-клеточная, почечная недостаточность.
Обсуждение
При ретроспективном анализе данного клинического случая позднее диагностирование септического состояния было обусловлено несколькими причинами: из признаков ССВО на начальных этапах определялось только повышение температуры тела с положительным ответом на антибактериальную терапию; забор крови на посев и стерильность был произведен однократно, имела место поздняя готовность этого результата; для исключения или подтверждения септического процесса по техническим причинам не определялся прокальцитонин; не проводилась в динамике оценка органной недостаточности по шкалам APACHE III и SOFA; при проведении спиральной КТ ТБС не были выявлены признаки септического очага. Также, по нашему мнению, одной из причин несвоевременного распознавания септического процесса и позднего начала адекватной антибактериальной терапии послужила недооценка тяжести коморбидного фона пациентки [15].
Заключение
Сепсис у больных циррозом печени встречается в 7–20% случаев [16]. Летальность при бактериальных осложнениях у этой категории пациентов достигает 60–70% и, как правило, обусловлена слабой выраженностью, а нередко и полным отсутствием симптоматики микробной инфекции [16, 17]. Отсутствие признаков ССВО у пациентов с циррозом печени объясняют концепцией «иммунного паралича». Имеются данные о корреляции «иммунного паралича» с тяжестью септического процесса [18]. В ряде случаев единственным проявлением спонтанной бактериемии служит появление или усиление печеночной энцефалопатии [15]. Трудности раннего выявления сепсиса в большинстве случаев носят объективный характер, поскольку обусловлены полиморфизмом клинических проявлений, отсутствием «золотого» стандарта диагностики. Заподозрить септический процесс на ранних этапах, особенно при наличии такой тяжелой фоновой патологии, как в данном случае – цирротической стадии гепатита, позволит динамическая оценка состояния с применением шкал APACHE III, SOFA (qSOFA), проведение прокальцитонинового теста [19].
Информированное согласие пациента отсутствует.


