Введение
Распространенность инфекций, вызванных вирусами папилломы человека (ВПЧ), у беременных женщин обнаруживается в 2 раза чаще по сравнению с небеременными [1] и составляет от 5,5 до 65% [2]. Цервикальная интраэпителиальная неоплазия (CIN) встречается от 1,3 до 2,7 случая на 1000 беременностей, а заболеваемость раком шейки матки (РШМ) составляет 0,1–12 на 10 тыс. беременностей [3]. Повышенная чувствительность эпителия шейки матки (ШМ) к ВПЧ у беременных связана с влиянием эстрогенов и прогестерона, которые увеличивают экспрессию ВПЧ 16-го типа [4].
Исследователи обращают внимание на то, что изменение экспрессии генов различных сигнальных путей может служить прогностическим фактором перехода CIN в рак. Однако эти процессы изучены недостаточно, особенно у беременных женщин, что послужило основанием для настоящего исследования.
Цель исследования: определить экспрессию генов апоптоза и пролиферации у беременных женщин, инфицированных ВПЧ, и их роль в прогнозе прогрессиронания цервикальной неоплазии.
Методы
Проведено открытое наблюдательное неинтервенционное когортное клиническое исследование. В исследовании приняли участие 82 беременные женщины, инфицированные ВПЧ, в возрасте от 23 до 31 лет. Контрольную группу составили 25 беременных женщин без ВПЧ. Пациентки дали информированное согласие на участие в данном исследовании.
При создании протокола исследования учитывались положения Хельсинкской декларации Всемирной медицинской ассоциации (пересмотр 2008 г.), а также документа «Международные этические рекомендации по проведению биомедицинских исследований с участием людей». Протокол исследования одобрен этическим комитетом ФГАОУ РУДН.
Отбор пациенток проведен в соответствии с критериями включения и исключения. Критерии включения: возраст пациенток 18–45 лет, беременность. Критерии исключения: тяжелые соматические заболевания, резус-отрицательная кровь, преэклампсия, угроза прерывания беременности, психические заболевания и когнитивные расстройства, злокачественные новообразования любой локализации.
Применялись общеклинические методы исследования (изучение жалоб и анамнеза, объективное и акушерское обследования), лабораторные методы включали тестирование на ВПЧ методом полимеразной цепной реакции (ПЦР) в режиме реального времени (тест «Квант-21»), цитологическое исследование мазков экто- и эндоцервикса по Папаниколау с оценкой по классификации Бетесда (пересмотра 2014 г.).
Определение уровня экспрессии мРНК генов VEGFA, TGFb, BCL-2, BAG1, BAX в клетках эпителия цервикального канала выполняли методом ПЦР в режиме реального времени (реактивы и детектирующий амплификатор производства компании «ДНК-Технология», Россия). Для выделения нуклеиновых кислот использовали наборы «Проба НК». Реакцию ставили в двух повторах для каждой точки.
Уровень экспрессии мРНК указанных выше генов измеряли в относительных единицах, нормировку которой проводили методом сравнения пороговых циклов (метод ΔΔCр) относительно нормировочного фактора, рассчитанного с использованием референсных генов (B2M, GUSB, TBP).
Статистический анализ полученных данных осуществляли при помощи пакета программы Statistica 6.0. Использовали методы описательной статистики. Количественные показатели представляли в виде Ме (Q25–Q75%), где Мe – медиана, а Q25–Q75% – интерквартильный размах показателя. Закон распределения признаков оценивали при помощи критерия Колмогорова–Смирнова, он оказался отличным от нормального. Для показателей, характеризующих качественные признаки, указывали абсолютное число и относительную величину в процентах (%). Проверку статистической значимости различий количественных показателей, отличающихся от нормального распределения, проводили при помощи непараметрических критериев. Анализ различий в независимых выборках выполняли с помощью U-критерия Манна–Уитни. Различия качественных признаков анализировали при помощи χ2-критерия. Различия считали статистически значимыми при р≤0,05.
Результаты исследования
Средний возраст обследованных пациенток составил 29,2±3,3 года. Срок беременности при включении в исследование составил в среднем 10,3±0,9 недели и колебался в пределах от 8 до 14 недель. Общая клиническая характеристика обследованных пациенток представлена в табл. 1.
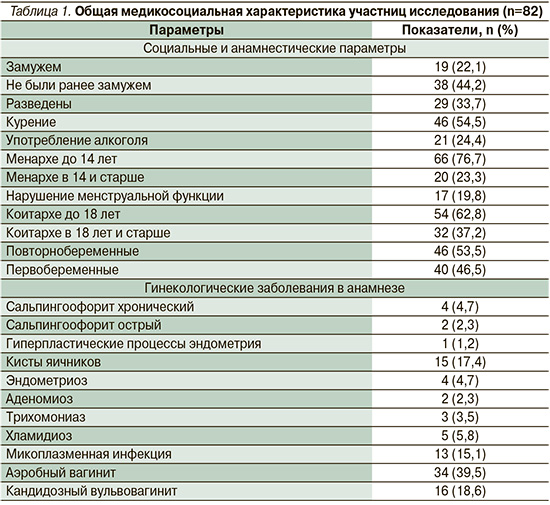
Гинекологические заболевания в анамнезе отмечены с частотой 1,3±0,6 на одну беременную. Из экстрагенитальных заболеваний в анамнезе наиболее часто встречались болезни желудочно-кишечного тракта – 29,1% (25/86), сердечно-сосудистой системы – 16,3 (14/86), нарушения жирового обмена – 12,8% (11/86), остальные – от 3 до 5 случаев в выборке.
Пациентки контрольной группы были сопоставимыми по всем исследуемым показателям (статистически значимая разница отсутствовала).
Первоначально среди обследуемых пациенток определяли серотипы ВПЧ, представленные в табл. 2. Из ВПЧ высокого канцерогенного риска (ВКР) наиболее часто в данной когорте пациенток выделялись типы 16, 52 и 56. ВПЧ 18-го типа в данной выборке не был представлен.
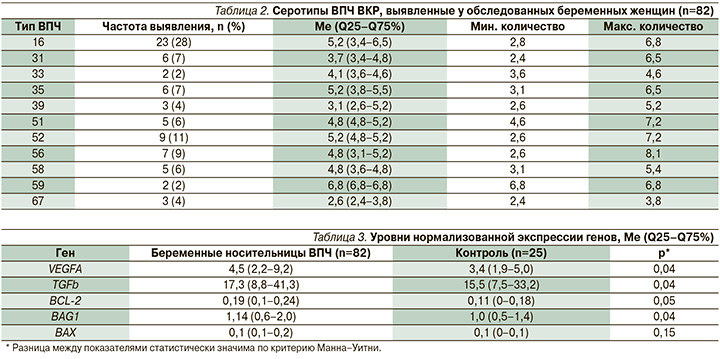
Уровни экспрессии генов, детерминирующих процессы роста или апоптоза, представлены в табл. 3, в т.ч. рассчитаны медианные значения экспрессий в зависимости от серотипа вируса (табл. 4).
Из табл. 3 видно, что в целом по выборке выявлены статистически значимые различия с показателями группы контроля в выраженности экспрессии генов VEGFA, TGFb, BCL-2 и BAG1, кроме BAX.
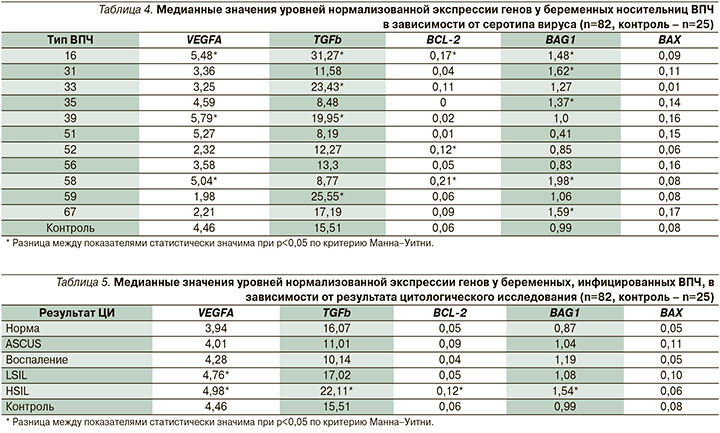
При анализе табл. 4 и выделении подгрупп с отдельным серотипом вируса была обнаружена разница в степени экспрессии изучаемых генов в зависимости от серотипа, за исключением экспрессии гена BAX: его экспрессия статистически значимо не зависела от серотипа по сравнению с показателями контроля. Медианные значения уровней экспрессии всех генов (кроме BAX) были статистически значимо выше для серотипа 16.
Проведен сравнительный анализ выраженности экспрессии генов в зависимости от результата цитологического исследования у беременных, инфицированных ВПЧ (табл. 5).
Экспрессия гена VEGFA была статистически значимо выше по сравнению с контролем при LSIL (low grade squamous intraepithelial lesion). HSIL (high grade squamous intraepithelial lesion) отличала высокая экспрессия всех генов (кроме BAX), которая была статистически значимо выше по сравнению с контролем.
Таким образом, экспрессия всех генов (кроме BAX) была статистически значимо выше для серотипа 16 и трех генов – для 58-го типа. При LSIL повышалась экспрессия гена VEGFA, при HSIL – всех генов (кроме BAX).
Обсуждение результатов
Полученные результаты свидетельствуют о том, что носительство ВПЧ у беременных женщин сопряжено с изменением экспрессии генов VEGFA, TGFb, BCL-2, BAG1, которая для некоторых типов ВПЧ оказалась выше, чем в контроле. Так, для типов 16, 39 и 58 экспрессия гена VEGFA, характеризующего ангиогенез, была статистически значимо выше по сравнению с контролем и составляла более log5/105 клеток.
VEGF – фактор роста эндотелия сосудов, является главным регулятором, ответственным за индукцию ангиогенеза, роста эндотелиальных клеток и ингибирование апоптоза. Ангиогенез играет ключевую роль в прогрессировании опухолей за счет образования новых кровеносных сосудов. Избыточная экспрессия/регуляция VEGF обнаружена нами и при LSIL, и при HSIL и, как отмечают другие исследователи, связана с плохим прогнозом и может играть важную роль в прогрессировании CIN и развитии РШМ [5, 6].
На фоне ВПЧ ВКР типов 16, 33, 39 и 59 и при HSIL (в отличие от LSIL и в отсутствие поражений ШМ) отмечается повышенный уровень экспрессии гена TGF-b (трансформирующий фактор роста β), который представляет собой многофункциональный цитокин, действующий как антипролиферативный фактор в нормальных эпителиальных клетках и на ранних стадиях онкогенеза, он останавливает клеточный цикл на стадии G1, препятствуя пролиферации, индуцирует дифференцировку и способствует апоптозу [7]. Увеличение экспрессии TGF-β часто коррелирует со злокачественными новообразованиями многих видов рака и дефектом реакции ингибирования роста клеток. Нарушение сигнального пути TGF-β/Smad может способствовать прогрессированию дисплазии ШМ. Кроме того, неопластические клетки часто теряют чувствительность к нему, что является характерным изменением, связанным с прогрессированием от CIN до цервикальной карциномы [7].
В апоптотическом пути BCL-2 – один из наиболее важных мембранных белков, который блокирует движение по пути, ведущему к апоптозу или запрограммированной клеточной смерти. Увеличение экспрессии BCL-2 при более высоком уровне CIN подразумевает усиление защиты от запрограммированной гибели клеток, но еще и индукцию генетической нестабильности в диспластических эпителиальных клетках, и большую способность развиваться в инвазивную карциному [8]. Экспрессия белка BCL-2 в CIN3 значительно выше, чем для CIN1, CIN2 (p=0,03, p=0,02 соответственно). Однако никакой связи между иммуноокрашиванием BCL-2 и инфекцией ВПЧ не наблюдалось [9]. Экспрессия BCL-2 в настоящем исследовании была статистически значимо выше контрольных значений для ВПЧ типов 16, 52 и 58 и в 2 раза выше при HSI по сравнению с контролем, при этом при других заболеваниях ШМ оставалась на уровне референсных значений.
Наибольшее число ВПЧ типов 16, 31, 35, 58, 87 демонстрировали увеличение экспресии BAG-1. BAG-1 – это многофункциональный белок, предотвращающий апоптоз, который взаимодействует с различными клеточными белками и влияет на их функции. На поверхности клетки он связывается с цитозольным доменом рецепторов факторов роста и усиливает защиту клеток от гибели, вызванной рецепторами факторов роста. В цитозоле он связывается с BCL-2 и белком теплового шока, модулирует их функции. Сверхэкспрессия BAG-1 обнаружена в различных линиях опухолевых клеток и раковых тканях [10]. M.K. Hassumi-Fukasawa et al. изучали уровни экспрессии BAG-1 у женщин с CIN и обнаружили, что они значительно различались между LSIL и HSIL (p=0,014) и между LSIL и инвазивными плоскоклеточными карциномами (SCC – (Squamous cell carcinoma; p=0,014). Авторы утверждают, что экспрессия BAG-1 может способствовать дифференциальной диагностике между LSIL и HSIL/SCC [11]. В настоящем исследовании получены аналогичные результаты: при HSIL экспрессия этого гена была в 2 раза выше по сравнению с контролем и отсутствием CIN и статистически значимо выше по сравнению с LSIL.
BAX является членом семейства генов BCL-2. Этот белок образует гетеродимер с BCL2 и действует как активатор апоптоза с помощью белка-супрессора опухолей p53. При повышении экспрессии гена BAX происходит снижение риска канцерогенеза [12, 13], однако нами этого не было выявлено у обследованных пациенток и показатели экспрессии этого гена не отличались от контрольных значений.
Таким образом, при LSIL повышалась экспрессия гена VEGFA, а при HSIL – всех генов (кроме BAX). То есть выявлена способность некоторых типов ВПЧ изменять экспрессию генов, ответственных за пролиферацию. Однако остается неясным: в какой степени каждый из изученных генов влияет на процесс прогрессирования поражений ШМ или имеет значение их совокупность? Поэтому необходимы дальнейшие исследования, чтобы прояснить молекулярные аспекты связи между экспрессией генов, инфекцией ВПЧ и прогрессировании CIN для прогнозирования риска РШМ у беременных женщин.
Заключение
Исследование беременных женщин позволило выявить, что наиболее выраженной способностью изменять экспрессию генов, ответственных за пролиферацию, обладают ВПЧ 16-го и 58-го типов. При LSIL выявлено увеличение экспрессии только гена VEGFA, при HSIL – всех генов, характеризующих пролиферативный потенциал. Изменений экспрессии гена BAX, стимулирующего апоптоз, у ВПЧ-инфицированных беременных женщин не обнаружено. Это свидетельствует о возможности использования этих маркеров в прогнозе прогрессирования поражений ШМ, однако требует дальнейшего изучения.
Источник финансирования. Исследование проведено при поддержке Программы РУДН «5-100».
Вклад авторов. Бебнева Т.Н. – разработка концепции и дизайна исследования, получение клинических данных и формирование электронной базы полученных результатов, критический пересмотр первой версии статьи на предмет ее интеллектуального содержания, одобрение окончательной версии статьи перед ее подачей для публикации. Дикке Г.Б. – корректировка дизайна исследования и электронной базы полученных результатов, анализ результатов статистической обработки клинического материала и их интерпретация, написание первой версии статьи и ее редактирование после рецензирования, одобрение окончательной версии статьи перед ее подачей для публикации. Галкина И.С. - исполнение лабораторной части исследования, формирование электронной базы полученных результатов, критический пересмотр первой версии статьи на предмет ее интеллектуального содержания, одобрение окончательной версии статьи перед ее подачей для публикации.



