Введение
Распространенность аллергического ринита (АР) в разных странах мира составляет 4–32%, в России – 10–24%. Имеет место поздняя диагностика заболевания ввиду низкого уровня обращаемости больных на ранних стадиях АР. Наиболее часто первые симптомы заболевания проявляются в первой половине жизни. АР часто ассоциируются с бронхиальной астмой, которую выявляют у 15–38% больных АР. В то же время 55–85% больных бронхиальной астмой отмечают симптомы АР [2–3].
К современным тенденциям АР следует отнести ежегодный рост заболеваемости; пик заболеваемости приходится на возраст от 18 до 24 лет; наиболее высокую распространенность АР в экологически неблагоприятных регионах (в частности, среди населения, подвергающегося воздействию химических и радиационных факторов, АР составляет в структуре аллерго-патологии более 50%).
Симптоматика АР
В зависимости от этиологического фактора выделяют сезонный, круглогодичный (бытовой) или профессиональный АР [3]. По характеру течения: интермиттирующий АР (симптомы беспокоят менее 4 дней в неделю или менее 4 недель в году) и персистирующий АР (симптомы беспокоят более 4 дней в неделю и более 4 недель в году) [2].
По степени тяжести:
- легкая – у пациента имеются слабовыраженные симптомы ринита, которые не нарушают дневную активность и сон;
- средняя – симптомы ринита препятствуют работе, учебе, занятиям спортом, нарушают сон пациента;
- тяжелая – симптомы значительно ухудшают качество жизни пациента, в отсутствие терапии не способного нормально работать, учиться, заниматься спортом; значительно нарушается ночной сон [2].
По стадии заболевания: обострение, ремиссия.
В последнее время в научных публикациях авторы все чаще стали обращать внимание на такую особую форму АР, как локальный (ЛАР). Это заболевание, характеризующееся локальной (в слизистой оболочке носа) гиперпродукцией иммуноглобулина Е (IgE) против круглогодичных и сезонных аллергенов, Th2-профилем воспаления в слизистой оболочке носа в ответ на аллергенный стимул, отсутствием специфических IgE в сыворотке крови и отрицательными результатами кожных проб с аллергенами, при этом заболевание проявляется типичными симптомами АР [4–8].
Даже в условиях непостоянного контакта с виновными аллергенами, например при пыльцевой аллергии, заболевание склонно к персистированию. Это объясняется тем, что пыльца растений задерживается в квартирах, как в ловушках, и ее концентрация повышается при осуществлении уборки с использованием обычных пылесосов.
Тяжесть симптоматики АР может варьироваться из года в год в зависимости от количества пыльцы и длительности ее воздействия во время периодов пыления.
Патогенез
Механизм развития воспаления при АР служит классическим примером гиперчувствительности I типа, согласно классификации Джелла и Кумбса [1].
Реакция гиперчувствительности I типа обусловлена взаимодействием аллергена с IgE, сорбированным на мембранах тучных клеток и базофилов. Гомоцитотропность IgE (способность реагировать с поверхностью собственных клеток: тучных клеток и базофилов) обусловлена наличием особых рецепторных структур в области Fc-фрагмента молекулы антитела (АТ). Именно это свойство выражено у IgE, тогда как другие AT (например, IgG) взаимодействуют и с чужеродными клетками (т.е. они гетероцитотропны). Взаимодействие аллергена с IgE, сорбированным на тучных клетках и базофилах, приводит к высвобождению биологически активных веществ (гистамин, серотонин, эозинофильный и нейтрофильный хемотаксические факторы, протеазы).
Эти вещества образуются еще до контакта с аллергеном. После взаимодействия последнего с IgE синтезируются новые медиаторы – фактор активации тромбоцитов (PAF), медленно реагирующее вещество анафилаксии (лейкотриены В4, С4, D4) и другие продукты метаболизма фосфолипидов клеточных мембран (простагландины и тромбоксаны).
Медиаторы взаимодействуют с рецепторами мышечных, секреторных и многих других клеток, что приводит к сокращению гладкой мускулатуры, повышению проницаемости сосудов и отеку. Клинически реакции I типа проявляются преимущественно анафилаксией и атопическими заболеваниями. Реже наблюдают острую крапивницу и ангионевротические отеки. Развитие анафилаксии могут блокировать циркулирующие AT (IgM, IgG), способные в отличие от сорбированного IgE, быстрее связывать антиген (АГ). Но обычно они образуются в незначительных количествах, что дает аллергену возможность беспрепятственно достигать поверхности тучных клеток и базофилов с фиксированными на их поверхности IgE. Анафилактические реакции иммуноспецифичны и развиваются после попадания аллергена, к которому организм был предварительно сенсибилизирован. Состояние гиперчувствительности формируется через 7–14 суток после первого контакта с АГ и сохраняется годами. Реакции могут быть системными или местными. Системные проявления в виде анафилактического шока могут развиваться после попадания аллергена практически любым путем (подкожно, парентерально, ингаляционно). Проявления местных реакций – атопии. Их развитие обусловлено образованием IgE в ответ на длительное воздействие аллергенов. Клинически проявляются ринитом, конъюнктивитом, бронхиальной астмой, отеком Квинке.
Отметим, что вырабатываемый в слизистой оболочке полости носа SIgA осуществляет нейтрализацию аллергенов, ингибирование активации тучных клеток, уменьшение воспалительного ответа, уменьшение легочной эозинофилии, симптомов АР и приступов аллергической астмы. Он чрезвычайно важен при развитии острых респираторных заболеваний, т.к. известно, что ряд вирусов, его вызывающих, способствует запуску аллергического воспаления в дыхательных путях, начиная с полости носа.
Диагностика АР
В диагностике АР значительную роль играют следующие данные:
- профессиональный сбор анамнеза жизни, заболевания, семейного анамнеза;
- эндоскопия полости носа;
- клинический анализ крови;
- цитологическое исследование мазков из полости носа;
- культурологический анализ отделяемого из полости носа с определением чувствительности к антибиотикам;
- лучевая диагностика околоносовых пазух;
- постановка кожных проб со стандартными АГ;
- определение общего сывороточного и специфических IgE.
Для расширенной диагностики определяют уровни эозинофильного катионного протеина, внеклеточных пероксидаз и свободного гемоглобина в назальном секрете, проводят назальный провокационный тест с предполагаемым причинным АГ.
Дифференциальную диагностику выполняют прежде всего с неинфекционным неаллергическим ринитом (НАР), который является не-IgE-опосредованным заболеванием с хроническими носовыми симптомами, такими как заложенность, ринорея, чихание. Но для НАР характерно отсутствие такого типичного для АР назального симптома, как зуд. Эти симптомы возникают в связи с действием неаллергических, неинфекционных триггеров, таких как изменения погоды, воздействие резких запахов и сигаретного дыма, изменения атмосферного давления и т.д. У таких пациентов отсутствуют сопутствующие аллергические заболевания, а аллергенспецифические IgE с помощью кожных проб или лабораторных тестов не выявляют.
Выделено по меньшей мере 8 подтипов/фенотипов, соответствующих критериям НАР:
- неаллергическая ринопатия, ранее именуемая вазомоторным ринитом, или идиопатическим НАР;
- неаллергический ринит с эозинофильным синдромом (НАРЭС);
- атрофический ринит;
- ринит у лиц пожилого возраста (сенильный);
- ринит, вызванный пищей и алкоголем, «лекарственно-индуцированный НАР» вызывает усиление обструкции носа, которое наблюдают при длительном применении интраназальных сосудосуживающих средств;
- лекарственно-индуцированный ринит (в т.ч. и медикаментозный, вызванный применением β-адреноблокаторов/вазодилататоров/контрацептивов/аспирина, нестероидных противовоспалительных средств);
- гормональный ринит (наблюдают во время менструального цикла, полового созревания, беременности и при некоторых эндокринных заболеваниях, таких как гипотиреоз и акромегалия);
- идиопатический ринит (характеризуется гиперреактивностью верхних дыхательных путей к неспецифическим факторам окружающей среды, таким как изменения температуры воздуха и влажности, табачный дым, воздействие продуктов питания, парфюмерии, запахов, дыма и т.п.) [9–10];
- ринит при спонтанной утечке цереброспинальной жидкости.
В то же время АР может протекать совместно с НАРЭС.
Лечение АР
Целью лечения является облегчение симптомов АР и уменьшение проблем в повседневной жизни, вызванных АР. Ведение пациента с АР должно осуществляться в тандеме оториноларингологом и аллергологом-иммунологом.
Основные составляющие лечения АР:
- информирование пациента и профилактические мероприятия;
- элиминация аллергена;
- аллерген-специфическая иммунотерапия;
- медикаментозное лечение.
Информирование пациента
Информирование пациента о его заболевании должно начинаться на приеме у лечащего врача. Чем более подробную и полную информацию о заболевании и лечении предоставит врач пациенту в доступной для него форме, тем более ответственно и разумно пациент будет относиться к лечению. Осознанное восприятие состояния собственного здоровья приведет к наибольшим успехам в лечении и профилактике заболевания.
Информационные флаеры о заболевании, «школы пациентов», общественные организации, сообщество пациентов с АР и группы поддержки пациентов с конкретными заболеваниями – все эти формы информирования и поддержки пациентов актуальны и используются во многих странах. Их должен готовить психолог, способный настроить пациента на необходимость длительной и/или постоянной терапии АР; обосновать больному, что он не должен чувствовать себя ущербным или изгоем, т.к. АР нередко ведет к развитию депрессивного состояния; объяснить, что один препарат может не подойти в силу индивидуальных особенностей, а многообразие препаратов, предназначенных для лечения АР (особенно системных антигистаминных), существует для персонифицированного лечения. При этом при подборе лечения конкретному больному АР эффективными могут оказаться всего 1–3 препарата. В флаере необходимо приводить информацию об АР как о серьезном заболевании, требующем постоянного лечения.
Элиминация аллергена и барьерные методы
В большинстве случаев полностью исключить контакт с аллергеном не представляется возможным. Однако даже частичная элиминация аллергена облегчает течение заболевания, уменьшает потребность в количестве используемых лекарственных средств, в т.ч. и сильнодействующих. Помимо общеизвестных элиминационных мероприятий (регулярная обработка помещений акарицидами, фунгицидами и т.п.; использование пылесосов для уборки помещений с набором защитных фильтров, включая класс НЕРА; применение кварцевых ламп ионизаторов, ежедневная влажная уборка, увлажнение воздуха, смена наполнителя подушек на синтетический, исключение контакта с домашними животными, переезд на время цветения причинно-значимых растений в другую климатическую зону и т.д.) особое значение последнее время придается ирригационно-элиминационной терапии (ИЭТ) [11–12].
Применение готовых изотонических растворов на основе морской воды способствует поддержанию нормального физиологического состояния слизистой оболочки полости носа, разжижению слизи и нормализации ее выработки в бокаловидных клетках слизистой оболочки, улучшению функции мерцательного эпителия, удалению уличной и комнатной пыли, аллергенов и гаптенов со слизистой оболочки носа, уменьшает локальный воспалительный процесс и оказывает увлажняющее действие. Также использование ИЭТ с целью очищения полости носа рекомендуют перед применением топических интраназальных препаратов.
Барьерные методы имеют определенное преимущество для профилактики обострений АР. Препараты (Назаваль, Превалин, Аква Марис Эктоин) обладают барьерной и элиминирующей функциями, образуют защитный стабилизирующий слой на поверхности слизистой оболочки, препятствуют проникновению аллергенов, восстанавливают мукоцилиарный клиренс, нормализуют функции реснитчатого эпителия [13].
Аллерген-специфическая иммунотерапия (АСИТ)
АСИТ – основной метод патогенетического лечения связанных с IgE-опосредованным механизмом аллергических заболеваний, заключающийся в введении в организм пациента возрастающих доз аллергена, ответственного за клинические проявления заболевания у данного больного [2]. Эффективность этого вида терапии выражается в уменьшении или полном отсутствии клинических симптомов при естественной экспозиции аллергена. После использования АСИТ отмечают снижение выраженности и продолжительности обострения, снижение потребности в медикаментах, используемых при базисной и симптоматической терапии. Проведение АСИТ в ряде случаев позволяет предупреждать развитие бронхиальной астмы и расширение спектра аллергенов, к которым формируется повышенная чувствительность пациента. АСИТ действует как на раннюю, так и на позднюю фазу аллергического ответа, приводит к торможению аллерген-специфической реакции и угнетению тканевой гиперреактивности, проявляющейся повышением чувствительности к медиатору аллергии гистамину. Под действием АСИТ происходит подавление миграции эффекторных клеток в зону аллергического воспаления, возникает генерация регулирующих Т-лимфоцитов, способствующих индукции иммунологической толерантности, которая характеризуется подавлением пролиферативного и цитокинового ответов в отношении виновных аллергенов [13–15].
Отличие лечения ЛАР от классического АР заключается в отсутствии опыта проведения АСИТ при этой форме АР. В настоящее время известно только об одном исследовании, в ходе которого изучали эффективность АСИТ аллергеном луговых трав для пациентов с ЛАР, обусловленным сенсибилизацией к пыльце луговых трав [16].
Медикаменозное лечение
Терапия АР включает достаточно широкий спектр фармакологических препаратов, используемых как перорально, так и интраназально.
Топические препараты
Деконгенсанты. Короткие курсы (5–10 дней) лечения топическими деконгестантами назначают для снижения выраженной заложенности носа при обострении АР и для обеспечения доставки других местных препаратов, используемых в терапии. Препараты этой группы не эффективны в отношении зуда и чихания. К α1-адреномиметикам относятся фенилэфрин, фенилэфрина гидрохлорид, диметинден.
К α2-адреномиметикам относятся ксилометазолин, оксиметазолин, нафозолин, тетразолин. Деконгестанты рекомендовано с осторожностью назначать детям младше 2 лет, поскольку существующий интервал между терапевтической и токсической дозами в этой возрастной группе невелик. Лечение детей следует начинать с наиболее низких концентраций препарата. Так, назначать оксиметазолин или ксиметазолин следует с самых низких доз (0,05%) длительностью не более 5–7 дней. В отношении детей младше 2 лет отдают предпочтение препаратам на основе фенилэфрина. Необходимо помнить, что эти препараты имеют много противопоказаний и побочных эффектов. Применение новых форм препаратов этой группы, особенно без консервантов, использование дозированных аэрозолей позволят нивелировать местные побочные эффекты, снизить риск передозировки и развития медикаментозного ринита.
Интраназальные кромоны (стабилизаторы мембран тучных клеток). Натрия кромогликат (кромоглициевая кислота) менее эффективен, чем интраназальные кортикостероиды или антигистаминные средства. Препарат не вызывает побочных эффектов. Натрия кромогликат необходимо назначать 4–6 раз в сутки, что не всегда удобно для пациента.
Интраназальные блокаторы H1-гистаминовых рецепторов. Для азеластина и левокабастина характерно быстрое начало действия (<15 минут) Они оказывают только локальное действие. Их рекомендуют назначать при легких формах заболевания. Препараты применяют в отношении детей старше 5 лет в виде назального спрея; в виде глазных капель – для лечения аллергического конъюнктивита. Топические антигистаминные препараты значительно уменьшают ринорею и чихание. По эффективности препараты сравнимы с пероральными антигистаминными средствами. При местном введении в рекомендуемых дозах не оказывают седативного эффекта. Однако препарат азеластин имеет побочный эффект, проявляющийся кратковременным извращением вкуса.
Топические стериоды. Ингаляцион-ные глюкокортикостероиды (ИГКС) не угнетают мукоцилиарную активность эпителия. Они уменьшают все симптомы АР и также могут быть эффективными в отношении глазных симптомов, сопровождающих АР. При заложенности носа терапию рекомендуют начинать с ИГКС, т.к. эти препараты более эффективны, чем любые другие лекарственные средства, в устранении причины заложенности носа – подлежащего аллергического воспаления. Действие ГКС начинается через 7–8 часов, но достигает максимума через 2 недели. Однако скорость действия интраназальных ГКС может быть выше, чем считалось ранее; у некоторых пациентов эффект проявляется в течение 2 часов. При выборе конкретного препарата отдают предпочтение лекарственным средствам, обладающим высокой топической активностью, низкой системной биодоступностью, минимальной у интраназальных кортикостероидов последних поколений (мометазона фуроат, флутиказона фуроат). При интраназальном применении они практически не определяются в плазме крови. Этот факт дает возможность применения относительно длительных и частых курсов терапии. Что касается состояния слизистой оболочки полости носа, то, согласно инструкции к препарату, после 12-месячного лечения назальным спреем мометазона фуроата не возникало признаков атрофии слизистой оболочки носа; кроме того, мометазона фуроат проявлял тенденцию способствовать нормализации гистологической картины при исследовании биоптатов слизистой оболочки носа. Однако не стоит забывать: при изначальных аномалиях в архитектонике полости носа, индивидуальных особенностях пациента, чрезмерной лекарственной нагрузке на слизистую оболочку полости носа риск атрофии слизистой оболочки и вероятность носовых кровотечений при применении топических ГКС существует [17]. Во избежание этих побочных явлений следует при использовании обучить пациентов правилу креста: введение препарата в левую половину носа правой рукой, а в правую левой, направляя головку распылителя на латеральную стенку полости носа.
Системные препараты
Блокаторы H1-гистаминовых рецепторов. Блокаторы H1-гистаминовых рецепторов I поколения (хлороперамин, диметинден, дифенгидрамин, клемастин) имеют ряд побочных эффектов, таких как сонливость, сухость во рту, слабость, но обладают моментальным эффектом при чихании и водянистом отделяемом из носа. Антигистаминные препараты I поколения противопоказаны пациентам с глаукомой, гиперплазией предстательной железы и астмой ввиду их потенциального антихолинергического действия. Они в меньшей степени угнетают функцию центральной нервной системы у детей, нежели у взрослых [9]. Следует проявлять особую осторожность в отношении возможности проявления возбуждающих эффектов, таких как судороги.
Блокаторы H1-гистаминовых рецепторов II поколения, такие как оксатомид, азеластин, меквитазин, эффективны в отношении заложенности носа, но не окажут действия при чихании и ринорее. Их прием может оказаться причиной таких же побочных эффектов, как и у блокаторов H1-гистаминовых рецепторов I поколения (сонливость, вялость, головокружение, сухость во рту).
У современных препаратов этой группы (цетиризин, фексофенадин, лоратадин) вышеуказанные побочные эффекты сведены к минимуму [18]. Блокаторы H1-гистаминовых рецепторов II поколения обладают мягким, отсроченным и продолжительным действием, для должного достижения которого требуется около 2 недель.
Антагонисты лейкотриеновых рецепторов (антилейкотриены). Пептидные лейкотриены, продуцируемые и высвобождаемые тучными клетками, эозинофилами и макрофагами, оказывают мощное расслабляющее действие на гладкие мышцы сосудов слизистой оболочки носа, увеличивают проницаемость сосудов и стимулируют миграцию эозинофилов.
Антилейкотриены пранлукаст и монтелукаст подавляют вазодилатацию и снижают проницаемость слизистой оболочки полости носа, как следствие – уменьшают заложенность носа. При заложенности носа препараты этой группы более эффективны, чем антигистаминные препараты II поколения. Их эффект отмечают через 1 неделю после начала перорального приема, который достигает максимума через 4 недели [19]. Подавление эозинофильной инфильтрации, значительное уменьшение отделяемого из носа и приступов чихания происходят при применении более 2 недель.
К основным показаниям к их применению относятся АР легкой или средней степени тяжести, ЛАР с назальной обструкцией в качестве основной жалобы. Никаких побочных эффектов и сонливости при их приеме не возникает.
Антагонисты D2-простагландиновых/A2-тромбоксановых рецепторов. Препарат раматробан усиливает проницаемость сосудов слизистой оболочки носа, блокируя рецепторы тромбоксана, подавляет миграцию эозинофилов, а также миграцию эозинофилов, блокируя CRTh2 (рецептор-хемоаттрактант – гомологичный рецептор, экспрессируемый на Th2-клетке рецептора простагландина D2). Раматробан оказывает сильное отсроченное воздействие при заложенности носа.
Препарат не зарегистрирован на территории Российской Федерации, однако некоторые пациенты имеют опыт его применения.
Системные ГКС. Преднизолон и метилпреднизолон перорально назначают лишь в случае отсутствия эффекта от терапии остальными группами препаратов при среднетяжелой и тяжелой степенях АР. ГКС назначают короткими курсами в 4–7 дней по 20–40 мг/сут для взрослого пациента. В отсутствие эффекта от применения препаратов этой группы показано хирургическое лечение.
Алгоритм ведения пациентов с АР, согласно форме и степени тяжести заболевания, представлен на рисунке.
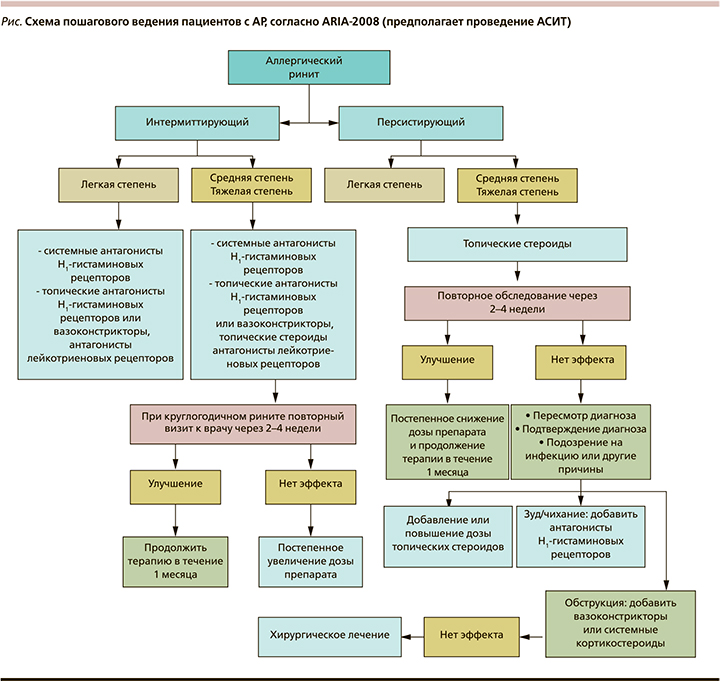
Ввиду широкого спектра препаратов, используемых при АР, практикующему врачу зачастую достаточно не просто рационально составить план лечения пациентов, страдающих данным заболеванием. Особенно это касается пациентов детского возраста. Желание врача максимально минимизировать симптоматику заболевания и улучшить качество жизни пациента приводит к назначению объемного перечня системных и топических препаратов. Как следствие – увеличивается лекарственная нагрузка на организм пациента, в частности на слизистую оболочку полости носа. Оборотной стороной медали является снижение приверженности пациента лечению. Он путается в назначениях и неосознанно нарушает режим дозирования препаратов. Обособленная проблема – это прием препаратов детьми, т.к. применение ими множества местных и системных препаратов невозможно в силу возрастных особенностей.
Выходом из сложившейся ситуации служит назначение комбинированных препаратов, широко представленных на рынке. В отношении АР и ЛАР удачной комбинацией является диметинден+фенилэфрин. Она рекомендована в качестве интраназального использования, содержит адреномиметик (фенилэфрин) и антигистаминный компонент (диментинден), что идеально в данном случае. Данную комбинацию можно использовать как взрослым, так и детям: в виде назального спрея и геля назначают взрослым и детям с 6 лет, в виде назальных капель – взрослым и детям с 1 года.
Эффективность комбинации диметинден+фенилэфрин была изучена в ряде исследований и наблюдений [20]. Ее применение позволяет уменьшать продолжительность применения системных антигистаминных препаратов второго поколения, предупреждать обострение АР, уменьшать фармакологическую нагрузку на пациента и увеличивать его приверженность лечению.
Заключение
По течению АР часто проявляется среднетяжелой и тяжелой формой, значительно нарушая качество жизни пациента (сон, работоспособность и т.п.). При АР основным плацдармом развития воспаления является слизистая оболочка, которая не только участвует в этом процессе, но и ее несовершенство (нарушения в строении плотных соединений эпителиальных клеток) может играть значительную роль в его этиологии. В связи с этим, основная направленность терапии должна быть ориентирована на местное использование лекарственных средств, особенно при ЛАР, что мы и наблюдаем в мировой практике. Назначение комплексных топических препаратов, улучшает комплаентность, а следовательно и эффективность лечения.



