Среди российских гастроэнтерологов традиционно популярны европейские консенсусы по эрадикации Helicobacter pylori. В январе 2017 г. в журнале Gut была опубликована официальная версия консенсуса Маастрихт-V [1], с некоторыми положениями которого мы вас ознакомим.
Раздел Маастрихта-V «Профилактика заболеваний»
Положение 1
Инфекция H. pylori признана значимым этиологическим фактором при раке желудка.
Уровень доказательности: 1а. Степень рекомендаций: А.
Положение 3
Эрадикация H. pylori снижает риск развития рака желудка.
Уровень доказательности: низкий. Степень рекомендаций: умеренная.
Хотя когортные работы постоянно указывают на то, что инфекция H. pylori считается мощным фактором риска развития рака желудка [2], доказательства того, что риск снижается после эрадикации H. pylori, до сих пор основаны на двух рандомизированных интервенционных исследованиях [3, 4].
Положение 7
Риск развития рака желудка может быть снижен более эффективно за счет применения эрадикационной терапии до развития атрофии и кишечной метаплазии.
Уровень доказательности: 2b. Степень рекомендаций: B.
Положение 12
Стратегия «скрининг-и-лечение» H. pylori рекомендуется лицам с повышенным риском развития рака желудка.
Уровень доказательности: умеренный. Степень рекомендаций: выраженная.
К лицам с «фенотипом рака желудка» относят пациентов с атрофическим гастритом в теле желудка. Скрининг на популяционной основе инвазивными подходами невозможен, но фенотип рака желудка может быть обнаружен с помощью комбинации неинвазивных маркеров, к которым относят серологическое определение H. pylori, содержания пепсиногенов и их соотношения [5].
Раздел Маастрихта-V «Лечение инфекции H. рylori»
Положение 1
Резистентность H. pylori к антибиотикам возрастает в большинстве регионов мира.
Уровень доказательности: средний. Степень рекомендаций: выраженная.
Существуют географические колебания резистентности H. pylori к антибиотикам. Например, резистентность H. pylori к кларитромицину составляет 30% в Италии и Японии, 40% – в Турции, но только около 15% – в Швеции и на Тайване [6].
Положение 4
В регионах с резистентностью H. pylori к кларитромицину выше 15% в качестве схемы первой линии для эрадикации рекомендуется квадротерапия с висмутом или конкомитантная терапия (ингибиторы протонной помпы – ИПП, амоксициллин, кларитромицин и метронидазол). В регионах с высокой резистентностью H. pylori к кларитромицину и метронидазолу для эрадикации целесообразно использовать квадротерапию с висмутом.
Уровень доказательности: низкий. Степень рекомендаций: выраженная.
Положение 5
Продолжительность применения квадротерапии с висмутом для терапии первой линии должна составлять 14 дней. В некоторых регионах длительность эрадикации с этой схемой в течение 10 дней может давать хорошие результаты.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
В настоящее время существует масса исследований, подтверждающих необходимость увеличения длительности эрадикационной терапии [7].
Положение 9
В регионах с низкой резистентностью H. pylori к кларитромицину в качестве терапии первой линии может применяться тройная схема. Альтернативной схемой служит квадротерапия с висмутом.
Уровень доказательности: высокий. Степень рекомендаций: выраженная.
Положение 10
Применение высоких доз ингибиторов протонной помпы 2 раза в день повышает эффективность тройной терапии. В Европе и Северной Америке наиболее высокие результаты в эрадикации H. pylori дает применение эзомепразола и рабепразола.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
В настоящее время доказано, что эффективность ингибиторов протонной помпы зависит от полиморфизма цитохрома 2С19. Следует заметить, что высокая доля быстрых метаболизаторов встречается среди европеоидов (56–81%). Для преодоления побочных явлений полиморфизма в системе цитохрома рекомендуется применять эзомепразол в дозе 40 мг 2 раза в сутки или рабепразол в дозе 20 мг 2 раза в сутки [8].
Положение 11
Продолжительность эрадикации при помощи тройной терапии с кларитромицином должна составлять 14 дней. В некоторых географических регионах хорошие результаты лечения могут давать менее продолжительные схемы.
Уровень доказательности: средний. Степень рекомендаций: выраженная.
Продолжительность эрадикации менее 14 дней может быть разрешена только в тех регионах, где продемонстрирована высокая эффективность лечения с тройной схемой [9].
Положение 12
В случае неудачи применения висмут-содержащей квадротерапии в качестве схемы второй линии для эрадикации целесообразно применять тройную терапию с фторхинолоном (ИПП+левофлоксацин+амоксицилин) или конкомитантную терапию.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
Положение 13
После неудачи тройной терапии в качестве схемы второй линии рекомендуется квадротерапия с висмутом или тройная терапия с фторхинолоном, или конкомитантная схема.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
Положение 15
После неудачи терапии второй линии необходимо выполнять определение генотипической резистентности H. pylori к антибиотикам с рекомендациями по выбору метода лечения.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
Раздел Маастрихта-V «H. pylori и микробиота желудка»
Положение 1
Микробиота желудка включает другие микробы кроме H. pylori.
Уровень доказательности: 2с. Степень рекомендаций: B.
Желудок, как и другие части желудочно-кишечного тракта, имеет собственную микробиоту. H. pylori – наиболее хорошо изученная, но не единственный ее представитель. Несколько современных исследований, выполненных при помощи молекулярных методов (16S rДНК секвенирующий анализ), позволили обнаружить в желудке около 100 видов бактерий.
У здоровых пациентов в желудке чаще обнаруживают Proteobacteria, Firmicutes, Bacteroidetes, Actinobacteria и Stretococcus [10]. В одном из исследований в желудке у 12 здоровых лиц было обнаружено 85 родов бактерий (рис. 1) [11].
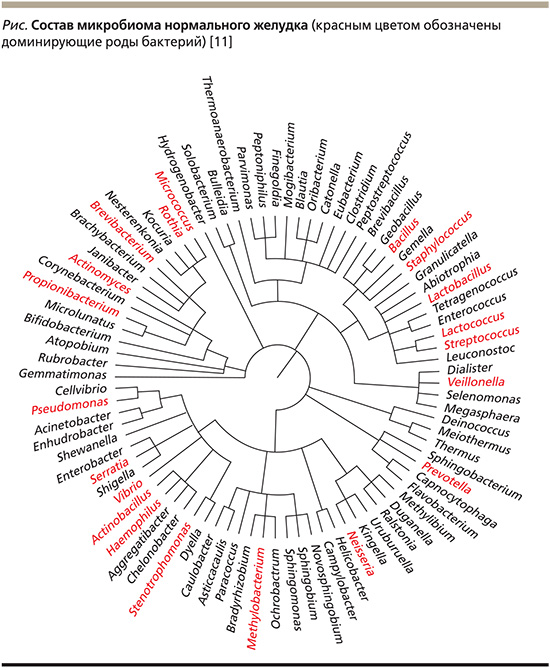
Положение 3
Компоненты микробиоты желудка могут играть роль в развитии H. pylori-ассоциированных заболеваний.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
Большое внимание в настоящее время уделяется изучению предраковых и онкологических заболеваний органов пищеварения [12, 13]. Наряду с изучением метаболических [14] и иммунных аспектов развития патологии [15, 16] роль микробиоты в настоящее время исследуется очень активно. В работе шведских ученых была определена микробиота у 10 больных раком желудка и у 5 лиц с диспепсией молекулярными методами. Секвенирование показало относительно низкое содержание H. pylori и доминирование у больных раком желудка анаэробных штаммов (клостридии, бактероиды), увеличение общего количества бактерий в желудке по сравнению с лицами с нормальной слизистой желудка [17].
В другом исследовании количество бактерий семейства Helicobacteraceae было значительно снижено в группе лиц с раком желудка по сравнению с пациентами с хроническим гастритом, в то время как число бактерий семейства Streptococcaceae значительно возросло. Разнообразие и плотность микробиоты желудка в группе пациентов с раком желудка были увеличены по сравнению со здоровыми лицами [18]. Эти и другие исследования показывают, что H. pylori может быть главным, но не единственным микробным триггером для различных заболеваний желудка. Другие микроорганизмы помимо H. pylori могут играть значительную роль в развитии предраковой и онкологической патологии [19].
Положение 9
Только некоторые пробиотики обладают способностью уменьшать побочные эффекты, вызванные эрадикацией H. pylori.
Уровень доказательности: средний. Степень рекомендаций: выраженная.
В настоящее время для снижения побочных эффектов эрадикации хорошо документирована эффективность пробиотиков, содержащих Lactobacillus [20] и Saccharomyces boulardii [21].
Положение 10
Некоторые пробиотики могут давать положительный эффект при эрадикации H. pylori.
Уровень доказательности: низкий. Степень рекомендаций: слабая.
Пробиотики могут угнетать H. pylori посредством нескольких механизмов, которые включают выделение антимикробных продуктов или конкуренцию за колонизацию и выживание.
В мета-анализах отмечается позитивное влияние пробиотиков на повышение эффективности эрадикации H. pylori [22]. Тем не менее в мета-анализах с разделением на группы только определенные штаммы показали свою значимость для эрадикации, включая Lactobacillus, Bifidobacterium и S. boulardii [20, 21].
Заключение
В настоящее время установлено, что лечение инфекции H. pylori имеет большое значение для профилактики рака желудка. В связи с повышающейся резистентностью H. pylori к антибиотикам на первый план эрадикационной терапии в мире выходят квадротерапия с висмутом и конкомитантная терапия. Возникает вопрос: каким образом рекомендации консенсуса Маастрихт-V по лечению могут быть интерпретированы для применения в России? Одним из аспектов гастродуоденальной патологии в России является относительно низкая резистентность H. pylori к кларитромицину, медиана которой не превышает 15%, в связи с чем в нашей клинической практике возможно широкое применение тройной схемы (ИПП+кларитромицин+амоксицилин)
в течение 10 дней [23]. Сейчас считается доказанным наличие в желудке здоровых людей массы микроорганизмов [24]. Международный (Киотский) консенсус по гастриту верифицировал эту точку зрения [25]. Европейский консенсус Маастрихт-V подтвердил рациональность этого подхода и рекомендовал применение пробиотиков, содержащих Lactobacillus и Bifidobacterium, а также S. boulardii для повышения эффективности эрадикации H. pylori и уменьшения частоты побочных эффектов антибактериальной терапии [1].



