Обоснование
За последние 40 лет 5-летняя выживаемость пациентов с диссеминированным раком желудка увеличилась, но остается низкой: менее одного из пяти пациентов выживает в течение 5 лет [1]. Для пациентов с прогрессирующим заболеванием на фоне первой линии терапии прогноз особенно неблагоприятный, средняя медиана выживаемости составляет всего 3 месяца при наилучшей поддерживающей терапии и приблизительно 4,0–5,3 месяца с применением химиотерапии (ХТ) второй линии. В большинстве международных исследований в качестве терапии второй линии используются иринотекан, доцетаксел и еженедельный паклитаксел, при этом общая выживаемость (ОВ) с ХТ одним агентом составляет от 4,0 до 9,5 месяцев. Следует отметить, что верхний предел выживаемости, приведенный в источниках литературы для второй линии и достигающий 9-месячного срока, получен в ходе японского исследования, где приблизительно 80% пациентов в последующем получали ХТ третьей линии. В других исследованиях ОВ была от 4,0 до 5,3 месяца [2].
Кроме того, для пациентов с прогрессирующим заболеванием при распространенном раке желудка или желудочно-кишечного перехода качество жизни и поддержание работоспособности являются ключевыми терапевтическими целями, поэтому не следует игнорировать токсичность ХТ.
В последние годы исследования молекулярных путей, вовлеченных в канцерогенез при раке желудка, привело к множеству исследований таргетной терапии. После успеха исследования ToGA [3], в котором добавление трастузумаба к дуплету ХТ привело к увеличению медианы ОВ до 16 месяцев для подгруппы HER2-положительных пациентов, активно исследовались различные таргетные препараты, нацеленные на путь ангиогенеза сосудистого эндотелиального фактора роста (VEGF) [4], путь фактора роста гепатоцитов (MET) [5], все ингибиторы фосфоинозитид-3-киназы (PI3K/mTOR) и другие препараты, нацеленные на семейство рецепторов эпидермального фактора роста (EGFR) [6]. До сих пор эти исследования таргетной терапии при раке желудка были разочаровывающими, только трастузумаб в первой линии и рамуцирумаб во второй, которые продемонстрировали клиническую пользу в показателях выживаемости, зарегистрированы и одобрены к применению во всех рекомендациях. Частично это может быть связано с отсутствием прогностических биомаркеров для большинства препаратов, за исключением трастузумаба. Кроме того, гетерогенность молекулярных изменений, наблюдаемых при гастроэзофагеальном раке во всем мире, еще больше усложняет результаты этих крупных многоцентровых исследований.
Ряд недавних публикаций ясно продемонстрировал, что существует ряд различных подгрупп рака желудка и желудочно-пищеводного рака в соответствии с геномными изменениями [7]. Такое исследование может позволить стратифицировать пациентов в будущих протоколах по изучению таргетной терапии, пока не будут выяснены лучшие прогностические биомаркеры.
Рамуцирумаб – полностью гуманизированное моноклональное антитело, направленное против рецептора-2 фактора роста эндотелия сосудов, является первым антиангиогенным таргетным агентом, продемонстрировавшим улучшение выживаемости в виде монотерапии или в комбинации с ХТ среди пациентов с диссеминированным раком желудка. Два больших исследования III фазы по изучению эффективности рамуцирумаба во второй линии лечения диссеминированного рака желудка уже хорошо изучены и проанализированы. Первым из них было исследование REGARD, международное рандомизированное многоцентровое плацебо-контролируемое исследование монотерапии рамуцирумабом, проведенное в период между 2009 и 2012 г. [8]. Частота объективных ответов при монотерапии рамуцирумабом составила только 4%, но частота достижения стабилизации заболевания была значительно выше, чем в группе плацебо (45 против 21%), что привело к значительно более высокому уровню контроля заболевания – 45 против 23%. Медиана ОВ была увеличена в группе рамуцирумаба до 5,2 месяца по сравнению с 3,8 в группе плацебо (частота сердечных сокращений – 0,776, 95% доверительный интервал [ДИ] – 0,603–0,998; р=0,047). Выживаемость без прогрессирования (ВБП) через 6 месяцев также улучшилась до 42% при применении рамуцирумаба по сравнению с 32% в группе с плацебо. Эти результаты сопоставимы с таковыми, полученными с использованием стандартной ХТ второй линии в этой популяции больных, однако выгодно отличаются меньшей токсичностью.
На основании этих результатов FDA (Food and Drug Administration) одобрило рамуцирумаб для лечения рака желудка и желудочно-кишечного перехода 14 апреля 2014 г.
В исследовании RAINBOW были отобраны 665 пациентов с диссеминированным раком желудка, прогрессирующих на терапии первой линии, для лечения в период с декабря 2010 по сентябрь 2012 г. [9]. Пациенты были рандомизированы для лечения либо паклитакселом в комбинации с рамуцирумабом, либо паклитакселом и плацебо. По результатам лечения ОВ была значительно выше в группе паклитаксел плюс рамуцирумаб (9,6 месяца, 95% ДИ – 8,5–10,8 месяца против 7,4, 95% ДИ – 6,3–8,4 месяца; отношение рисков [ОР]=0,807, 95% ДИ – 0,678–0,962; р=0,017) и в среднем медиана ВДП была улучшена до 4,4 месяца против 2,9 в группе с плацебо. Рамуцирумаб также улучшил показатель объективного ответа (28 против 16% с плацебо) и достиг уровня контроля заболеваний на 80% против 64 в группе с плацебо.
Таким образом, рамуцирумаб является первым антиангиогенным таргетным препаратом, улучшающим выживаемость в режиме монотерапии или в комбинации с паклитакселом в трудной популяции больных раком желудка и пищеводно-желудочного перехода после прогрессирования на фоне терапии первой линии. Лечение, как правило, хорошо переносится с ожидаемой токсичностью для антиангиогенного препарата. Хотя эту токсичность нельзя назвать незначительной, следует отметить, что число смертей, связанных с лечением, было низким, и в исследовании RAINBOW смертность, связанная с лечением, была одинаковой в группах как лечения, так и плацебо, всего 2%. Однако добавление рамуцирумаба поддерживало стабильное или улучшенное качество жизни дольше, чем плацебо. Потенциальный вариант без ХТ у пациентов в этой ситуации, которые могут иметь остаточную токсичность от ХТ или соматические противопоказания, служит очень желанным дополнением к доступным методам лечения, особенно когда поддержание качества жизни имеет первостепенное значение.
Как хорошо известно, биология заболевания варьируется по всему земному шару, поэтому географический регион может выступать в качестве суррогатного маркера чувствительности к конкретному антиангиогенному агенту.
Целью данного исследования было сопоставление данных рандомизированного клинического исследования и результатов, полученных в ходе реальной клинической практики.
Методы
Под нашим наблюдением находились 24 пациента. Из них 12 (50%) мужчин и 12 (50%) женщин. Возраст от 29 до 72 лет, медиана возраста – 52 года (95% ДИ – 43,56–60,32 года).
Локализация первичной опухоли: у 15 (62,5%) пациентов – тело желудка, у 4 (16,67%) – кардиальный отдел желудка, у 5 (20,83%) – антральный отдел желудка.
У 1 (4,17%) пациента аденокарцинома желудка была высокодифференцированной, у 3 (12,50%) – умеренно дифференцированной, у 10 (41,67%) – низкодифференцированной, у 8 (33,33%) – был верифицирован перстневидноклеточный рак и у 2 (8,33%) пациентов дифференцировка опухоли не определена.
У 10 пациентов 4-я стадия заболевания была диагностирована в момент первичной постановки диагноза, у остальных 14 пациентов время регистрации и 4-й стадии варьировалось от 1 до 27 месяцев. Медиана времени диагностирования 4-й стадии заболевания составила 2 месяца (95% ДИ – 0–11,44 месяца).
Только у 8 (33,33%) пациентов диссеминация процесса затрагивала менее 3 отдаленных очагов, у 16 (66,67%) метастазами было поражено более три органов. Брюшина была поражена у трети пациентов: у 8 (33,33%) из 24.
ECOG (Eastern Cooperative Oncology Group)-статус на момент начала терапии у 21 (87,5%) пациента был равен 1, у 3 (12,5%) – 2.
У 10 (41,67%) пациентов на момент начала лечения была зарегистрирована анемия, по данным клинического анализа крови, у 14 (58,33) пациентов показатели крови были в пределах референсных значений.
Все пациенты получили первую линию лечения. Длительность первой линии терапии варьировалась от 3 до 11 месяцев; медиана длительности терапии первой линии составила 5 месяцев (95% ДИ – 4,00–6,83 месяца).
Больным в качестве второй линии терапии был проведен режим рамуцирумаб+паклитаксел.
Результаты
Длительность терапии рамуцирумабом варьировалась от 2 до 16 месяцев; медиана длительности терапии составила 5,0 месяцев (95% ДИ – 3,00–7,44 месяца).
На фоне терапии рамуцирумабом у 11 (45,83%) пациентов зарегистрирована стабилизация опухолевого процесса, у 3 (12,50%) – частичный ответ, у 4 (16,67%) – прогрессирование процесса и у 6 (25,00%) пациентов оценка эффективности терапии не проводилась в связи с ухудшением общего состояния на фоне лечения. Таким образом, частота объективного ответа составила 58,33%.
Медиана ОВ составила 18 месяцев (95% ДИ – 14–23 месяца; см. рисунок).
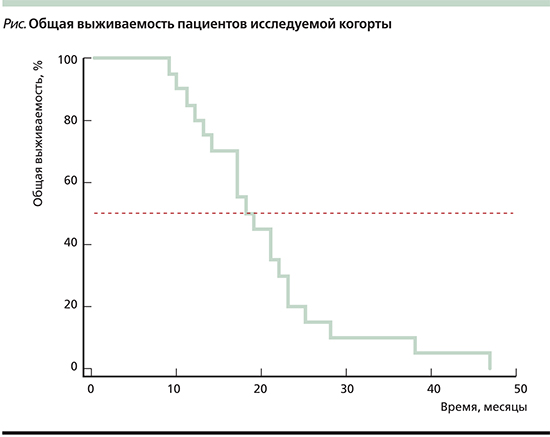
Обсуждение
Как и в большинстве исследований, пациенты, отобранные в RAINBOW и REGARD, были моложе и «здоровее», чем большинство больных раком желудка на момент начала второй линии, и вопрос о том, будет ли эффективен препарат в реальной клинической практике, остается нерешенным. Согласно данным исследования RAINBOW, медиана времени до прогрессирования составила 4,4 месяца. В реальной клинической практике- медиана длительности терапии достигла 5,0 месяцев. Показатель объективного ответа в международном исследовании составил 28%, в нашем исследовании практически у половины (45,83%) пациентов зарегистрирована стабилизация опухолевого процесса, а в 12,50% случаев – частичный ответ. Данные о выживаемости в RAINBOW были проанализированы в соответствии с географическим регионом, путем сравнения азиатских и неазиатских пациентов. Преимущество общей выживаемости не было значительным для азиатских пациентов, хотя время до прогрессирования оставался значительно улучшенным, это различие можно объяснить более широким использованием терапии третьей линии после прекращения исследования у азиатских пациентов по сравнению с неазиатскими пациентами (почти 70% против почти 40%).
Заключение
Полученные показатели ОВ больных (медиана – 18 месяцев) и длительность терапии рамуцирумабом+паклитаксел (2–16 месяцев) сопоставимы с результатами рандомизированного регистрационного исследования RAINBOW, что делает приемлемым применение данного лекарственного подхода в реальной клинической практике.



