Введение
Хроническая обструктивная болезнь легких (ХОБЛ) остается одной из важнейших проблем современного здравоохранения. Согласно прогнозам экспертов, к 2030 г. заболевание займет третье место среди причин смертности в мире [1]. ХОБЛ представляет собой гетерогенное заболевание, к характерным чертам которого относятся стойкие респираторные симптомы и бронхиальная обструкция, возникающие в результате патологии дыхательных путей и/или альвеол. Наиболее частой причиной данных изменений служит значимое воздействие повреждающих частиц и газов [2]. Течение заболевания характеризуется периодически возникающими обострениями, приводящими к более быстрому прогрессированию заболевания и являющимися ведущей причиной обращения больных ХОБЛ за медицинской помощью, госпитализаций и летальных исходов [3, 4]. Только в США затраты, связанные с заболеванием, превышают 50 млрд долл. в год, большинство из которых приходится на лечение обострений [5]. Как свидетельствуют результаты проведенных исследований, отмечается слабая корреляция между нарушениями вентиляционной функции легких и частотой обострений ХОБЛ, лучшим предиктором развития будущих обострений является их частота в прошлом [6]. Согласно современным представлениям, бóльшая часть обострений ХОБЛ имеет инфекционную природу, вместе с тем показания к назначению антимикробных препаратов (АМП) и их выбор в данной клинической ситуации зачастую служат предметом дискуссий. Обсуждению этих вопросов и посвящена представленная статья.
Этиология и патогенез
Результаты проведенных исследований свидетельствуют, что до 70−80% случаев обострений ХОБЛ обусловлены бактериальной и вирусной инфекцией респираторного тракта (рис. 1). Основные неинфекционные причины обострения: воздействие аэрополлютантов окружающей среды, низкая приверженность пациентов лечению, декомпенсация сердечной деятельности, ошибочное назначение лекарственных препаратов и др. Ключевое место в развитии инфекционных обострений ХОБЛ занимают бактериальные возбудители, среди которых ведущая роль принадлежит нетипируемой Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis, при тяжелой ХОБЛ – Pseudomonas aeruginosa [8].
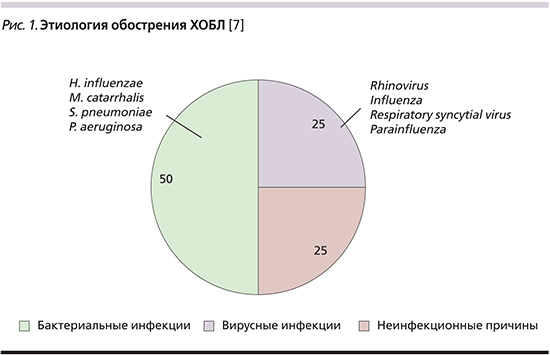
Структура возбудителей в значительной степени коррелирует с имеющимися у пациента нарушениями вентиляционной функции легких. При выраженной бронхиальной обструкции из образцов мокроты пациентов чаще выделяются пенициллинорезистентные S. pneumoniae (ПРП), β-лактамазопродуцирующие штаммы H. influenzae. Наличие бронхоэктазов ассоциируется с колонизацией бронхиального дерева P. aeruginosa, особенно в сочетании с крайне тяжелыми нарушениями бронхиальной проходимости. Этиологическое значение представителей семейства Enterobacteriaceae и Staphylococcus aureus, несмотря на частое выделение данных возбудителей при бактериологическом исследовании образцов мокроты пациентов с обострением ХОБЛ, остается неясным. Роль «атипичных» бактерий (Chlamydophila pneumoniae и Mycoplasma pneumoniae) в развитии обострений заболеваний представляется достаточно скромной: согласно результатам проведенных исследований, данные микроорганизмы ответственны менее чем за 5% обострений [8].
Следует отметить, что взгляды на роль бактериальной инфекции в патогенезе обострений ХОБЛ неоднократно менялись: от признания ведущей роли инфекционных агентов в возникновении обострений заболевания до отрицания причинно-следственной связи между выявлением бактерий в секрете дыхательных путей и усилением выраженности симптомов. Известно, что структурные изменения бронхов, а также нарушение местного противоинфекционного иммунитета при ХОБЛ создают условия для колонизации бактериальных агентов на поверхности эпителия дыхательных путей (в нормальных условиях дыхательные пути дистальнее гортани стерильные), результатом чего является прогрессирование эндобронхиального воспаления. В предшествующие годы преходящее усугубление клинических проявлений заболевания преимущественно объяснялось периодически возрастающей «микробной нагрузкой» на дыхательные пути. Вместе с тем получены и доказательства того, что возникновение обострений ХОБЛ ассоциируется с «приобретением» пациентом новых штаммов бактерий, к которым организм еще не приобрел действенного противоинфекционного иммунитета. Развитие иммунологических реакций в этом случае и является фактором, приводящим к появлению клинической картины обострения заболевания [9]. Необходимо отметить, что при микробиологическом исследовании образцов мокроты невозможно разграничить «колонизирующие» микроорганизмы и микроорганизмы, ответственные за развитие обострений, что ограничивает диагностическую ценность данного метода диагностики и определяет нецелесообразность его рутинного использования при обострении ХОБЛ. Исследование рекомендуется при наличии у пациента факторов риска инфекции, вызванной P. aeruginosa, неэффективности антибактериальной терапии (АБТ) в случае существующей уверенности в инфекционной этиологии обострений, при наличии или угрозе возникновения острой дыхательной недостаточности.
Диагностика бактериального обострения ХОБЛ
Обострение ХОБЛ – это острое событие, характеризующееся ухудшением респираторных симптомов и приводящее к изменению режима используемой терапии [2].
К основным признакам, характеризующим обострение заболевания, относятся критерии, предложенные N.R. Anthonisen et al. [10]:
- появление или усиление одышки;
- увеличение объема отделяемой мокроты;
- усиление гнойности мокроты.
Наличие всех трех вышеуказанных критериев описывается как I тип, двух из них – как II, одного – как III тип обострения заболевания [10].
Актуальность разграничения бактериально зависимых обострений ХОБЛ от обострений заболевания другой этиологии определяется прежде всего необходимостью решения вопроса о целесообразности назначения антибиотиков. Было показано, что при I и II типах обострения имеет место клиническое преимущество АБТ перед плацебо; напротив, при III типе превосходства антибиотиков перед плацебо продемонстрировать не удалось [10]. Микробиологическое исследование мокроты, как уже было отмечено, не позволяет идентифицировать тип обострения. Определение уровня биомаркеров, имеющих высокую корреляцию с бактериальной инфекцией при пневмонии и сепсисе (С-реактивный белок, прокальцитонин), имеет ограниченное значение при обострении ХОБЛ. Наиболее простым и надежным признаком бактериальной природы обострения, как свидетельствуют результаты исследований, остается наличие гнойной мокроты [11]. Именно клиническая картина обострения ХОБЛ служит решающим фактором, определяющим тактику ведения пациентов.
Следует отметить, что для большой части бактериальных обострений ХОБЛ характерно спонтанное разрешение симптомов, что связано с особенностями развития воспаления и иммунологических реакций при данном заболевании. Вместе с тем обострения ХОБЛ имеют существенное медико-социальное значение, связанное не только с их влиянием на качество жизни больных и темпы прогрессирования заболевания, но и с высокой летальностью данной категории пациентов. Так, госпитальная летальность колеблется от 4 до 10%, достигая 24% у пациентов отделений интенсивной терапии и реанимации (ОРИТ). Еще более пессимистично оценивается долговременный прогноз больных, госпитализированных по поводу тяжелого обострения ХОБЛ, летальность среди которых в течение ближайшего года приближается к 40% [12]. Результаты проведенных исследований свидетельствуют, что отсутствие своевременного назначения АМП при бактериальных обострениях ХОБЛ сопровождается увеличением вероятности терапевтической неудачи, госпитализаций, рецидивов [13].
Антибактериальная терапия
К настоящему времени выполнена масса контролируемых клинических исследований, посвященных оценке эффективности антибиотиков при обострении ХОБЛ. Наиболее значимым из них стало выполненное еще в 1987 г. исследование N.R. Anthonisen et al. [10]. Результаты, полученные в ходе исследования, позволили сформулировать основные показания к назначению АБТ в данной клинической ситуации. Дополнительные доказательства целесообразности применения АМП получены при мета-анализе 19 рандомизированных плацебо-контролируемых исследований, включившем 2663 пациента с обострением ХОБЛ [14]. Было показано, что при сравнении с плацебо применение антибиотиков при обострении заболевания ассоциируется со значительным уменьшением вероятности терапевтической неудачи как у амбулаторных, так и у госпитализированных пациентов [14]. Результаты 5 рандомизированных плацебо-контролируемых исследований, опубликованных после 2010 г. и включенных в данный мета-анализ, представлены в табл. 1.
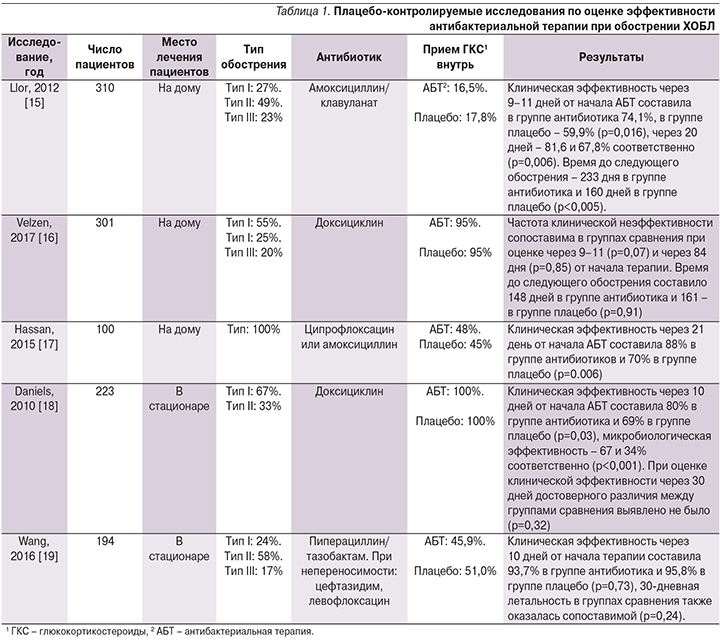
Как свидетельствуют результаты представленных исследований, эффективность АБТ при обострении ХОБЛ не всегда однозначна, что может быть объяснено включением в исследования пациентов с III типом обострения без гнойной мокроты. Так, в исследовании J.X. Wang et al. число пациентов, продуцирующих гнойную мокроту, составило лишь 26,3% в группе АБТ и 24% в группе плацебо [19]. Кроме того, следует учесть частый прием пациентами, включенными в данные исследования, системных ГКС. В ряде исследований было показано, что использование этих препаратов может ассоциироваться с увеличением частоты терапевтических неудач при обострении ХОБЛ бактериальной этиологии [20, 21]. Еще одним значимым фактором, определяющим эффективность АБТ, служат выбор антибиотика, его фармакодинамические и фармакокинетические особенности. Так, например, микробиологическая эффективность доксициклина в исследовании J.M. Daniels et al. оказалась весьма скромной и составила лишь 67% [18].
О целесообразности назначения АМП при обострении ХОБЛ свидетельствуют и результаты когортных исследований. Так, в ходе ретроспективного когортного исследования, включившего 84 621 госпитализированного пациента с обострением ХОБЛ, проведено сравнение исходов лечения при раннем (первые два дня госпитализации) и позднем применении антибиотиков (либо в его отсутствие). Вероятность терапевтической неудачи оказалась ниже в группе пациентов, получавших АБТ [22]. Кроме того, в ходе еще одного когортного исследования показана связь между применением антибиотиков и снижением риска летальности среди госпитализированных пациентов, а также уменьшением частоты повторных госпитализаций [23].
Согласно современным рекомендациям, показаниями к назначению АБТ при обострении ХОБЛ служат [2]:
- Обострение I типа;
- Обострение II типа, одним из клинических признаков которого является выделение гнойной мокроты;
- Обострение ХОБЛ, требующее проведения неинвазивной или искусственной вентиляции легких.
Нецелесообразно назначение антибиотиков при I типе обострения ХОБЛ.
Рекомендации по выбору АМП
Помимо определения показаний к назначению АБТ необходимо рассмотреть и достаточно сложный вопрос выбора антибиотика.
Эмпирическая АБТ обострения ХОБЛ предусматривает выбор препаратов, активных в отношении наиболее вероятных бактериальных возбудителей с учетом распространенности и механизмов их приобретенной устойчивости к различным классам АМП. Наиболее часто в данной клинической ситуации используются β-лактамы (аминопенициллины, амоксициллин/клавуланат, цефалоспорины II–III поколений), макролиды (азитромицин, кларитромицин) и респираторные фторхинолоны (левофлоксацин, моксифлоксацин). Применение в Российской Федерации (РФ) тетрациклинов и триметоприма/сульфаметоксазола ограничивает высокая частота выделения резистентных к ним штаммов S. pneumoniae. Необходимо отметить, что недавно полученные данные мониторинга устойчивости пневмококка к АМП свидетельствуют о распространении в РФ штаммов возбудителя, резистентных к макролидным антибиотикам. Так, среди штаммов S. pneumoniae, включенных в исследование SOAR в 2014–2016 гг., частота выделения штаммов, устойчивых к азитромицину и кларитромицину, составила 31,2% [24]. Вместе с тем сохраняется высокая чувствительность пневмококка к β-лактамам и респираторным фторхинолонам. Среди штаммов возбудителя, включенных в исследование ПеГАС-IV в 2010–2013 гг. (n=430), чувствительные к пенициллину штаммы составили 95,3%, к амоксициллину − 96,3%. Все исследованные штаммы S. pneumoniae были чувствительными к респираторным фторхинолонам [25]. Те же классы АМП обладают высокой природной активностью в отношении гемофильной палочки. Согласно данным, полученным в ходе исследования ПеГАС-IV, частота выделения штаммов H. influenzae, устойчивых к амоксициллину/клавуланату, в РФ составила менее 1%. Штаммов возбудителя, устойчивых к респираторным фторхинолонам, выявлено не было [26]. Следует отметить, что, несмотря на общие тенденции, профиль устойчивости респираторных возбудителей может отличаться в отдельных регионах, поэтому при выборе антибиотиков наиболее целесообразно руководствоваться локальными данными о резистентности микроорганизмов к АМП.
При мета-анализе 19 рандомизированных контролируемых исследований, посвященных оценке эффективности использования антибиотиков разных классов при обострении хронического бронхита и ХОБЛ, была показана меньшая клиническая эффективность макролидов по сравнению с таковой респираторных фторхинолонов для пациентов с подтвержденной бактериальной этиологией обострения [27]. Недостаточная активность макролидных антибиотиков в отношении штаммов H. influenzae, выделенных у пациентов с обострением ХОБЛ, продемонстрирована в ходе недавно опубликованного исследования M.M. Pettigrew et al. [28]. При этом следует учитывать, что природная активность макролидов в отношении H. influenzae невысока и присутствует лишь у азитромицина и в меньшей степени у кларитромицина. Вышеуказанные данные свидетельствуют о необходимости взвешенного подхода к назначению данного класса АМП при обострении ХОБЛ. Назначение азитромицина и кларитромицина в данной клинической ситуации может быть оправданно при непереносимости β-лактамных антибиотиков и отсутствии факторов риска инфицирования антибиотикорезистентными возбудителями, ведущим из которых является прием АМП в течение предшествовавших 3 месяцев [29]. Вместе с тем, как свидетельствуют результаты мета-анализа рандомизированных контролируемых исследований, наибольшая эффективность АБТ при обострении ХОБЛ отмечается при применении амоксициллина/клавуланата и респираторных фторхинолонов [30]. Однако необходимость ограничения роста резистентности микроорганизмов, предупреждения возникновения нежелательных лекарственных реакций определяет необходимость выделения категорий пациентов, для которых применение данных антибиотиков будет наиболее целесообразным.
В связи с этим важно определение факторов осложненного течения ХОБЛ, при котором увеличивается частота выделения резистентных микроорганизмов, повышается вероятность терапевтической неудачи лечения обострения и для купирования симптомов которого рекомендуется использовать амоксициллин/клавуланат или респираторные фторхинолоны. Признаки осложненного течения заболевания: возраст пациента ≥65 лет и/или выраженные нарушения вентиляционной функции легких (объем форсированного выдоха за 1 секунду − ОФВ1<50% от должных значений), и/или наличие серьезных сопутствующих заболеваний сердечно-сосудистой системы, и/или 2 и более обострений в течение года, и/или госпитализации по поводу обострения в предшествовавшие 12 месяцев, длительная кислородотерапия.
Доминирующую роль P. aeruginosa в этиологии обострения ХОБЛ при осложненном течении заболевания следует предполагать при наличии по меньшей мере двух из числа указанных признаков:
- Крайне тяжелые нарушения бронхиальной проходимости (ОФВ1<30% от должных значений);
- Ггоспитализация в течение предшествовавших 12 месяцев;
- Прием АМП в течение предшествовавших 3 месяцев;
- Прием ГКС внутрь (преднизолон >10 мг/сут в течение 2 недель) в течение предшествовавших 3 месяцев;
- Наличие бронхоэктазов;
- Предшествовавшее выделение P. aeruginosa из мокроты.
Наличие факторов риска P. aeru-ginosa-инфекции предполагает назначение препаратов с антисинегнойной активностью.
Один из вариантов алгоритма ведения пациентов с обострением ХОБЛ, предложенный американскими экспертами, представлен на рис. 2.
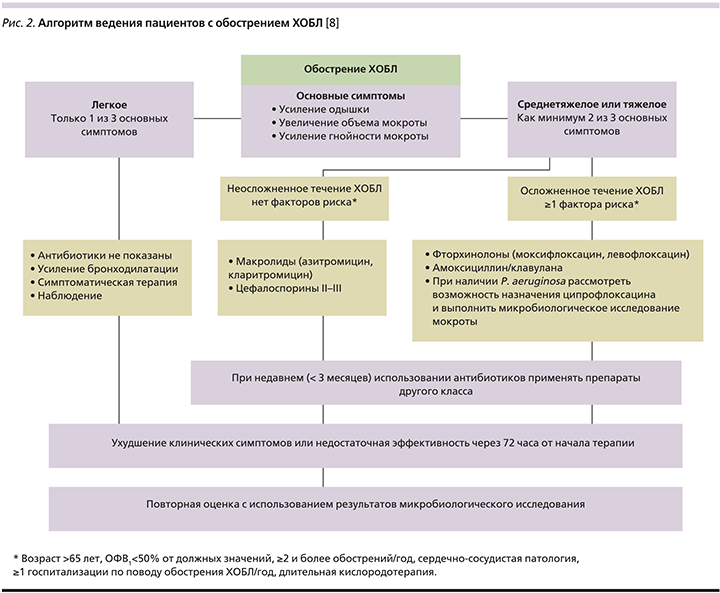
Назначение антибиотиков показано при наличии по меньшей мере двух из трех основных критериев обострения ХОБЛ. Выбор АБТ определяется наличием/отсутствием у пациента признаков осложненного течения заболевания и факторов риска P. aeruginosa-инфекции. При этом следует обратить внимание на тот факт, что американские эксперты рекомендуют соблюдать принцип «ротации»: при недавнем (<3месяцев) использовании антибиотика следует применять препарат другого класса.
Выбор АМП при лечении обострения ХОБЛ в условиях стационара предусматривает обязательную оценку наличия у пациентов факторов риска P. aeruginosa-инфекции (рис. 3).
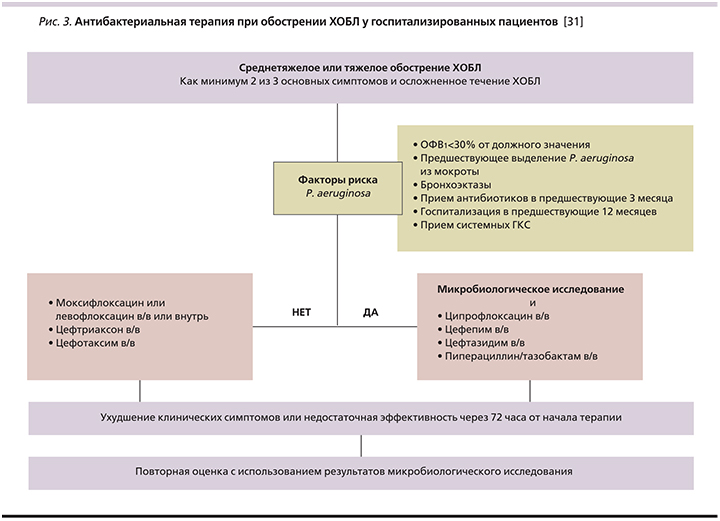
Еще один алгоритм выбора тактики АБТ при обострении ХОБЛ предложен экспертами Европейского респираторного общества ERS (European Respiratory Society) и Европейского общества по клинической микробиологии и инфекционным заболеваниям ESCMID (European Society of Clinical icrobiology and Infectious Diseases) рис. 4).
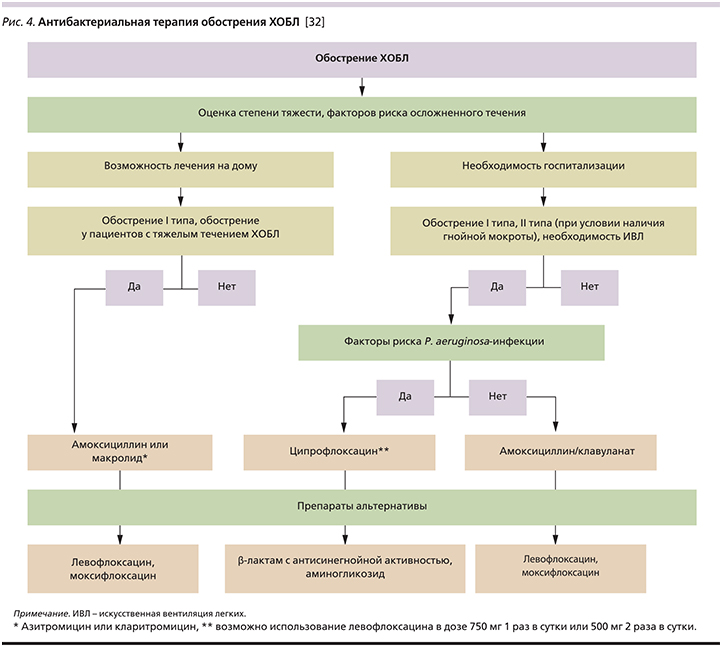
Обосновывая тактику ведения больных, перенесщих обострение ХОБЛ, эксперты также выделяют три категории пациентов:
- Пациенты с обострением заболевания, не требующим лечения в условиях стационара;
- Госпитализированные пациенты без факторов риска P. aeruginosa-инфекции;
- Госпитализированные пациенты с факторами риска P. aeruginosa-инфекции.
В качестве препаратов выбора для лечения обострения ХОБЛ в амбулаторных условиях европейские эксперты рекомендуют амоксициллин или макролид (азитромицин, кларитромицин). Кроме того, эксперты предлагают использовать при обострении ХОБЛ тетрациклин. Частота выделения тетрациклинорезистентных штаммов S. pneumoniae в РФ составляет 31,2% [25], что не позволяет рекомендовать тетрациклин в качестве препарата выбора или даже альтернативы для лечения пациентов данной категории. Основным же антибиотиком для госпитализированных пациентов без факторов риска P. aeruginosa-инфекции остается амоксициллин/клавуланат [32]. Его популярным воспроизведенным препаратом является Амоксиклав®, обладающий терапевтической эквивалентностью с референтным антибиотиком.
Доминирующая роль P. aeruginosa в этиологии обострения ХОБЛ у пациентов третьей группы определяет выбор ципрофлоксацина в качестве терапии I линии в данной клинической ситуации. В случае применения левофлоксацина режим дозирования препарата должен быть 750 мг 1 раз в сутки или 500 мг 2 раза в сутки. При необходимости парентерального введения антибиотиков может быть назначен β-лактам, обладающий активностью в отношении синегнойной палочки, или аминогликозид. Путь введения препаратов выбирается, исходя из степени тяжести обострения. Переход с парентерального введения на пероральный прием антибиотика осуществляется при стабилизации состояния пациента, как правило, на 3-й день терапии [32].
Рекомендации по выбору АБТ при обострении ХОБЛ, предложенные экспертами Российского респираторного общества на страницах федеральных клинических рекомендаций (пересмотр 2018 г.), представлены в табл. 2. Данный документ утвержден научно-практическим советом Министерства здравоохранения РФ и размещен на сайте ведомства [33].
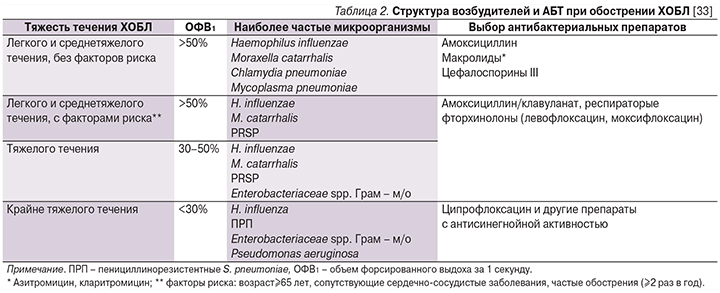
Отечественные эксперты также обращают внимание на взаимосвязь структуры возбудителей, имеющихся у пациента нарушений вентиляционной функции легких и предлагают в качестве основных препаратов для лечения обострения ХОБЛ использовать амоксициллина/клавуланат и респираторные фторхинолоны (левофлоксацин, моксифлоксацин) [33].
Заключение
Таким образом, резюмируя современные подходы к тактике ведения пациентов с обострением ХОБЛ, следует отметить, что основным критерием принятия решения о необходимости назначения АМП остается клиническая картина заболевания. Следует неукоснительно соблюдать один из основных принципов АБТ – назначать антибиотики только при бактериальной инфекции. Выбор того или иного препарата определяется наличием или отсутствием у пациента факторов риска этиологической значимости резистентных возбудителей и вероятности терапевтической неудачи. В условиях продолжающегося роста устойчивости ключевых респираторных патогенов к АМП, необходимым условием правильного выбора антибиотика является оценка регионального (при возможности и локального) профиля антибиотикорезистентности микроорганизмов.


