Введение
Гастроинтестинальные стромальные опухоли (ГИСО) представляют собой редкую группу опухолей желудочно-кишечного тракта. Они имеют мезенхимальное происхождение, потенциально злокачественные и располагающиеся под слизистой оболочкой. Согласно мировой статистике, ежегодно выявляют примерно 10–20 новых случаев на 1 млн человек [1, 2]. ГИСО могут быть различной локализации и встречаются чаще у пациентов после 50 лет в желудке (51%), тонкой (36%), толстой (7%) и прямой (5%) кишке [2, 3]. Для ГИСО нехарактерно лимфогенное метастазирование. Диссеминация опухоли при прогрессировании заболевания происходит гематогенным путем с преимущественным поражением печени, сальника и брюшины.
Несколько факторов имеют прогностическое значение при оценке степени злокачественности ГИСО и риска возможного метастазирования. Наиболее значимы размер и локализация опухоли, а также индекс митотической активности, который определяется по результатам гистологического исследования путем подсчета числа митозов в 50 полях зрения при большом увеличении микроскопа (см. таблицу). По данным литературы, митотический индекс коррелирует с размером новообразования, что позволяет первично предполагать характер опухоли по косвенным данным и определять тактику лечения [4, 5].

В зависимости от размеров опухоли в настоящее время выделяют микро-, мини- и клинически значимые ГИСО [5]. Микро-ГИСО представляют собой опухоли менее 1 см. Они редко выявляются при эндоскопическом исследовании, однако являются довольно частыми находками (10–35%) на патологоанатомическом исследовании пациентов среднего возраста. Мини-ГИСО – это опухоли размером от 1 до 2 см. Опухоли таких размеров, как правило, доступны визуализации и своевременной диагностике, но подходы к лечению вплоть до настоящего времени четко не определены. Обычно у пациентов с мини- и микро-ГИСО нет клинических проявлений, и редко отмечается генерализация заболевания. Это подтверждается данными одного из исследований, в котором сравнивали результаты лечения больных ГИСО размером менее 2 (101 пациент) и более 2 см (170 больных).
В большинстве опухолей размером менее 1 см не было выявлено митотической активности [6].
К клинически значимым ГИСО относят новообразования размером более 2 см. Крупные опухоли склонны к изъязвлению и кровотечению, которое может быть первым клиническим манифестом заболевания. Большие новообразования также могут вызывать явления дисфагии и частичного нарушения проходимости.
В 2018 г. были опубликованы обновленные клинические рекомендации ESMO-EURACAN по диагностике, лечению и дальнейшему наблюдению пациентов с ГИСО [7]. Согласно данным рекомендациям, стандартной тактикой ведения пациентов с ГИСО менее 2 см является динамическое наблюдение, поскольку опухоли такого размера ассоциируются с низким потенциалом злокачественности. В качестве методики мониторинга рекомендуется применять эндосонографию, в ходе которой возможно установить размеры новообразования, а также признаки злокачественности (нечеткие контуры, появление полостей распада, изъязвление, гетерогенность). При первичном обращении пациента с ГИСО менее 2 см рекомендуется контроль через 3 месяца с последующим наблюдением 1 раз в 1/2 года. Тем не менее пациенту с мини- и микро-ГИСО рекомендовано предлагать и альтернативный вариант – удаление новообразования. Оперативному вмешательству подлежат все симптомные пациенты, а также пациенты, у которых при динамическом наблюдении отмечается рост опухоли или изменение сонографических и/или эндоскопических характеристик. Все клинически значимые ГИСО (т.е. размером более 2 см) подлежат удалению.
Подход к лечению ГИСО за последние несколько лет претерпел существенные изменения, что служит отражением более четкого понимания характера опухоли и возможности определения степени ее злокачественности на дооперационном этапе с использованием неинвазивных методов обследования. Общей тенденцией служит более активная хирургическая тактика в комбинации с системной химиотерапией при распространенных формах заболевания. При локализованных формах не требуется проведения обширных резекций. Для соблюдения онкологических стандартов достаточно достижения визуального чистого края резекции R0, подтвержденного результатами гистологического исследования. Это обстоятельство легло в основу широкого применения мини-инвазивных вариантов лечения, в частности лапароскопических операций. Оперативная эндоскопия, получившая стремительное развитие в последнее время, несмотря на техническую возможность удаления ГИСО небольших размеров, в т.ч. путем проведения полнослойной резекции стенки желудочно-кишечного тракта, не нашла широкого одобрения в качестве допустимой технологии. По всей видимости, сложность методик эндоскопической полнослойной резекции и энуклеации образований мышечного слоя служат основным ограничением их распространения. Однако к настоящему времени уже накоплен достаточный мировой опыт удаления ГИСО небольших размеров с применением различных эндоскопических технологий. В 2012 г. были опубликованы результаты ретроспективного исследования по сравнению лапароскопического и эндоскопического удалений ГИСО желудка [8]. При правильном отборе пациентов эндоскопическая техника показала результаты, сопоставимые с лапароскопической в отношении долгосрочной эффективности операции и числа осложнений при проведении вмешательства.
Цель данной статьи – обзор литературы по возможности использования различных эндоскопических методик для удаления ГИСО желудка и представление собственного опыта.
Методы эндоскопического удаления ГИСО желудка
Методики эндоскопического удаления эпителиальных и подслизистых новообразований достаточно разнообразны. Выбор технологии определяется размером и локализацией новообразования, его принадлежностью к определенному слою стенки желудка и характером роста. Эндоскопическое лечение ГИСО в настоящее включает различные варианты резекции слизистой оболочки, диссекцию в подслизистом слое, полнослойную резекцию, тоннельную диссекцию и комбинацию эндоскопического и лапароскопического подходов.
В зависимости от отношения к стенке желудка выделяют четыре типа ГИСО. При первом типе ножка, исходящая из мышечной оболочки желудка, очень узкая, а само новообразование практически полностью располагается в просвете желудка (рис. 1А). При втором типе ножка широкая, опухоль располагается в просвете желудка под тупым углом (рис. 1Б). ГИСО третьего типа располагаются в середине стенки желудка (рис. 1В), а новообразования четвертого типа располагаются субсерозно и имеют экстраорганный рост (рис. 1Г). Соответственно, эндоскопическая энуклеация как метод безопасного удаления подходит для опухолей первого и второго типов опухолей.
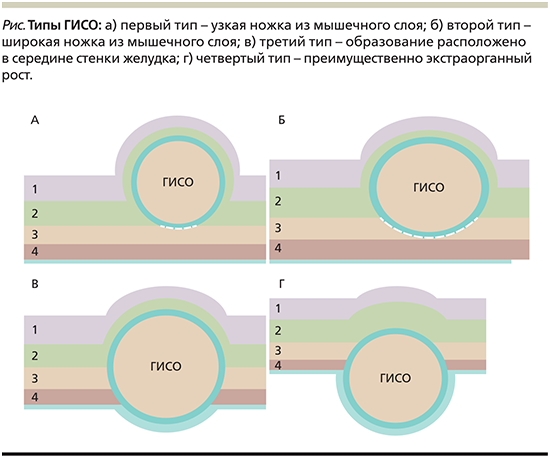
В случае наличия ГИСО третьего или четвертого типа используют эндоскопическую полнослойную резекцию [9–11].
Методика колпачковой резекции представляет собой удаление слизистой оболочки желудка с большей частью подслизистого слоя и подслизистым новообразованием при помощи эндоскопической петли и специального колпачка. Методика может быть использована для удаления небольших опухолей и имеет ряд технических ограничений, обусловленных трудностями захвата в резекционную петлю подслизистого образования, расположенного в мышечном слое желудка. Для формирования складки, представляющей собой дубликатуру стенки желудка, используют жесткие дистальные резекционные колпачки. Опухоль погружается в просвет колпачка при помощи вакуумной аспирации с формированием псевдополипа. Колпачковая методика резекции предполагает захват ткани у основания псевдополипа при помощи резекционной петли, предварительно уложенной по краю колпачка в специальный желоб. При лигатурной методике на основание псевдополипа скидывается кольцо-лигатура. В последующем резекция проводится вне колпачка как стандартная полипэктомия. Эндоскопическая резекция слизистой оболочки не гарантирует полноценного удаления подслизистого новообразования, особенно расположенного в теле и антральном отделе желудка. По этой причине высоки риски рецидива. Более того, при удалении ГИСО, исходящих из мышечного слоя, уровень осложнений достаточно высок, особенно риск перфорации [12, 13]. Необходимо также учитывать, что эффективность эндоскопической резекции зависит от локализации опухоли. Например, в позиции ретрофлексии повышается риск перфорации.
В настоящее время показания к удалению ГИСО методом резекции слизистой оболочки ограничены небольшими новообразованиями, исходящими из мышечной пластинки слизистой.
Другим методом эндоскопического удаления ГИСО служит диссекция в подслизистом слое. Первоначально диссекция была предложена для лечения раннего рака желудка [14]. В дальнейшем технология нашла свое применение в удалении подслизистых новообразований, включая ГИСО [15]. Суть технологии заключается в использовании специальных ножей различной конфигурации, при помощи которых после разметки удаляется слизистая оболочка и бóльшая часть подслизистого слоя.
По сравнению с резекцией слизистой оболочки метод диссекции позволяет удалять новообразования большего объема единым блоком. Несмотря на значительное число публикаций по удалению подслизистых новообразований методом диссекции в подслизистом слое, лишь небольшая часть из них посвящена непосредственно результатам лечения пациентов с ГИСО. В 2013 г. были опубликованы результаты лечения 144 пациентов из Китая (по данным гистологии 89 удаленных новообразований были ГИСО). Согласно данной работе, методика диссекции в подслизистом слое эффективна и безопасна в случаях удаления подслизистых новообразований желудка размером менее 50 мм, исходящих из второго и третьего эхо-слоев. При этом уровень резекции единым блоком был высок и составил 92,4% [16]. В статье Y. Meng et al. [17] эффективность лечения пациентов методом диссекции была сопоставимой с таковой при лапароскопических операциях, однако в группе внутрипросветных вмешательств время операции, потеря крови и длительность пребывания в стационаре были ниже.
Диссекция в подслизистом слое достаточно сложная операция, сопряженная с более высоким риском кровотечения и перфорации в процессе ее выполнения и раннем послеоперационном периоде, которые варьируются от 0 до 8,2% и 0 и 15,6% соответственно. Тем не менее большинство осложнений возможно разрешить с помощью эндоскопических методов. К более грозным, но редко встречающимся осложнениям относятся аспирационная пневмония, стеноз, тромбоэмболия и воздушная эмболия [18–24].
Полнослойная эндоскопическая резекция желудка – еще один вариант удаления ГИСО. Применяются те же принципы, что и при диссекции. После рассечения (или иссечения) слизистой оболочки над образованием под контролем зрения проводится периопухолевая резекция стенки желудка. При этом неминуемо возникает полнослойный дефект стенки желудка. В данном случае интраоперационная перфорация является не осложнением, а закономерной особенностью оперативного вмешательства. Закрытие дефекта стенки желудка имеет несколько технических решений, однако всегда представляет определенные сложности. Использование традиционных гемостатических клипс не всегда гарантирует надежное закрытие дефекта, т.к. сводит только слизистую оболочку. В азиатских странах достаточно широко применяется методика закрытия сквозного дефекта стенки желудка с использованием легирующей петли, которая гемостатическими клипсами крепится по краям перфорационного отверстия.
Последующее затягиванием петли приводит к сближению краев раны и полному ее закрытию. Полнослойная резекция впервые была представлена японскими авторами для удаления единым блоком новообразований, исходящих из мышечного слоя (4-й эхо-слой) [25]. В 2014 г. авторы из Китая опубликовали данные по удалению новообразований единым блоком с отсутствием каких-либо грозных осложнений (частота резекции без повреждения капсулы составила 98%) [26]. Для закрытия дефекта в первом случае авторы применяли клипсы, во втором кроме них использовали эндоскопическую лигатурную петлю Endoloop [27, 28].
Сравнительно недавно для закрытия дефекта после полнослойной резекции стали применять и новые устройства, доказавшие свою эффективность. Специальная система для полнослойной резекции представляет собой прозрачный колпачок с термопетлей и клипсой OVESCO, которая устанавливается на терапевтический эндоскоп [29]. С помощью щипцов производится захват предварительно размеченного новообразования и помещение последнего в колпачок. Сразу после наложения клипсы OVESCO с помощью петли внутри колпачка осуществляется полнослойная резекция.
К осложнениям подобных вмешательств можно отнести кровотечение и местный перитонит, хотя их частота встречаемости невелика. А в исследовании H. Wang et al. при равной эффективности и безопасности полнослойной резекции и лапароскопических операций внутрипросветные вмешательства имеют преимущества в виде сокращения длительности процедуры и пребывания пациента в стационаре, а также снижения риска кровопотери [30].
Туннельная методика является модификацией традиционной диссекции. Впервые данная техника применена при лечении пациентов с ахалазией кардии для выполнения пероральной эндоскопической миотомии [31]. В 2012 г. появились первые публикации о туннельных резекциях при удалении подслизистых образований желудка [32]. Суть технологии заключается в формировании доступа в подслизистое пространство на некотором удалении от опухоли. В последующем по направлению к опухоли формируется туннель. Новообразование удаляется методом периопухолевой резекции, подчас с формированием дефекта в мышечной стенке. Целостность слизистой оболочки восстанавливается с использованием гемостатических клипс. Пространственное разобщение разреза слизистой оболочки и дефекта в мышечной стенке позволяет добиваться надежной герметичности. Более быстрое заживление раневого дефекта и отсутствие необходимости применения сложных методик закрытия – несомненное преимущество туннельного метода по сравнению с традиционной диссекцией [26, 33–35].
Самыми распространенными осложнениями являются карбоксиперитонеум, кровотечение, выпот в плевральной полости и т.д., но большинство из них не требует активного лечения, что говорит о безопасности данного метода в целом [36, 37].
Тем не менее и у этой техники есть свои ограничения. В литературе мало данных о применении туннельной диссекции для удаления новообразований желудка, большинство наблюдений относятся к уровню гастроэзофагеального перехода. Данный метод не подходит для новообразований, располагающихся в дне желудка и по большой кривизне. Более того, вследствие ограниченного пространства в туннеле попытки удаления новообразований размером более 3–4 см единым блоком не представляются возможными.
Мы представляем наш опыт туннельной диссекции в лечении пациентов с подслизистыми новообразованиями желудка.
Методы
С марта 2014 по сентябрь 2018 г. в МКНЦ им. А.С. Логинова проведено одноцентровое проспективное исследование, в которое были включены 22 пациента с ГИСО. Всем пациентам помимо стандартного списка лабораторных и инструментальных методов обследования выполняли эндоскопическую ультрасонографию (ЭУС) и компьютерную томографию (КТ) органов брюшной полости с внутривенным контрастированием для исключения отдаленных метастазов и поражения лимфатических узлов. Критерии включения в исследования: а) установленный по данным предоперационного обследования диагноз ГИСО; б) размер опухоли не более 4 см; в) расположение опухоли в области субкардии и тела желудка по передней или задней стенке и малой кривизне. В исследование не были включены пациенты с новообразованиями более 4 см, а также с локализацией опухоли по большой кривизне, в своде и антральном отделе желудка. Все оперативные вмешательства проводились под эндотрахеальным наркозом двумя опытными эндоскопистами. Перед операцией всем пациентам вводили профилактичесую дозу антибиотика. Ключевыми параметрами оценки эффективности процедуры были край резекции, время оперативного вмешательства, периоперационные осложнения, длительность пребывания в стационаре и результаты послеоперационного наблюдения. Протокол послеоперационного наблюдения включал наблюдение онкологом, КТ органов брюшной полости и эзофагогастродуоденоскопию через 6, 12 и 24 месяца.
Показанием к оперативному лечению служили рост опухоли при динамическом наблюдении и изменение структуры опухоли по данным ЭУС. Среди прооперированных также были пациенты с впервые выявленными новообразованиями, изначально имевшими неоднородную структуру, что более характерно для ГИСО.
Все новообразования были удалены по методике туннельной диссекции, в которой можно выделить четыре основных этапа. Первым этапом после инъекции физиологического раствора, подкрашенного индигокармином, выполнялся продольный либо поперечный разрез слизистой оболочки на 3–4 сантиметра проксимальнее опухоли. Затем в подслизистом слое формировался широкий туннель. Опухоль максимально выделялась до уровня мышечного слоя с последующей полнослойной периопухолевой резекцией стенки желудка. Заключительным, четвертым, этапом операции после извлечения макропрепарата стало восстановление целостности слизистой оболочки металлическими клипсами.
В день операции пациентам разрешали пить воду. Прием пищи ограничивали до контрольного рентгенологического полипозиционного исследования с водорастворимым контрастом и подтверждения состоятельности шва слизистой оболочки. В отсутствие отклонений от нормального течения послеоперационного периода выписка пациентов осуществлялась через день после оперативного вмешательства.
Среди пациентов были 3 мужчин и 19 женщин. Всего было удалено 25 новообразований желудка. Уровень резекции единым блоком составил 100%, все удаленные новообразования имели край резекции R0. Средний возраст пациентов составил 62,8 года. Средний размер опухолей составил 17 мм, наименьшее из новообразований было 13 мм, наибольшее – 37 мм. Средняя продолжительность операции составила 145,9 минуты. Шести больным при выраженном карбоксиперитонеуме потребовалась интраоперационная декомпрессия брюшной полости при помощи иглы Вереша. Нужно отметить, что полнослойный дефект мышечной стенки желудка мы считали не осложнением, а одним из этапов операции.
При послеоперационном рентгенологическом исследовании на следующие сутки после операции патологических затеков не было отмечено ни в одном из наблюдений. По результатам исследования расширяли диету до приема протертой и мягкой пищи.
В одном случае в связи с кровотечением и неэффективностью эндоскопического гемостаза потребовалось изменение хирургического доступа. Пациентке была выполнена лапароскопическая атипичная резекция желудка.
По результатам иммуногистохимического исследования 12 удаленных новообразований оказались ГИСО низкой степени злокачественности. Четыре удаленные опухоли отнесли к промежуточной группе с назначением в двух случаях адъювантной терапии иматинибом. Семь новообразований были лейомиомами, двое пациентов отказались от проведения иммуногистохимии.
При динамическом наблюдении с проведением ЭГДС и КТ органов брюшной полости признаков рецидива и прогрессирования заболевания ни в одном из наблюдений выявлено не было.
Обсуждение
ГИСО является самым распространенным в структуре подслизистых новообразований желудка, что подтверждается данными нашего исследования. Все лейомиомы, подтвержденные при иммуногистохимии, располагались в кардиальном отделе желудка. Исходя из результатов работ других авторов, также следует, что локализация опухоли в теле желудка в большей степени характерна для ГИСО, а субкардиальное – для лейомиомы [38].
В нашем исследовании уровень резекции единым блоком составил 100%, все удаленные новообразования имели край резекции R0. Таким образом, туннельная диссекция служит решением проблемы неполноценной резекции в ряде наблюдений при использовании методики колпачковой резекции или стандартной диссекции.
Стоит отметить, что полнослойный дефект мышечной стенки, который образовался в шести случаях, мы не считали осложнением. При постепенном формировании и выделении опухоли под визуальным контролем перфорация считается запланированным этапом операции.
Однако метод имеет существенные ограничения, связанные со сложностью технической реализации в области угла и свода желудка. Необходимы дальнейшее изучение проблемы и накопление опыта с получением долгосрочных результатов.
Заключение
ГИСО желудка небольших размеров обладают низким потенциалом злокачественности. Эндоскопические технологии при правильном определении показаний позволяют удалять опухоли без нарушения целостности капсулы и с соблюдением онкологических критериев. Онкологическая обоснованность данных операций основывается на отсутствии рецидивов и прогрессирования болезни за период наблюдения.
Кроме того, минимизация доступа значительно сокращает число осложнений и период реабилитации пациентов после операции. Эндоскопические технологии находятся на экспериментальной стадии и требуют изучения отдаленных результатов.


