Введение
Эрадикация инфекции Helicobacter pylori (НР) является основой лечения НР-ассоциированных гастродуоденальных заболеваний. Традиционно для достижения эрадикации НР используют определенные схемы терапии, основанные на сочетании антибактериальных и антисекреторных препаратов. Существующие схемы можно подразделить на стандартные, т. е. хорошо апробированные и рекомендованные в качестве основных в лечении данной патологии международными и отечественными стандартами, и особые, которые могут назначаться в случае неэффективности или невозможности применения по каким-либо причинам стандартной схемы. Несмотря на информированность большинства врачей о составе стандартной терапии, не все понимают, почему стандартная терапия включает именно эти, а не иные препараты и почему в некоторых случаях она не дает желаемого результата.
В отличие от многих микроорганизмов НР in vitro чувствителен к большинству антимикробных препаратов. Еще в 1988 г. C.A.M. McNulty и J.C. Dent [1] продемонстрировали его чувствительность к 21 антибактериальному агенту. НР чувствителен к подавляющему большинству антибиотиков пенициллинового ряда и большинству цефалоспоринов (цефуроксиму, цефокситину, цефалексину), причем их минимальная подавляющая концентрация для 90 % бактерий (МПК90) не превышает 0,5 мг/л. Макролиды и фторхинолоны in vitro также проявляют достаточно высокую активность в отношении НР, их МПК90 ниже 0,5 мг/л. Весьма эффективны и антибиотики других групп (нитрофураны, гентамицин, тетрациклин, рифампицин). Метронидазол обладает активностью средней степени. НР устойчив к ванкомицину, цефсулодину, триметоприму и сульфаниламидам, поэтому эти антибактериальные препараты используют при его культивировании для подавления конкурентной флоры.
Несмотря на активность in vitro, при назначении in vivo вышеперечисленные антибактериальные препараты отнюдь не отличаются столь же высокой эффективностью. Одной из причин этого является снижение их активности в кислой среде желудка. Активность пенициллина и ампициллина в условиях кислой среды снижается более чем в 10 раз, цефалексина – в 16, ципрофлоксацина – в 10, а эритромицина – более чем в 100 раз. Макролиды последнего поколения (кларитромицин, джозамицин) в отличие от эритромицина гораздо более устойчивы к кислой среде [2]. Незначительное изменение активности наблюдается у тетрациклина и фуразолидона. Активность же метронидазола и висмута трикалия дицитрата не изменяется при кислых значениях рН [3].
Другой причиной неэффективности антибактериальных препаратов in vivo является неспособность некоторых их них накапливаться в слизи, покрывающей желудочный эпителий. Неионизированные молекулы эритромицина и ципрофлоксацина из слизистой оболочки быстро диффундируют в просвет желудка. При меньших значениях рН возможны их переход в ионизированную форму и задержка в слизистом слое, но снижение рН само по себе приводит к их почти полному разрушению. Поэтому эритромицин практически не эффективен при лечении НР-инфекции. В отличие от эритромицина кларитромицин и рокситромицин отличаются хорошим проникновением в ткани и слизистый слой [4]. Ципрофлоксацин и другие фторхинолоны не применяются в стартовой терапии хеликобактериоза еще и потому, что при их назначении очень быстро формируются резистентные штаммы ко всей группе хиноловых препаратов [5].
Амоксициллин – один из наиболее эффективных антибиотиков, применяемых при лечении HР-ассоциированных заболеваний. Препарат относится к группе β-лактамных антибиотиков, подгруппе аминопенициллинов. Максимальную активность амоксициллин проявляет при нейтральных значениях рН [6]. Он представляет собой амфотерное соединение, при рН 3–6 проникает в ткани несколько хуже, тогда как в слизь, которая на 90 % состоит из воды, способен проникать в большей степени [7], что позволяет добиваться высокой его концентрации как в пристеночном слое, эпителии и собственной пластинке слизистой оболочки, так и в желудочном содержимом.
Механизм воздействия амоксициллина на НР заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллинсвязывающих белков – ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма – пептидогликана [8]. Это приводит к нарушению синтеза клеточных оболочек и лишает микробную клетку способности противостоять осмотическому градиенту, что приводит к набуханию и разрушению ее стенок. То есть он оказывает бактерицидное действие, тогда как подавляющее большинство других β-лактамов обладает бактериостатическим эффектом. Данное обстоятельство объясняет нецелесообразность применения для лечения НР других антибиотиков данной группы (в т. ч. и родственного ампициллина). Побочными эффектами, свойственными амоксициллину, являются диарея, аллергические реакции и псевдомембранозный колит. При проведении антихеликобактерной терапии детям рекомендуется суточная доза 50 мг/кг в 2 приема до или после еды, взрослым рекомендуется доза 1000 мг 2 раза в день. При приеме амоксициллина до еды его местное антибактериальное действие усиливается.
При лечении НР-инфекции широко применяется производное нитроимидазола – метронидазол. Его действие не зависит от рН-среды. Под влиянием бактериальных нитропродуктаз происходит внутриклеточное восстановление нитрогруппы нитроимидазолов. Активные производные оказывают цитотоксическое действие: образуют комплексы с ДНК, вызывая ее дегидратацию, нарушая процессы синтеза в делящихся и покоящихся клетках, что приводит к бактерицидному эффекту.
Побочные эффекты метронидазола включают гастроинтестинальные симптомы, гепатотоксическое действие. При проведении антихеликобактерной терапии метронидазол рекомендуют назначать детям по 15–20 мг/кг в сутки в два приема после еды, взрослым – по 500 мг 2 раза в день.
Эффективность другой группы антибиотиков, макролидов, в отношении НР доказана многими исследованиями [9]. Основу химической структуры макролидов составляет макроциклическое лактонное кольцо. Все они обладают противовоспалительным и иммуномодулирующим действием, накапливаясь в клетках организма (в т. ч. и в полиморфно-ядерных лейкоцитах), влияя на миграцию нейтрофилов, окислительные реакции в фагоцитах и продукцию многих цитокинов. Механизм действия макролидов состоит из торможения синтеза белка в микробных клетках при их размножении путем связывания с каталитическим пептидилтрансферазным центром рибосомальной 50S-субъединицы. Это приводит к торможению реакции транслокации и транспептидации, нарушению процесса формирования и наращивания (элонгации) пептидной цепи. Препараты этой группы обладают преимущественно бактериостатическим действием. Поскольку макролиды являются слабым основанием, их активность возрастает при рН, равной 5,5–8,5.
Полусинтетические макролиды (кларитромицин, рокситромицин, азитромицин) характеризуются более высокой кислотоустойчивостью, чем эритромицин, однако при приеме внутрь частично разрушаются под действием желудочного сока. Главным достоинством препаратов этой группы является их способность создавать очень высокие и стабильные концентрации в тканях, превышающие содержание макролидов в сыворотке крови. Важной особенностью кларитромицина является его конкурентное взаимодействие с ингибиторами протонной помпы (ИПП), что увеличивает концентрацию в крови обоих препаратов. Кларитромицин наиболее активен в отношении HР и наиболее устойчив к кислой среде желудка. По даннымI. Miki и соавт. (2003) [10], монотерапия кларитромицином приводит к уничтожению HР в 54 % случаев, а согласно исследованиям Gisbert – в 15 % случаев, что, тем не менее, является впечатляющим результатом. Кларитромицин способен вызывать нарушение вкусовой чувствительности, реже – диспепсические явления и аллергические реакции.
Антибактериальная активность антибиотиков может быть усилена за счет одновременного назначения антисекреторных средств. Повышение интрагастральной рН с 3,5 до 5,5 усиливает активность амоксициллина и макролидов более чем в 10 раз [11]. Этот факт объясняет высокую эффективность схем антихеликобактерной терапии при включении мощных ингибиторов желудочной секреции.
Фармакологический механизм ИПП обусловлен их селективным антагонизмом к Н+/К+-АТФазе париетальных клеток желудка, которая вступает в необратимую связь с активным метаболитом ИПП сульфенамидом. Минуя желудок, ИПП быстро всасываются в кишечнике и перераспределяются между органами и тканями. Являясь слабым основанием, они лучше накапливаются там, где значения рН наиболее низкие [12]. В канальцах париетальных клеток рН может достигать 1,0–0,8. Это обеспечивает селективное накопление препаратов, поскольку оптимальным для всех видов ИПП является уровень рН от 1 до 2 [13]. ИПП избирательно накапливаются в кислой среде секреторных канальцев париетальной клетки, где их концентрация в миллион раз превосходит таковую в крови [14]. Там они переходят в активную форму и образуют прочные ковалентные связи с SH-группами Н+/К+-АТФазы, создавая необратимую ковалентную связь и исключая возможность конформационных переходов молекулы фермента, тем самым блокируя его работу. Секреция кислоты восстанавливается, только когда синтезируются новые молекулы Н+/ К+-АТФазы [14]. Важно отметить, что после отмены ИПП восстановление продукции HCl происходит на 4–5-й день в результате ресинтеза помп, т. е. при применении ИПП отсутствует феномен “рикошета”, свойственный Н2-гистаминоблокаторам. Антисекреторная активность ИПП в 2–10 раз превышает таковую блокаторов Н2-рецепторов гистамина. Это объясняет лидирующее положение данной группы препаратов в лечении кислотозависимых и HР-ассоциированных заболеваний [15].
Среди большой группы ИПП наиболее известен омепразол. Многочисленные исследования доказали его высокую эффективность и безопасность. Побочные эффекты омепразола выражены слабо и включают желудочно-кишечные нарушения, такие как диарея, метеоризм, боли в животе, запор. Со стороны ЦНС иногда отмечаются головная боль и головокружение. В подавляющем большинстве случаев жалобы купируются самостоятельно и не требуют отмены или снижения дозы препарата. Исследования, проведенные среди детей в возрасте от 3 месяцев до 18 лет, показали, что фармакокинетика омепразола у них как при пероральном, так и при внутривенном введении не отличается от таковой у взрослых [16]. Оптимальной дозой омепразола у детей, способной поддерживать рН выше 4 на протяжении 90 % времени суток при пероральном приеме, является 1 мг/кг/сут [17]. Наблюдение за детьми, получавшими омепразол по поводу гастроэзофагеальной рефлюксной болезни на протяжении 7 лет, не выявило никаких побочных реакций, лишь незначительную гиперплазию G-клеток желудка с умеренной гипергастринемией [18]. Уровень гастрина в крови обычно повышался через несколько недель лечения, а гиперплазия G-клеток появлялась лишь через несколько лет.
ИПП обладают синергизмом с антибактериальными препаратами. Активность многих антибиотиков повышается при сдвиге значений рН из кислой в щелочную сторону. Кроме того, уменьшение объема секрета повышает концентрацию антибактериальных препаратов в желудочном соке [19]. Сочетание ИПП и кларитромицина увеличивает время полужизни обоих препаратов, а также концентрацию макролида в слизистой оболочке антрального отдела и желудочной слизи. Длительного повышения рН среды выше 5 достаточно для синергического действия ИПП и двух антибиотиков в уничтожении HР.
В соответствии с совместными рекомендациями Европейской и СевероАмериканской ассоциаций детских гастроэнтерологов (ESPGHAN и NASPGHAN) оптимальными схемами эрадикационной терапии детей являются следующие [20]:
1-я линия:
• ИПП + амоксициллин + кларитромицин,
• ИПП + амоксициллин + метронидазол,
• ИПП + кларитромицин + метронидазол;
2-я линия:
• висмута трикалия дицитрат (Де-нол) + ИПП + амоксициллин + метронидазол (тетрациклин после 12 лет).
Оптимальные дозы препаратов, входящих в стандартные схемы антихеликобактерной терапии, представлены в таблице.

В качестве первой линии терапии рекомендована схема, включившая ИПП, кларитромицин и амоксициллин, и реже – схема, в которой вместо амоксициллина применялся метронидазол [21]. Поскольку компоненты первой схемы были наиболее удачно сбалансированы по эффективности и минимальны по побочным действиям, она получила название “стандартная тройная терапия”. Уровень эрадикации при использовании данной комбинации препаратов составил 78–1 % [22]. По результатам G.M. Buzas, J. Jozan (2004) [23], эффективность схемы, включающей кларитромицин и амоксициллин, приближается к 80 %, амоксициллин и нитроимидазол – к 72,5 %. Целесообразность включения в схему эрадикации кларитромицина показана при сравнении комбинации лансопразола (30 г 2 раза в сутки), амоксициллина (1 г 2 раза в сутки) и метронидазола (400 мг 3 раза в сутки) с режимом, включавшим лансопразол и амоксициллин в той же дозе, но с заменой метронидазола на кларитромицин (500 мг 2 раза в сутки). Эффективность последнего варианта оказалась более высокой (91 против 78 %) [24].
За прошедшие после принятия Консенсуса Маастрихт-III пять лет все более очевидным становится снижение эффективности рекомендуемых в качестве первой линии терапии тройных эрадикационных схем. Причиной тому – растущая резистентность НР к антибиотикам. Так, суммируя результаты 20 европейских исследований, в которых проведена оценка результатов стандартной тройной терапии 1-й линии, включившей омепразол, амоксициллин и кларитромицин у 2751 пациента, можно заключить, что в случае чувствительности штаммов эрадикация достигается в среднем у 87,8 %, а при устойчивости к кларитромицину – только у 18,3 % пациентов [25]. Общая эффективность схемы стандартной терапии омепразолом, амоксициллином и кларитромицином в Европе снизилась примерно на 10 % за 10 лет. Это снижение подчеркивает клиническое значение резистентности НР к кларитромицину.
Целью данного исследования была сравнительная оценка частоты выявления СagA(+)-штаммов НР и наличия мутаций, обусловливающих резистентность НР к кларитромицину, у детей и подростков двух разных регионов России (Санкт-Петербурга и Северной Осетии), а также оценка эффективности стандартной терапии 1-й линии, включившей омепразол, амоксициллин и кларитромицин в возрастных дозах.
Материал и методы
Исследованы биоптаты антрального отдела желудка 257 детей и подростков с НР-ассоциированными гастродуоденальными заболеваниями: 153 жителя Санкт-Петербурга и 104 жителя Северной Осетии. Наличие СagA определялось методом полимеразной цепной реакции (ПЦР) с использованием специфических праймеров. Наличие мутаций, связанных с устойчивостью НР к кларитромицину (A2142G, A2143G, T2717C), выявлены методом полугнездовой ПЦР с последующим рестрикционным анализом. Исследования проводились в научно-исследовательской лаборатории “Диагностика” Института экспериментальной медицины РАМН.
Тридцати восьми подросткам 15–18 лет с язвенной болезнью двенадцатиперстной кишки и эрозивным гастродуоденитом (15 из Санкт-Петербурга и 23 из Владикавказа) проведено лечение НР-инфекции по стандартной 7-дневной схеме ОАК (омепразол, амоксициллин, кларитромицин). Все дети получали эрадикационную терапию впервые. В ходе лечения оценена динамика клинических данных (боли, диспепсические расстройства, болезненность при пальпации в эпигастральной зоне) и регистрировались побочные реакции; по окончании лечения (на 8–10-й день) проведена контрольная фиброгастродуоденоскопия для оценки рубцевания язв. Через 4–6 недель после окончания лечения проведен дыхательный Хелик-тест для оценки эрадикации НР.
В качестве препарата для проведения стандартной схемы лечения был выбран Пилобакт АМR как наиболее удобный в применении, поскольку он представляет собой набор капсул омепразола (20 мг), амоксициллина (500 мг) и таблеток кларитромицина (500 мг), расфасованных в специальные стрипы, предназначенные для разового приема. Каждый стрип содержит 1 капсулу омепразола, 1 таблетку кларитромицина и 2 капсулы амоксициллина, что соответствует рекомендуемой разовой дозе каждого препарата для взрослых. Дозы для подростков 15–18 лет соответствуют дозам взрослых. В упаковке Пилобакта АМ содержится 14 стрипов, что очень удобно для проведения 7-дневного курса стандартной терапии. Имеющиеся результаты применения Пилобакта АМ для эрадикации НР у взрослых пациентов подтверждают его эффективность и хорошую переносимость [26].
Результаты и обсуждение
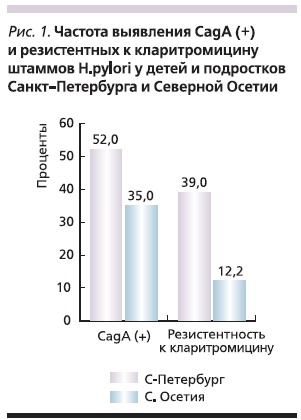
Выделенные штаммы НР отличались по токсигенности: CagA(+)-штаммы выявлены у 52 % детей и подростков из Санкт-Петербурга и 35 % – из Владикавказа. Мутации, обусловливавшие резистентность НР к кларитромицину, выявлены у 39 % жителей Санкт-Петербурга и лишь у 12,2 % жителей Северной Осетии (рис. 1).
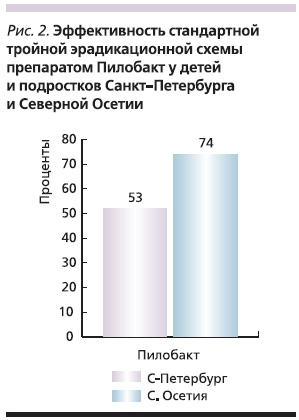
На фоне лечения Пилобактом АМ наблюдалась быстрая положительная динамика клинических симптомов: боли купировались в среднем на 3-и сутки лечения, болезненность в эпигастрии – на 5-е, к концу курса лечения жалоб не предъявлял ни один из пациентов. Эндоскопическое исследование, проведенное сразу после окончания лечения, показало успешное рубцевание (красный рубец) и полную эпителизацию эрозий у всех больных. Побочные реакции на прием препарата наблюдались лишь у двух пациентов: в одном случае отмечена головная боль, у другого пациента – кратковременная диарея. Контрольное исследование через 4–6 недель после окончания лечения установило, что эрадикация НР достигнута у 17 из 23 (74 %) больных из Северной Осетии и 8 из 15 (53 %) больных из Санкт-Петербурга (рис. 2).
Полученные результаты свидетельствуют о существенном различии как в токсигенности штаммов НР, так и в устойчивости их к кларитромицину в разных регионах России. У детей и подростков Санкт-Петербурга отмечен более высокий уровень вирулентных CagA(+)-штаммов НР, а также существенно более высокий уровень резистентности к кларитромицину (39,0 против 12,2 %). Различная чувствительность к одному из компонентов стандартной схемы 1-й линии, примененной нами (ОАК), объясняет существенные отличия в ее эффективности в двух регионах. Результаты стандартной эрадикационной схемы в Северной Осетии продемонстрировали хорошие результаты, близкие к европейским. Подобное наблюдалось нами среди детей и подростков Санкт-Петербурга в конце прошлого века, когда эрадикация при лечении схемой ОАК достигала 72 % [27]. По прошествии 10 лет произошло снижение эффективности стандартной схемы 1-й линии на 18 %. Это объясняется растущей резистентностью НР к кларитромицину, что, вероятно, обусловлено частым назначением антибиотиков группы макролидов для лечения детей с различной патологией. Вместе с тем хорошая клиническая и эндоскопическая динамика процесса на фоне приема Пилобакта АМ, хорошая переносимость и удобство приема препарата позволяют рекомендовать его для проведения эрадикации НР у подростков в регионах с уровнем резистентности к кларитромицину ниже 20 % либо после предварительного определения индивидуальной чувствительности штамма НР к этому антибиотику.
Информация об авторах:
Корниенко Елена Александровна – доктор медицинских наук, профессор, заведующая кафедрой
гастроэнтерологии ФПК и ПП СПбГПМА.
E-mail: elenkornienk@yandex.ru;
Паролова Наталья Ивановна – кандидат медицинских наук, ассистент кафедры
гастроэнтерологии ФПК и ПП СПбГПМА;
Базрова Фатима Владимировна – заведующая гастроэнтерологическим отделением
Республиканской детской клинической больницы Владикавказа;
Суворова Мария Александровна – заведующая лабораторией “ООО Диагностика”
Института экспериментальной медицины РАМН



