Введение
На протяжении последних десятилетий воспалительные заболевания кишечника (ВЗК) остаются в центре внимания врачей, поскольку стали распространенными заболеваниями желудочно-кишечного тракта (ЖКТ). Увеличение числа больных ВЗК происходит с изменением образа жизни в современном обществе [1]. Принятие «западных привычек» питания и образа жизни привело к тому, что в Китае, Южной Корее и Австралии в последние годы отмечается значительный рост заболеваемости ВЗК [2]. Интересен факт, что в странах, адаптирующих у себя «западный стиль» питания, включающий высокий уровень потребления насыщенных жиров и сахарозы и бедных клетчаткой продуктов, отмечается рост заболеваемости не только ВЗК, но и сахарным диабетом 2 типа, а также бронхиальной астмой [3]. Появилось четкое понимание того, что пищевой рацион играет важную роль в патогенезе ВЗК, поскольку метаболизм ряда компонентов пищи влияет на эпителиальный барьер и иммунную систему слизистой оболочки ЖКТ.
Влияние пищевых привычек на микрофлору кишечника
Пищевые привычки, по-видимому, помимо прочего, являются модулятором кишечного микробиоценоза. Например, употребление высокобелковой пищи, в т.ч. красного мяса, приводит к увеличенному образованию таких бактериальных метаболитов, как аммиак, индолы, фенолы и сульфиды, которые оказывают токсическое действие на кишечник [4]. Жирная пища изменяет состав микробиоты кишечника путем повышенного образования желчных кислот [5]. В последние годы увеличивается потребление пищевых химических добавок, таких как подсластители, эмульгаторы, загустители, консерванты и пищевые красители. Их влияние на риск возникновения ВЗК требует дальнейшего изучения. «Западный стиль» диеты с низким содержанием пищевых волокон и омега-3 полиненасыщенных жирных кислот, повышенным потреблением пищевых химических веществ, таких как сахарозаменители (сахарин, сукралоза), способствует воспалению и росту патогенных бактерий в кишечнике [6]. Известно, что пищевые волокна метаболизируются кишечными микробами в короткоцепочечные жирные кислоты, которые ингибируют экспрессию провоспалительных цитокинов [6]. Питание с низким содержанием пищевых волокон провоцирует истощение нормального кишечного микробиоциноза. Микробиота кишечника, богатая патогенными и условнопатогенными бактериями, приводит к появлению провоспалительных иммунных клеток, неконтролируемому воспалению и повреждению слизистой оболочки. Идентифицировано более тысячи видов бактерий, живущих в ЖКТ, которые помогают пищеварительному процессу, участвуют в синтезе ряда витаминов. Микробная кишечная композиция – динамичная и сложная экосистема, которая меняется в зависимости от факторов окружающей среды, образа жизни и привычек [7]. Исследования демонстрируют, что микробиота кишечника формируется под влиянием генотипа хозяина, диеты, привычек, предшествовавших инфекций, использования антибиотиков или других лекарств [8]. Взаимодействие между поступающими питательными веществами, микробиотой кишечника и иммунной системой служит важным звеном поддержания гомеостаза. Бактериальная колонизация кишечника формирует как локальный, так и системный иммунный ответ и участвует в модуляции иммунитета.
Роль различных компонентов пищи в кишечном гомеостазе имеет важное значение в сложных эпигенетических, генетических и экологических взаимодействиях, лежащих в основе патогенеза ВЗК. Доказано, что частота нарушений кишечной микрофлоры при ВЗК достигает 66–93% [9]. Большинство исследований указывает на снижение разнообразия микробиоты кишечника при ВЗК, уменьшение числа резидентной флоры, увеличение числа условно-патогенных бактерий и патогенных микроорганизмов. У больных язвенным колитом (ЯК) и болезнью Крона (БК) отмечается уменьшение количества бактерий типов Firmicutes и Bacteroidetes, повышение количества Proteobacteria [10]. По мнению некоторых ученых, снижение разнообразия микроорганизмов у ряда больных ВЗК становится причиной рефрактерности к терапии глюкокортикостероидами [11]. Исследование, проведенное еще в 2010 г., продемонстрировало существенные различия в микробиоте кишечника у детей, живущих в африканских сельских общинах, по сравнению с детьми, живущими в Европе. Кишечная микробиота африканских детей была богатой бактериями типа Bacteroidetes и бедной Firmicutes и Enterobacteria, в то время как результаты, полученные от европейских детей, были противоположными [12]. Авторы связали это с радикально отличающимися диетическими привычками в Европе и Африке. Работа французских ученых демонстрирует, что количество Clostridium leptum и Clostridium coccoides снижается в группе больных ВЗК, доказано, что они способствуют образованию бутирата, что в свою очередь приводит к изменению продукции провоспалительных цитокинов [13]. В работе K. Takeshita et al. выявлено снижение количества Fusicatenibacter saccharivorans у пациентов с активным ЯК в отличие от больных в ремиссии [14]. Исследования адгезии на слизистой оболочке патогенных штаммов Escherichia coli в генезе ЯК спорны. Ряд исследований демонстрирует, что патогенные штаммы E. coli обнаруживаются лишь в небольшом количестве образцов ткани больных ЯК [15]. По мнению других авторов, вирулентные штаммы E. coli участвуют в патогенезе ЯК [16]. Третья точка зрения: не все патогенные штаммы E. coli ассоциированы с ЯК [17]. По данным ряда исследований, известно, что токсин Clostridium difficile связан с обострением ВЗК [18]. Bacteroides vulgatus, входящие в состав микрофлоры толстой кишки здорового человека, при ВЗК обнаруживаются в повышенной концентрации и выделяют ферменты, расщепляющие муцин [19].
Важно обратить внимание и на тот факт, что одного лишь дисбиоза недостаточно, чтобы вызвать ВЗК. В пользу этого говорит то, что лечение пробиотиками не приносит желаемого результата, а диета влияет на гомеостаз кишечника и его иммунную функцию. Таким образом, установление причинно-следственной связи между пищевым рационом и микробиотой имеет большое значение в понимании причин и патогенеза ВЗК.
Дефицит микронутриентов при ВЗК
Дефицит микронутриентов встречается более чем у половины больных ВЗК в связи со сниженным аппетитом, плохой переносимостью ряда продуктов питания, однообразным пищевым рационом, оперативными вмешательствами, синдромом мальабсорбции и приемом лекарственных препаратов.
Микронутриенты – это незаменимые пищевые вещества, необходимые для нормального течения обменных процессов, формирования иммунитета. К микронутриентам относятся витамины и минералы. Последние подразделяются на макро- и микроэлементы в зависимости от концентрации в организме. К макроэлементам относятся водород, углерод, кислород, азот, натрий, магний, калий, кальций, фосфор, сера, хлор; к микроэлементам – железо, цинк, медь, йод, марганец, селен, кобальт, молибден, фтор, хром. Витамины – это органические соединения, которые относятся к незаменимым пищевым веществам и практически не синтезируются в организме человека [20]. В таблице представлены данные о симптомах недостатка ряда микронутриентов, которые наиболее часто выявляются у больных ВЗК, а также перечислены рекомендации по коррекции их дефицита [21, 22].
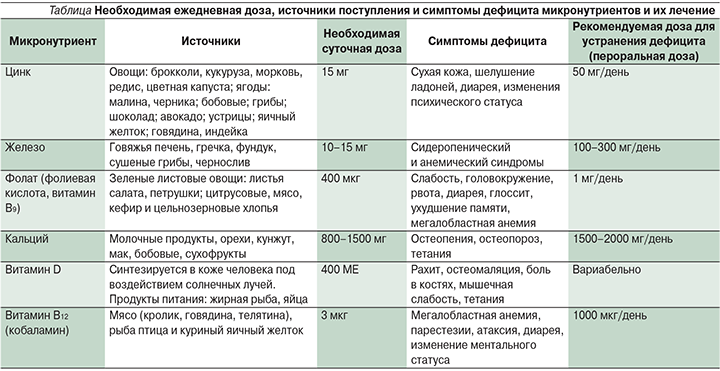
Витамин B12 и фолиевая кислота необходимы для образования форменных элементов крови, таких как эритроциты и лейкоциты. Кобаламин принимает участие в метаболизме жирных кислот и углеводов; фолиевая кислота – в метаболизме аминокислот. Их недостаток ведет к развитию мегалобластной анемии. Дефицит витамина В12 достоверно чаще встречается при БК, чем при ЯК. Содержание витамина В12 уменьшается у пациентов, которым проведена резекция желудка (фактор продукции) и/или терминального отдела подвздошной кишки (фактор абсорбции). Дефицит фолата у больных ВЗК возникает на фоне приема лекарственных препаратов: метотрексат является антагонистом фолата, а сульфасалазин блокирует его абсорбцию. Источники фолиевой кислоты – зелень и бобовые, как правило, плохо переносятся больными ЯК и БК. Пациентам, регулярно принимающим фолиевую кислоту, следует остерегаться потенциального дефицита витамина В12. Доказано, что недостаточность фолата увеличивает риск колоректального рака у пациентов с ВЗК [23], в связи с чем предлагается проводить скрининг витамина B12 и фолата у всех пациентов с этими заболеваниями. Не вызывает сомнений, что дефицит витамина D – один из факторов, предрасполагающих к аутоиммунным заболеваниям. Полученные данные свидетельствуют о том, что витамин D играет ключевую роль в поддержании баланса между воспалительной реакцией клеток Th1/Th17 и иммуносупрессивным ответом клеток Th2/Treg. Активный метаболит витамина D кальцитриол снижает пролиферацию Т-лимфоцитов Th1 и Th0 путем ингибирования интерлейкинов (ИЛ) -1, -2, -6 и -12, интерферона-γ и фактора некроза опухоли-α, стимулирует деление регуляторных Т-лимфоцитов (T-reg), облегчая синтез ИЛ-10 [24]. Кроме того, доказано, что витамин D влияет на поддержание баланса ацидобактерий. Важно, что дефицит витамина D отмечается при БК даже в период ремиссии и независимо от локализации процесса. Как демонстрируют многочисленные исследования, у больных ВЗК отмечается снижение минеральной плотности костей. К факторам риска дефицита кальция у этой группы пациентов относят синдром мальабсорбции, дефицит витамина D, прием глюкокортикостероидов, плохую переносимость молочных продуктов. Оценка содержания кальция и витамина D необходима для пациентов с ВЗК. Как в поддерживающей терапии, так и в достижении ремиссии при ВЗК крайне важно обеспечить достаточное поступление этих микронутриентов с пищей. Особое значение это приобретает при терапии глюкокортикостероидами. Большая часть витамина D синтезируется под воздействием солнечных лучей. Не стоит забывать, что чрезмерное пребывание на солнце пациентам с аутоиммунными заболеваниями противопоказано. При диагностированных признаках остеопороза может потребоваться лечение бисфосфонатами.
Источником цинка для организма человека служат продукты питания. Способствует всасыванию цинка витамин А, который стимулирует образование в энтероците цинксвязывающего белка, при этом, видимо, играя такую же роль, что и витамин D по отношению к кальцию. В свою очередь цинк необходим для синтеза ретинолсвязывающего белка в печени, обеспечивающего транспорт витамина А в тканях. На фоне воспалительных процессов в кишечнике всасывание цинка уменьшается скорее всего под влиянием ИЛ-1 [25]. Примерно 90% цинка выводится из организма кишечником, однако большая его часть вновь реабсорбируется и лишь небольшая покидает организм с калом (0,4–2,8 мг/сут, при общем его содержании в организме взрослого человека 1,5–2,0 г).
В настоящее время известно более 200 цинксодержащих ферментов, обеспечивающих нормальное течение физиологических процессов. Выявлено, что потери цинка у больных ЯК и БК происходят на фоне диареи (до 15 мг на литр стула) [26]. Большинство исследований показали снижение уровня цинка в сыворотке крови у пациентов с БК, хотя клинических стигм его дефицита не было. Поскольку цинк частично транспортируется альбумином, отмечалась их прямая корреляция в сыворотке крови больных БК [27].
Железодефицитная анемия выявляется при ВЗК в 42%, при БК – в 90% случаев. Ее этиология связана с потерями железа из дефектов ЖКТ, недостаточным питанием, нарушением абсорбции железа [28]. Лечение зависит от степени выраженности анемии. Увеличение уровня гемоглобина на 20 г/л в течение месяца лечения препаратами железа считается приемлемой скоростью прироста. Парентеральные формы препаратов железа следует рассматривать в качестве терапии первой линии для пациентов при БК с клинически активным воспалением, анамнестическими данными о непереносимости пероральных форм, уровнем гемоглобина ниже 100 г/л и у пациентов, которые нуждаются в эритропоэзстимулирующих препаратах [29].
Селен – необходимый компонент ряда основных процессов метаболизма, включая систему антиоксидантной защиты, синтез гормонов щитовидной железы и иммунитет. Кроме того, селен участвует в регуляции активности цитохрома-Р450, гемоксигеназы, ряда других митохондриальных и цитозольных ферментов. В связи с этим дефицит селена имеет значение при многих патологических процессах в организме, воспалительных и деструктивных, в качестве антиканцерогенного фактора [30]. Он поддерживает функцию макрофагов и активирует функции NK-клеток и Т-лимфоцитов. Дефицит селена увеличивает риск ухудшения настроения, что может приводить к депрессии. К сожалению, организм человека поглощает только половину селена из пищи. Его биодоступность увеличивается метионином, аскорбиновой кислотой и витамином Е [31]. Селен в составе различных соединений хорошо всасывается в тонкой кишке (в первую очередь в двенадцатиперстной, в меньшей степени – в тощей и подвздошной) и практически не всасывается в желудке. В среднем селен всасывается из кишечника на 78%, однако в отдельных случаях отмечается индивидуальная низкая интенсивность всасывания, что может лежать в основе дефицита этого микроэлемента. Интересно, что пониженное всасывание селена наблюдается и у жителей регионов с высоким его содержанием в почве. По данным эпидемиологических исследований, в России с использованием показателя содержания в сыворотке крови умеренный селенодефицит – распространенное явление, имеющее место на всем протяжении страны [32]. При общем сравнительно высоком уровне обеспеченности селеном жителей Омской области относительное благополучие выявлено только в южных и центральных районах, в то время как северные районы (Усть-Ишимский, Тарский, Муромцевский) отличались существенным понижением обеспеченности селеном населения [33].
Как демонстрируют исследования, у больных ЯК и БК отмечается недостаток железа, витаминов B12, D и K, фолиевой кислоты, селена, цинка, витаминов B6 и B1 [34]. Недостаточное количество перечисленных микронутриентов отмечается у пациентов с БК чаще, чем с ЯК, и чаще в период активности заболевании. По мнению ряда ученых, снижение обеспеченности микроэлементами влияет как на риск манифестации, так и на степень тяжести и длительность ремиссии ВЗК. Прием лекарственных препаратов в активный период заболевания ухудшает усвоение микронутриентов [35]. Например, глюкокортикостероиды ухудшают абсорбцию кальция, цинка и фосфора, вызывают недостаток витамина D. Длительное парентеральное питание приводит к недостатку многих микронутриентов, но чаще всего витаминов А, D, Е, цинка, меди и селена [36]. В исследовании, проведенном в Корее, у больных ВЗК доказан дефицит витамина D (у 74 из 83 обследованных больных ЯК и БК – 89,2%), цинка (у 39%), селена (у 30,9%). В той же работе исследователи указывают на необходимость выявления зависимости дефицита микронутриентов от активности заболевания, его продолжительности, медикаментозной терапии, локализации, оперативных вмешательств в анамнезе и наконец от пола и возраста больных. Доказано, что дефицит цинка достоверно чаще отмечался у больных ВЗК моложе 40 лет, дефицит селена – у больных ВЗК женского пола и с низким уровнем альбумина в сыворотке. В другом исследовании [37] указывается, что в экспериментальном колите у мышей выявлена обратная корреляция между выраженностью воспаления в кишечнике с уровнем селена в крови. При адекватном поступлении селена тяжесть воспаления уменьшалась.
В исследовании, опубликованном в 2015 г., доказывается, что витамин D влияет как на маркеры воспаления кишечника, так и на его микробиоту, достаточное поступление витамина D у больных ВЗК уменьшает риск рецидива заболевания [38]. В США при ретроспективном анализе историй болезни детей до 18 лет с ВЗК (n=60) выявлено, что ни у одного ребенка не было дефицита витамина В12, в то время как дефицит витамина D обнаружен у 62% пациентов, витамина А – у 16%, витамина Е – у 5% и цинка – у 40%. В контрольной группе дефицит витаминов D, E и цинка имел место у 75, 8 и 19% пациентов соответственно. Эта группа ученых рекомендует оценивать уровень витаминов А и D в дебюте заболевания [39]. Важным аспектом процесса лечения больных ВЗК остается персонализированная диета, предназначенная для компенсации сниженного уровня микронутриентов.
Заключение
На сегодняшний день нет единого индикатора, позволяющего оценивать нутритивный статус пациента с ВЗК. Для этого требуется использование комплекса соматометрических и клинико-лабораторных параметров. Следует проявлять осторожность при интерпретации измерений микронутриентов плазмы в условиях системного воспалительного ответа (например, при высоком уровне С-реактивного белка). По мнению ряда ученых, концентрация различных микронутриентов в крови вряд ли отражает общие резервы организма и может приводить к неправильной клинической интерпретации результатов с последующим ненужным вмешательством. Таким образом, необходимо разработать новые биомаркеры истинных резервов микронутриентов в организме, а оценку потребления и концентрации микронутриентов в пище следует интерпретировать в совокупности с биохимическими показателями.


