Введение
В структуре гинекологической заболеваемости миома матки (ММ) занимает второе место [1]. При тщательном обследовании миому можно выявить у 77% женщин в популяции [2]. Хотя ММ обычно диагностируют у пациенток позднего репродуктивного и пременопаузального возраста, за последние 40 лет отмечается тенденция к омоложению заболевания: его распространенность среди женщин в возрасте до 30 лет выросла с 2 до 12,5% [3]. В США распространенность ММ, не имеющей клинических проявлений, в возрасте от 18 до 30 лет составляет 43–57% [3–5]. ММ оказывает выраженное негативное воздействие на репродуктивную функцию и общее состояние здоровья женщин, но до настоящего времени не существует четкой патогенетически обоснованной оценки ее влияния на фертильность.
На наличие взаимосвязи между ММ и фертильностью женщин указывает тот факт, что выполнение миомэктомии способствует реализации репродуктивной функции пациенток с бесплодием неясного генеза [6, 7].
Вопрос ведения пациенток с ММ остается одной из наиболее актуальных проблем современной гинекологии, несмотря на многообразие терапевтических методик. Лечение ММ – предмет пристального внимания как мировой, так и отечественной гинекологии, что связано с возросшей частотой родов в позднем репродуктивном периоде, развитием постгистерэктомического синдрома, обосновывая необходимость проведения органосохраняющего лечения [1]. Статистика указывает на соотношение органоуносящих и органосохраняющих операций как 95:5. Рецидивы ММ после органосохраняющих операций возникают у 15– 45% пациенток, причем повторная операция более травматична и сопряжена с высоким интраоперационным риском кровотечения и образования послеоперационных спаек, что диктует необходимость поиска новых возможностей по снижению числа повторных оперативных вмешательств [8–10]. Также в послеоперационном периоде необходимо проведение противорецидивной терапии, поскольку хирургическое удаление миоматозных узлов не устраняет причины их развития, а интраоперационная травма миометрия повышает риск рецидива миом [11]. Предупреждения рецидива заболевания можно добиться путем назначения адъювантной терапии препаратами, блокирующими гормональную стимуляцию миоматозной трансформации миометрия.
Дискутабельными вопросами использования противорецидивной терапии являются специфические осложнения, связанные с развитием гормональных и биохимических нарушений, кратковременностью курса терапии, рецидивом заболевания после отмены препаратов, а главное – возможность использования их в молодом возрасте. Широкую распространенность в терапии ММ получили агонисты гонадотропин-рилизинг гормонов, однако их применение ограничивается развитием гипоэстрогенных состояний, нарушениями минерального обмена, кратковременностью курса терапии и рецидивами заболевания после отмены препаратов [12].По мнению большинства исследователей, антигестагены, первым представителем которых стал мифепристон, имеют многообещающие перспективы в лечении ММ [13]. В России зарегистрирован препарат мифепристона Гинестрил с дозировкой 50 мг для приема 1 раз в день [14]. Еще одним препаратом для лечения умеренных и тяжелых симптомов ММ является Эсмия, зарегистрированный в странах Евросоюза в 2012 г. Однако 09.02 2018 Европейское агентство лекарственных средств (EMA) опубликовало временные рекомендации о приостановке назначения препарата Эсмия новым больным и его повторного применения пациентками, завершившими предыдущий курс терапии препаратом, что обусловлено серьезным побочным эффектом со стороны печени, заключавшимся в развитии тяжелой печеночной недостаточности, потребовавшей трансплантации органа [15]. В настоящее время мифепристон имеет существенные преимущества перед другими методамив лечения ММ благодаря высокой клинической эффективности и хорошей переносимости, что позволяет успешно использовать его при лечении миомы у женщин репродуктвиного возраста не только в качестве адъювантной терапии, но и в длительном режиме в качестве единственного лечебного средства [13].
Весомая доказательная база эффективности противорецидивной терапии мифепристоном, хорошая переносимость препарата и целесообразность его применения пациентками, планирующих беременность, определяют широкий интерес специалистов к данному препарату [1]. Это обусловливает необходимость изучения частоты возникновения рецидивов заболевания и реализации репродуктивной функции у пациенток, перенесших органосохраняющее лечение по поводу ММ и курс адъювантной терапии мифепристоном.
Цель исследования. Оценка реализации репродуктивных возможностей и частоты рецидивов заболевания у пациенток, перенесших органосохраняющее лечение по поводу ММ и курс адъювантной терапии мифепристоном в течение двух лет после отмены препарата.
Материал и методы
Исследование проведено на базе гинекологического отделения ГБУЗ «Городская клиническая больница им. Ф.И. Иноземцева» ДЗМ (главный врач – д.м.н., профессор А.Е. Митичкин). В когортное проспективное сравнительное исследование были включены 136 женщин, перенесших органосохраняющее лечение по поводу миомы матки с 01.01.2015 по 31.03.2016. Исследование не имело конфликта интересов и осуществлялось без финансовой поддержки фармацевтических компаний. Критерии включения в исследование: возраст 25–45 лет (в среднем 33±5,5 лет), органосохраняющее лечение по поводу ММ.
Критерии исключения из исследования: возраст старше 45 лет, аллергические реакции на мифепристон, наличие противопоказаний к применению мифепристона, отягощенный соматический анамнез, включая заболевания печени, гиперпластические процессы со стороны матки (аденомиоз, гиперплазия эндометрия).
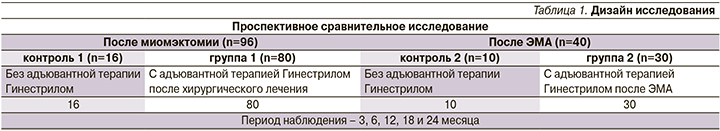
В зависимости от варианта органосохраняющего лечения пациентки были разделены на группы (табл. 1).
Объем обследования включал стандартные клинические, лабораторные и морфологические методы исследования.
До применения мифепристона проведен сбор данных, подтвердивших возможность участия пациенток в исследовании: критерии включения/исключения; антропометрические данные; факт курения и употребления алкоголя; жалобы; анамнез; сопутствующие заболевания; общий осмотр; термометрия; гинекологический статус; общеклинические лабораторные исследования; вид органосохраняющего оперативного лечения.
Клинико-анамнестический метод – изучение гинекологического анамнеза, особенности течения и длительность заболевания. Оценка соматического статуса с использованием визуальных и физикальных методов. Клиническое лабораторное обследование включило клинический анализ крови; общий анализ мочи; биохимическое исследование крови; коагулограмму; группу крови, резус-фактор; бактериоскопическое исследование отделяемого из цервикального канала.
Инструментальное обследование включило транваганальное и трансабдоминальное ультразвуковое исследование малого таза с допплерометрией.
Материал для морфологического исследования забирался во время проведения инвазивных методов диагностики (аспирационная биопсия эндометрия).
В зависимости от типа миоматозных узлов по классификации FIGO 2011 г. и их количества 136 пациенткам проведено органосохраняющее оперативное вмешательство: 48 – с субсерозно-интрамуральной миомой типа 5–7 по FIGO 2011 г. произведена миомэктомия лапароскопическим доступом; 8 с субсерозно-интрамуральной миомой типа 6–7 – вагинальная миомэктомия; 24 с интрамуральной миомой типа 3–4 – миомэктомия лапаротомным доступом; 16 с субмукозной миомой типа 0–1 – гистероскопическая миомэктомия; 40 с субмукозно-интрамуральной миомой типа 2–4 – эмболизация маточных артерий (ЭМА); 26 женщин, отказавшихся от приема мифепристона в послеоперационном периоде, составили контрольные группы.
Мифепристон (Гинестрил) назначался в дозе 50 мг/сут (1 таблетка) с 1-го дня менструального цикла после оперативного лечения в непрерывном режиме в течение 3 месяцев с учетом противопоказаний к его применению.
Основными параметрами эффективности применения мифепристона считали изменения размеров матки и миоматозных узлов после ЭМА, также оценивали отдаленные результаты спустя 3, 6, 12, 18 и 24 месяца после лечения в виде возникновения рецидивов заболевания.
Оценку переносимости препарата пациентками проводили на основании частоты возникновения побочных эффектов, динамического клинического наблюдения.
Оценку реализации репродуктивной функции пациенток провели путем учета наступления беременности в течение двух лет после лечения и ее исхода.
Полученные данные подвергли статистической обработке с использованием пакета программ STATISTICA 12,0; SPSS. Использовали метод описательной статистики с определением среднего арифметического, дисперсии, стандартного отклонения, 95% доверительного интервала. Достоверность различий оценивали с помощью непараметрического U-критерия Манна–Уитни. Различия считали значимыми при p<0,05.
Результаты исследования
В ходе исследования были получены данные об анамнезе, особенностях течения ММ.
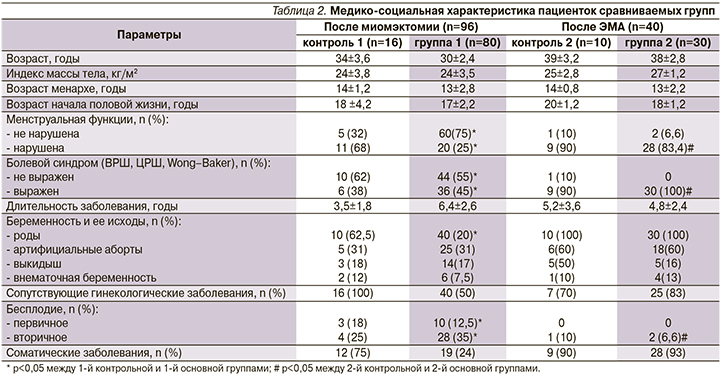
При анализе медико-социальной характеристики групп больных не было выявлено статистически значимых различий в возрасте менархе и начале половой жизни, индексе массы тела, длительности основного заболевания, сопутствующих гинекологических и соматических заболеваниях (табл. 2).
При сборе анамнеза в 40% случаев ММ имела бессимптомное течение, 60% пациенток беспокоил болевой синдром, у 50% больных отмечено нарушение менструального цикла по типу обильных маточных кровотечений и у 45 % пациенток эти жалобы сочетались. В итоге у 81 из 136 больных имелся болевой синдром разной степени выраженности. Оценка интенсивности болевого синдрома проведена по вербальной рейтинговой (ВРШ), цифровой рейтинговой шкалам (ЦРШ) и в соответствии со шкалой мимической оценки боли Wong–Baker. У 36 больных присутствовала слабая боль по ВРШ (2 балла по ЦРШ), которую можно было игнорировать. У 27 женщин отмечена боль средней интенсивности по ВРШ (4–5 баллов по ЦРШ), у 18 – сильная боль по ВРШ (7 баллов по ЦРШ).
Длительность заболевания с момента выявления ММ составила от 2 до 10 лет.
Гинекологический анамнез был отягощен у 88 женщин, 47 из них страдали заболеваниями шейки матки, 41 – воспалительными заболеваниями органов малого таза.
Соматический анамнез был отягощен у 68 пациенток: у 44 – выявлена постгеморрагическая анемия, у 3 – ожирение, у 9 – заболевания желудочно-кишечного тракта и у 12 – заболевания сердечно-сосудистой системы.
В клиническом анализе крови уровень гемоглобина составил от 90 до 136 г/л (в среднем 110±15,6 г/л), число лейкоцитов и тромбоцитов было в пределах нормы. В биохимическом анализе крови и коагулограмме изменений не выявлено.
При аспирационной биопсии эндометрия на 5–7-й день менструального цикла патологии эндометрия не выявлено.
При ультразвуковом исследовании размеры матки соответствовали сроку от 6 до 16 недель (в среднем 10±3,1), количество миоматозных узлов составило от 1 до 10 (в среднем 3,4±1,4), размеры миоматозных узлов – от 2 до 10 см (в среднем 5,5±2,4).
В зависимости от типа миоматозных узлов, согласно классификации FIGO 2011 г., пациенткам было проведено хирургическое органосохраняющее лечение. Интраоперационных и послеоперационных осложнений отмечено не было. Менструальный цикл восстанавился в течение 14–21 суток после операции.
При гистологическом исследовании у 96 (100%) пациенток, которым выполнена миомэктомия, была выявлена пролиферирующая ММ.
Через 1 месяц после начала приема мифепристона отмечено развитие аменореи у 100% больных. Нормальный менструальный цикл восстанавился через 1 месяц после отмены мифепристона.
Через 1 месяц после начала приема мифепристона у 50 пациенток болевой синдром отсутствовал. У 18 больных, которых исходно беспокоила сильная боль, присутствовал лишь слабый болевой синдром по ВРШ (2 балла по ЦРШ), которую она спокойно могла переносить без использования нестероидных противовоспалительных препаратов, полностью боль у них исчезла спустя 3 месяца после медикаментозного лечения. У 8 пациенток, отказавшихся от приема мифепристона, через месяц после хирургического лечения интенсивность боли уменьшилась до слабой и умеренной по ВРШ (2–4 балла по ЦРШ), спустя 3 месяца интенсивность боли не изменилась.
В результате проведенных исследований установлено, что при использовании мифепристона в послеоперационном периоде у 76 (96%) пациенток, подвергшихся миомэктомии, размеры матки уменьшились по сравнению с больными, отказавшимися от приема мифепристона, у которых размеры матки даже после проведенного хирургического лечения оставались выше нормы.
Объем матки у 96% женщин, получивших мифепристона, уменьшился после хирургического лечения на 42,1±5% от исходной величины (p<0,05) и на 64±9,6 (p<0,05) по сравнению с пациентками, не получавшими лечения этим препаратом, причем степень уменьшения размеров матки не зависела от возраста обследуемых женщин.
У 25 из 30 пациенток, перенесших ЭМА, спустя 3 месяца от начала терапии мифепристоном, отмечено уменьшение миоматозных узлов, в среднем на 1,5±0,4 см.
Побочные реакции на мифепристон имели место у одной пациентки в виде тошноты в первые 3 дня во время приема первой упаковки препарата. Индивидуальной непереносимости препарата, а также осложнений при приеме препарата в ходе исследования отмечено не было. Переносимость препарата больными была хорошей, ни одна пациентка в течение исследования не отказалась от приема препарата.
Отдаленные результаты исследований спустя 3, 6, 12, 18 и 24 месяца после лечения не выявили рецидивов заболевания у больных, перенесших миомэктомию. Напротив, у 2 пациенток, отказавшихся от медикаментозной терапии, рецидив заболевания был зарегистрирован спустя 12 месяцев после оперативного лечения, у 8 – спустя 18 и у 12 – через 24 месяца.
После ЭМА и терапии мифепристоном рецидив заболевания спустя 24 месяца после лечения также не был выявлен ни у одной из 30 пациенток, причем миоматозные узлы у 20 из них уменьшились до клинически незначимых (на 3,4±1,4 см). Среди 10 пациенток, отказавшихся от приема препарата, через 12 месяцев рецидив заболевания был зарегистрирован у 1 больной, спустя 18 месяцев – у 2 и через 24 месяца – у 3 пациенток.
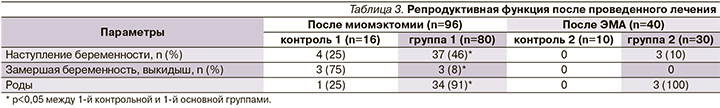
В течение 24 месяцев беременность наступила у 37 из 96 пациенток после миомэктомии, 40 женщин не планировали беременность, поэтому ими была выбрана ЭМА, но 3 пациентки все же забеременели и беременность закончилась своевременными родами (табл. 3).
После миомэктомии без адъювантной терапии мифепристоном беременность наступила у 4 пациенток из 16, но только лишь у 1 больной она закончилась самопроизвольными родами. После ЭМА без последующего лечения мифепристоном беременность не возникла ни у одной больной.
Обсуждение
При анализе отдаленных результатов миомэктомии у 80 пациенток, которым в послеоперационном периоде проводилась адъювантная терапия мифепристоном, установлено, что применение этого препарата в дозе 50 мг/сут в непрерывном режиме в течение 3 месяцев после хирургического органосохраняющего лечения по поводу пролиферирующей миомы матки (тип 0–7 по классификации FIGO, 2011) привело к достоверному снижению объема матки у 96% женщин (p<0,05) независимо от вида оперативного доступа. По литературным данным, миомэктомия сопровождается высокой частотой послеоперационных осложнений, возникающих в 7,7–12,7% наблюдений [16, 17]. После-операционное ведение пациенток подразумевает предохранение от беременности в течение 6–12 месяцев, тогда как оптимальным сроком наступления беременности является период 8–12 месяцев после операции, что снижает риск несостоятельности рубца на матке. В отсутствие антирецидивной терапии у 48% пациенток в течение 6–12 месяцев после операции отмечен рецидив заболевания, что служит серьезным фактором риска ухудшения репродуктивного прогноза [11, 18, 19]. В нашем исследовании в течение 24 месяцев после адъювантной терапии рецидивы заболевания не были зарегистрированы и 46% пациенток смогли реализовать свою репродуктивную функцию. В исследовании А.З. Хашукоевой и соавт. (2017) при динамическом наблюдении за 35 пациентками, получавшими терапию мифепристоном после лапароскопической миомэктомии, через 3–6–9 месяцев рецидивы заболевания также не были зарегистрированы [1].
Наступление беременности в 46% наблюдений, все случаи которой закончились своевременными родами, свидетельствует о благоприятном влиянии мифепристон на репродуктивный прогноз. Также отмечено, что применение данного препараты увеличивает безрецидивный период и шансы результативности вспомогательных репродуктивных технологий [1].
В последние десятилетия широкую популярность в качестве самостоятельного метода лечения ММ приобретает ЭМА [16]. Однако вопросы назначения противорецидивной терапии после ЭМА остаются дискутабельными. Рецидивы после ЭМА в течение 12 месяцев наблюдаются в 40% случаев, поэтому, по нашим данным, назначение мифепристона таким пациенткам обоснованно. Спустя 12 месяцев после комплексного лечения (ЭМА+мифепристон) объем миоматозных узлов уменьшается на 25%, а через 24 месяца – на 50%, причем отмечено отсутствие рецидивов в течение всего периода наблюдения.
Прием мифепристона вполне обоснован для женщин, планирующих беременность после миомэктомии, т.к. спустя месяц после отмены препарата восстанавливается менструальный цикл, что свидетельствует об отсутствии у него длительного угнетающего воздействия на репродуктивную систему [14, 18].
Заключение
Анализ результатов представленной работы позволяет сделать следующие выводы:
- Отдаленные результаты исследования позволяют рекомендовать мифепристон в послеоперационном периоде пациенткам, перенесшим органосохраняющее лечение по поводу пролиферирурющей ММ, с целью предотвращения рецидивов заболевания в течение 24 месяцев после отмены препарата.
- Использование мифепристона после ЭМА позволило достоверно уменьшить размеры узлов на 25% в течение 12 и на 50% спустя 24 месяца, полностью предупредив рецидивы в течение 24 месяцев.
- Комплексное лечение ММ, включившее проведение миомэктомии и медикаментозной терапии мифепристоном (Гинестрил), позволило реализовать репродуктивную функцию 46% пациенток.


