Введение
Курение – известный фактор риска развития атеросклероза, приводящего к возникновению ишемической болезни сердца (ИБС) и инфаркта миокарда (ИМ). При курении риск развития ИБС в 1,5 раза выше, а при выкуривании более 20 сигарет в день – в 2 раза выше, чем у не куривших [1]. У постоянных курильщиков, перенесших острый инфаркт миокарда (ОИМ), риск нового коронарного события по сравнению с не курившими, увеличен в 2,5 раза [2]. В то же время прекращение курения остается потенциально эффективной мерой вторичной профилактики и улучшает прогноз после сердечного события [3, 4].
Целью исследования было выявление особенностей ИМ у курящих пациентов по сравнению с не курившими.
Материал и методы
Изучению подвергнуты истории болезни всех пациентов, находившихся на лечении в отделении неотложной кардиологии Краевой клинической больницы № 2 Хабаровска с заключительным диагнозом «инфаркт миокарда» за 2015 г., всего 681 случай. Согласно цели исследования, было сформировано 2 группы наблюдения: 1-я группа – курящие (n=250), 2-я группа – не курившие (n=431). Средний койко-день в 1-й и 2-й группах составил 8,34±0,09 и 8,88±0,08 дня соответственно. Из историй болезни в базу данных вводили информацию о поле, возрасте, массо-ростовых показателях пациентов, наличии в анамнезе предшествовавших артериальной гипертензии (АГ), ИБС (в т.ч. ИМ), нарушений сердечного ритма, сахарного диабета (СД); характере и объеме получаемого амбулаторно лечения сопутствующей патологии. Для выявления возрастных особенностей в каждой группе осуществили деление по возрасту с интервалом в 10 лет. Таким образом, получили 7 возрастных подгрупп: 30–39 лет, 40–49, 50–59, 60–69, 70–79, 80–89 лет и 90–94 года (см. рисунок). Также фиксировали жалобы пациентов при поступлении, особенности настоящего ИМ и его осложнения. Анализировали лечение коронарного тромбоза: проведение медикаментозного тромболизиса, результаты ангиопластики и стентирования. По протоколу коронарной ангиографии (КАГ) отмечали число сосудов, пораженных атеросклерозом, сосудов с гемодинамически значимыми стенозами (≥75%) [5], число установленных стентов. Оценивали фракцию выброса (ФВ) левого желудочка по данным эхокардиографии (ЭхоКГ).
Статистический анализ данных выполнен в Центре «Биостатистика» с помощью статистических пакетов SAS 9.4 и Statistica 10. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05. При проверке нормальности распределения количественных признаков в группах сравнения с использованием критериев Колмогорова–Смирнова, Шапиро– Уилка, Крамера-фон-Мизеса и Андерсона–Дарлинга выяснено, что в обеих группах по всем анализируемым признакам нормальное распределение отсутствовало. В связи с этим для сравнения центральных параметров групп использовали непараметрический метод анализа с критерием Ван-дерВардена. При этом проверка гипотез равенства дисперсий производилась с помощью критериев Сиджела–Тьюки и Ансари–Брэдли [6, 7].
Исследование связи между парами дискретных качественных признаков проведено с использованием анализа таблиц сопряженности. Помимо оценки достигнутого уровня статистической значимости, χ2-критерия оценивали интенсивность связи анализируемых признаков с помощью V-коэффициента Крамера [6, 7].
Результаты исследования
Результаты анализа предшествовавших настоящему ИМ факторов риска и сопутствовавших заболеваний у пациентов на момент поступления в стационар приведены в табл. 1.
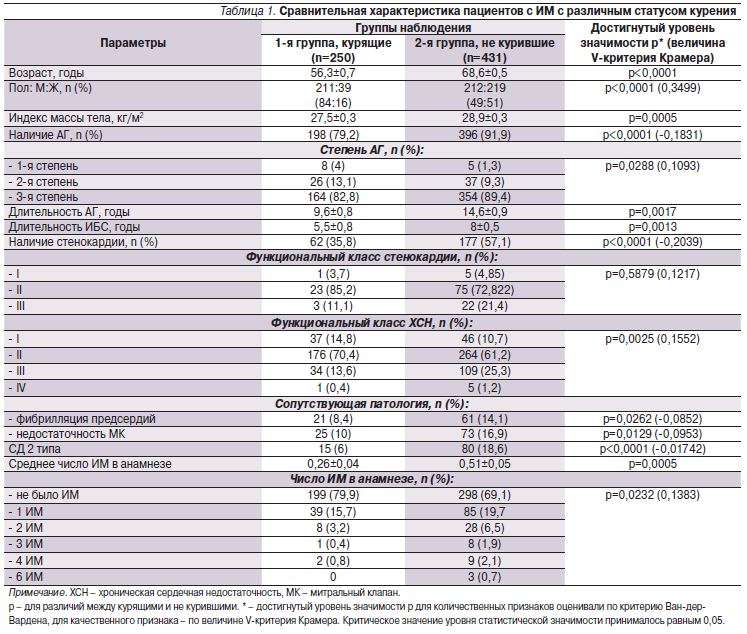
ИМ у курящих развивался на 12,4 года раньше, чем у не куривших пациентов (средний возраст – 56,3±0,7 и 68,6±0,5 года соответственно; р<0,0001). Среди курящих пациентов преобладали мужчины (84%). Результаты анализа демонстрируют наличие положительной связи между признаками «курит» и мужским полом (величина V-критерия Крамера – 0,3499), подобная связь выявлена ранее другими исследователями [8, 9].
На рисунке представлено деление курящих и не куривших пациентов по возрастным группам. В группах 30–39, 40–49 и 50–59 лет превалировали курящие мужчины, тогда как в более старших возрастных группах (60–69 и 70–79 лет) начинали преобладать не курившие мужчины, а затем не курившие женщины. Таким образом, среди курящих пациентов ИМ чаще развивался в возрасте до 60 лет (54,8%), в то время как у не куривших он случился в этом возрасте только в 17,2% случаев.
Пациенты обеих групп имели избыточную массу тела, но у курящих индекс массы тела был меньше, чем у не куривших, – 27,5±0,3 против 28,9±0,3 кг/м2 (р=0,0005).
Предшествовавшую ИМ АГ в группе курящих выявляли реже (в 79,2%) по сравнению с группой не куривших (91,9%), при этом ее длительность и степень были меньшими. Курящие пациенты до инфаркта реже страдали стенокардией (35,8 против 57,1% без отличий по ее функциональному классу), длительность ИБС у них была меньшей (5,5±0,8 против 8,0±0,5 года), и они имели меньший функциональный класс ХСН по сравнению с никогда не курившими. Кроме того, у них реже, чем у не куривших, наблюдали недостаточность МК (10 против 16,9%), фибрилляцию предсердий (8,4 против 14,1%) и СД 2 типа (6 против 18,6%).
У курящих пациентов анамнез был реже отягощен перенесенными ранее ИМ (в среднем 0,3±0,04 против 0,5±0,05).
Таким образом, курящие пациенты были моложе и имели менее отягощенный анамнез по предшествовавшим сердечно-сосудистым заболеваниям и СД 2 типа.
Характеристика ИМ в исследуемых группах представлена в табл. 2.
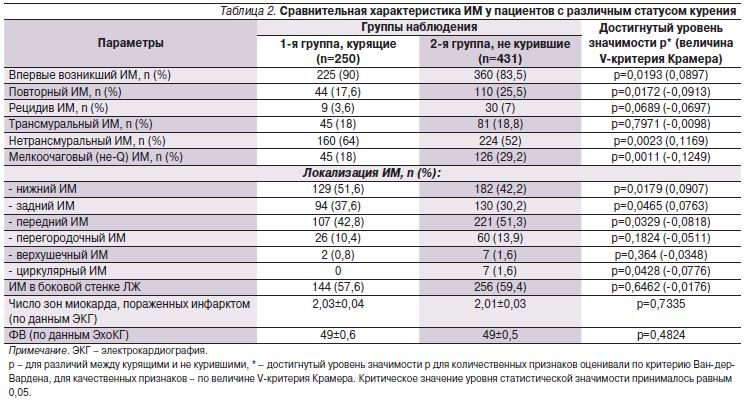
Курящие чаще страдали впервые возникшим ИМ, чем не курившие (90 и 83,5% соответственно; р=0,0193), и реже повторным ИМ по сравнению с пациентами 2-й группы (17,6 и 25,5% соответственно; р=0,0172). Трансмуральный ИМ развивался с одинаковой частотой в обеих группах, крупноочаговый нетрансмуральный ИМ чаще был у курящих пациентов (64 против 52%; р=0,0023), тогда как мелкоочаговый (не-Q) ИМ чаще отмечен у не куривших (29,2 против 18%; р=0,0011). Поскольку курящие пациенты были значительно моложе не куривших, наши данные подтверждают результаты исследований, выполненных в нашей клинике ранее Б.З. Сиротиным и соавт. [12], а также данные, полученные другими авторами [10, 11, 13], о том, что ИМ у людей более молодого возраста характеризуется большей глубиной и обширностью некроза.
У курящих лиц выявлена статистически значимая положительная связь с развитием заднего и нижнего ИМ, у не куривших же чаще развивался передний и циркулярный ИМ. Эти особенности совпадают с результатами крупного эпидемиологического исследования, по данным которого нижний ИМ также чаще развивался у курящих, а передний – у никогда не куривших пациентов [14]. Перегородка, верхушка и боковая стенки левого желудочка повреждались с одинаковой частотой в обеих группах. Несмотря на более молодой возраст курящих и меньшее бремя предшествовавших сопутствующих сердечно-сосудистых заболеваний и СД, число зон некроза миокарда, определяемое отведениями ЭКГ, в этой группе не отличалось от показателей у не куривших (2±0,04 в 1-й группе и 2±0,03 во 2-й; р=0,7335). ФВ левого желудочка в обеих группах также оказалась одинаковой (49±0,6 у курящих и 49±0,5 у не куривших; р=0,4824).
Анализ данных ангиографии в исследуемых группах представлен в табл. 3.
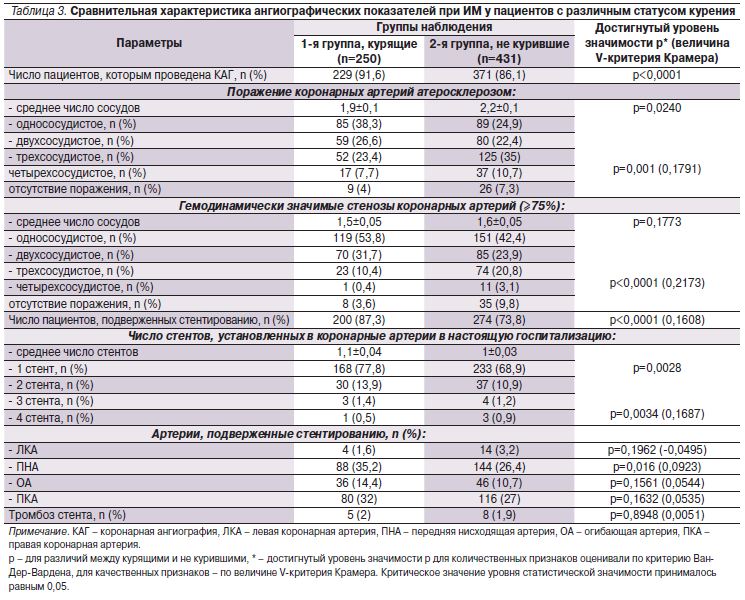
КАГ при ИМ курящим пациентам выполняли чаще (р<0,0001), при этом число пораженных атеросклерозом сосудов у них в среднем было значимо меньшим (1,9±0,1), чем у не куривших (2,2±0,1; р=0,0240). Поражение одного сосуда чаще наблюдали у курящих (38,3 против 24,9%), трех – у не куривших (35 против 23,4%; p<0,001).
Среднее число сосудов с гемодинамически значимыми стенозами (≥75%, в т.ч. сосудов с тромботической окклюзией, требовавших стентирования) в обеих группах было идентичным. В то же время значимый стеноз в одной или двух коронарных артериях чаще выявляли у курящих пациентов. Многососудистое гемодинамически значимое поражение коронарного русла с вовлечением трех или четырех сосудов чаще выявляли в группе не куривших. У курильщиков реже выявляли отсутствие гемодинамически значимых стенозов (3,62 против 9,83% у не куривших).
Курильщики чаще подвергались стентированию (87,3 против 73,8% по сравнению с не курившими). Указанная разница, по нашему мнению, обусловлена большей частотой многососудистого поражения артерий сердца в группе не куривших пациентов, что являлось причиной отказа от установки стентов с рекомендацией дальнейшего направления на операцию коронарного шунтирования. Курильщикам чаще устанавливали один (77,8%) и два стента (13,9%). Среднее число установленных стентов в группе курящих было большим по сравнению с группой не куривших (1,12±0,04 и 0,98±0,03 соответственно; р=0,0028). Полученные нами данные совпадают с результатами L. Metz и соавт., также отметивших, что курящие пациенты имели менее выраженное поражение коронарных сосудов, но подвергались более агрессивному инвазивному лечению [15].
Курящим пациентам с ИМ стент чаще устанавливали в переднюю нисходящую артерию (35,2%; р=0,016). Тромбоз стента встречался в обеих группах с одинаковой частотой (р=0,8948).
Курящим пациентам чаще проводили медикаментозный тромболизис (11,2%) по сравнению с 6,5% у не куривших (р=0,0313). Данный подход – весьма обоснованный, по мнению ряда авторов [16–18], указавших на больший тромботический компонент с относительно меньшим бременем атеросклеротической бляшки у данной категории пациентов.
Обсуждение
Подводя итоги, можно отметить, что курящие пациенты переносили ИМ в среднем на 12,4 года раньше, чем не курившие. В 84% случаев это были мужчины, более чем у половины курящих ИМ развивался в возрасте до 60 лет. Курильщики к моменту развития ИМ имели менее длительный анамнез по АГ, ИБС, в меньшем проценте случаев страдали сопутствующими СД, фибрилляцией предсердий, недостаточностью МК и ожирением, что мы объясняем разницей в возрасте. Полученные результаты совпадают с данными других исследований, авторы которых также отметили, что курящие пациенты с ИМ были на 7–10 лет моложе не куривших [14,16], реже страдали АГ, фибрилляцией предсердий и СД [19]. В то же время T. Gupta и соавт. в своем наблюдении отметили, что курящие пациенты чаще не куривших страдали ожирением, предшествовавшей ИБС и имели в анамнезе ИМ [14].
В нашем исследовании обнаружена связь курения с нижней и задней локализацией ИМ. Мы не смогли объяснить причину этого феномена, однако аналогичные данные были получены и другими авторами [14]. Тот факт, что курильщики в 90% случаев переносили крупноочаговый ИМ в отличие от не куривших, у которых чаще наблюдали ИМ без зубца Q, может быть объяснен более молодым возрастом куривших пациентов. Это согласуется с результатами ранее опубликованных работ о том, что ИМ у людей молодого возраста отличается большей глубиной и обширностью некроза [10–13].
Курящим проводилось более интенсивное лечение коронарного тромбоза с использованием медикаментозного тромболизиса и интракоронарного вмешательства, которое в 87,3% случаев заканчивалось установкой 1 или 2 стентов, о чем также сообщали ранее и другие авторы [15–18]. Чаще у курящих наблюдалось однососудистое поражение, как правило, с вовлечением передней нисходящей или правой коронарной артерии сердца.
Несмотря на более молодой возраст и менее отягощенный анамнез по сопутствующим заболеваниям, а также более активное лечение ИМ у куривших, число зон поражения миокарда и величина ФВ левого желудочка были сопоставимыми с группой не куривших. Зарубежные коллеги, исследуя ФВ на 30-й день после ОИМ, также не обнаружили различий в группах с разным статусом курения [20].
Заключение
Проведенное исследование подтвердило неблагоприятное влияние курения на возникновение ИМ. Курящие пациенты переносили ИМ в более молодом возрасте, несмотря на менее отягощенный анамнез по сопутствующим факторам сердечно-сосудистого риска по сравнению с не курившими. Течение ИМ у курящих отличалось бóльшим размером некроза и требовало большего объема мероприятий по коронарной реваскуляризации, включая тромболитическую терапию и стентирование. Это обосновывает проведение настоятельных рекомендаций пациентам по отказу от курения, которые должны давать врачи любой специальности в качестве мер первичной и вторичной профилактики сердечно-сосудистых заболеваний и их осложнений.



