Актуальность
С началом первых исследований в 1948 г., показавших значительный успех применения кортизона у пациентов с ревматоидным артритом, стартовала эра широкого использования глюкокортикостероидов (ГКС) в клинической практике [1–3].
Разнообразие физиологических влияний и спектра фармакологического действия ГКС, включающих противовоспалительный, иммуносупрессивный, жаропонижающий, обезболивающий, адаптогенный, неспецифический мембраностабилизирующий, противоотечный, противоаллергический, гематологический, гемодинамический, противошоковый, антитоксический, противорвотный эффекты, предопределяет универсальность их применения при различных патологических состояниях [1–4]. В клинической практике ГКС используются преимущественно в ревматологии, нефрологии, аллергологии, гематологии, трансплантологии и при неотложных состояниях. В связи с увеличением частоты аутоиммунных и аллергических заболеваний применение ГКС в педиатрии в последние годы значительно выросло [4–6].
В настоящее время препараты ГКС доступны повсеместно в виде пероральных, топических (для лечения болезней кожи), ингаляционных, интраназальных, внутрисуставных, глазных, эпидуральных и парентеральных (внутривенных, внутримышечных) лекарственных форм, а особенности их применения зависят от терапевтических стратегий, определяемых с учетом характера нозологии клиницистами различных специальностей [3–6].
Обладая широким спектром терапевтических свойств, ГКС неизбежно воздействуют на каждую из систем организма, что определяет не менее внушительный перечень потенциальных побочных эффектов от их применения. Негативные последствия длительных курсов лечения препаратами ГКС в течение нескольких десятков лет являются предметом серьезных исследований и подробно описаны в медицинской литературе [1–3]. Вместе с тем в современной педиатрической практике значительно чаще применяются короткие курсы лечения ГКС при различных острых заболеваниях. Безопасность краткосрочной терапии ГКС часто представляется как врачами, так и пациентами (или их родителями), сопоставимой с таковой при длительном приеме этих препаратов. Стероидофобия довольно широко распространена и в медицинском сообществе, и в популяции в целом. В ряде случаев, напротив, имеет место мнение об абсолютной «безвредности» кратковременного применения ГКС.
В отечественной литературе отсутствуют публикации, касающиеся безопасности применения короткого курса ГКС в педиатрии.
Учитывая высокую востребованность препаратов ГКС в клинической практике и необходимость формирования у врачей адекватных представлений о потенциальных рисках этих лекарственных средств, целью данного обзора явился анализ опубликованных данных о безопасности коротких курсов лечения ГКС у детей с различной патологией.
В качестве источников данных использованы публикации из различных медицинских баз данных: PubMed, Cochrane Library, Medscape, e-library, а также монографии экспертов по теме обзора.
Характеристика препаратов ГКС и их потенциальные побочные эффекты
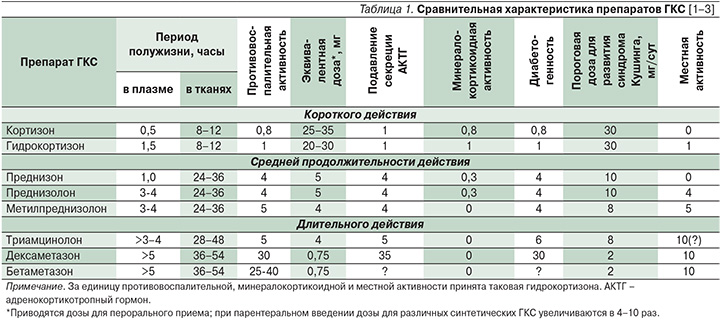
Группа лекарственных препаратов ГКС представлена как эндогенными гормонами коры надпочечников с преимущественно глюкокортикоидной функцией (кортизон и гидрокортизон), так и их синтетическими аналогами (преднизон, преднизолон, метилпреднизолон), включая галогенированные (фторированные) производные (триамцинолон, дексаметазон, бетаметазон) [1, 2]. В связи с существенным различием фармакокинетических и фармакодинамических свойств ГКС важной задачей для клинициста представляется выбор препарата с наименьшим риском развития побочных эффектов (табл. 1). Учитывая оптимальное соотношение эффективности и безопасности, препаратом выбора для длительного лечения является метилпреднизолон. На современном этапе он широко применятся при интенсивной терапии, аутоиммунных заболеваниях и в трансплантологии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных группах. В большинстве случаев вторым по эффективности ГКС остается преднизолон. При многих неотложных состояниях определенными достоинствами (особенности фармакокинетики, противовоспалительная активность) обладают фторированные соединения: дексаметазон и бетаметазон (табл. 1) [1, 2].
В зависимости от цели варианты терапевтического применения ГКС различаются, при этом лечение может быть как ургентным, так и плановым. Обычно ГКС назначают в качестве заместительной терапии при надпочечниковой недостаточности или с противовоспалительной и иммуносупрессивной целями [1–3]. В отличие от плановой терапии применение ГКС при ургентных состояниях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяют при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного) [1–3].
Тщательный выбор препарата, режима дозирования и вида терапии не позволяет полностью предотвратить развитие побочных эффектов при применении ГКС (табл. 2).
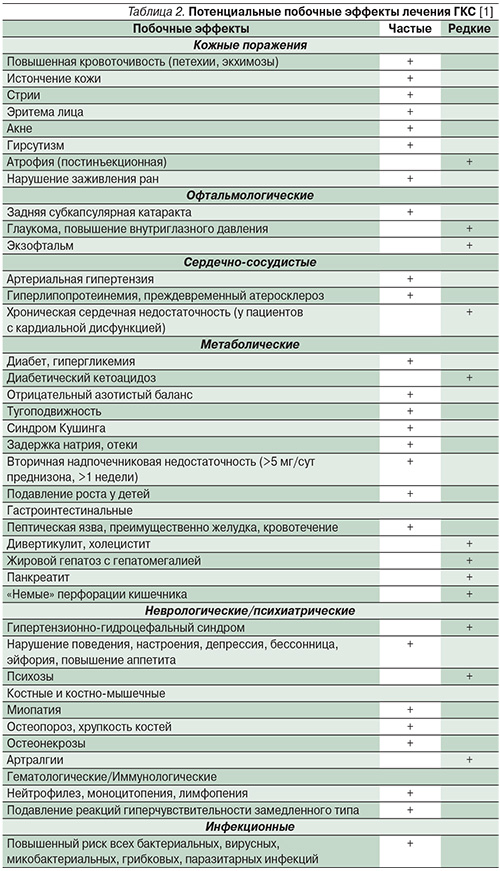
Развитие побочных эффектов ГКС может быть обусловлено следующими факторами [1–4]:
- длительная и высокодозная терапия ГКС приводит к подавлению гипоталамо-гипофизарно-надпочечниковой регуляции и при отмене сопряжена с угрозой развития острой надпочечниковой недостаточности;
- в связи с противовоспалительным и иммуносупрессивным действиями ГКС возможны атипичные инфекционные осложнения со склонностью к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Вместе с тем диспепсические явления на фоне лечения ГКС редко связаны с непосредственным поражением слизистой оболочки желудочно-кишечного тракта;
- возникновение метаболических и электролитных нарушений (синдром Кушинга, гипергликемия, остеопороз, повышение артериального давления) возможно за счет блока гормональной регуляции.
Терапевтические схемы применения ГКС
С учетом многообразия побочных эффектов ГКС их безопасность в клинической практике зависит от определения строгих показаний к их назначению, оценки отношения «ожидаемый эффект/предполагаемый риск», а также своевременной профилактики метаболических и электролитных нарушений.
Риск развития побочных эффектов ГКС определяется следующими факторами [1]:
- доза ГКС: <10 мг/сут преднизона – низкая доза; 10–20 мг/сут – средняя доза; >20 мг/сут – высокая доза;
- тип ГКС: длительного действия или короткого действия;
- продолжительность лечения: длительное лечение >3 месяцев.
В зависимости от терапевтической стратегии принято выделять несколько схем терапии ГКС [1–3]:
- короткие курсы лечения большими дозами с быстрой отменой;
- длительные курсы лечения малыми дозами с постепенной отменой;
- пульс-терапия: интенсивная терапия сверхвысокими или средними/высокими дозами;
- альтернирующий режим лечения.
Из-за широкого спектра потенциальных побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при применении минимальных доз. Самой эффективной считается внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной [1–3]. Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного применения умеренной/высокой дозы. Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект [1–4]. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (оптимально между 06.00 и 08.00); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 – днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Выбор терапевтической схемы обусловлен характером патологии. Короткие курсы ГКС обычно назначают для купирования тяжелых и острых воспалительных заболеваний, таких как аллергические реакции на лекарства, контактный дерматит, тяжелый атопический дерматит, тяжелая крапивница, обострения бронхиальной астмы, воспалительных заболеваний кишечника, ревматоидного артрита; различных гематологических болезней [6–8]. Короткие курсы ГКС также используют (очевидно, не всегда оправданно) как терапию отчаяния, или ex-uvantibus [7].
Лечение менее одного месяца считается краткосрочным. ГКС в течение нескольких дней или недель относительно безопасны. Лечение, продолжающееся более 3 месяцев, считается длительным и может приводить к различным побочным эффектам [4, 5]. В широкой практике короткий курс ГКС соответствует применению преднизолона взрослым человеком в стандартной дозе от 40 до 60 мг/сут на срок от нескольких дней до 3 недель. Общая кумулятивная доза в таких случаях не превышает 600 мг, чаще она даже бывает менее 400 мг. У детей при коротком курсе лечения обычно используются дозы, соответствующие расчету 1–2 мг/кг массы тела по преднизолону, при этом детям в возрасте 2–5 лет обычно назначают 20 мг/сут [9]. Максимальная доза преднизолона для старших детей не должна превышать 60 мг/сут [9].
Побочные эффекты коротких курсов лечения ГКС
Краткосрочное использование ГКС обычно рассматривается как безопасное. Вместе с тем минимальная доза системных ГКС и продолжительность их введения, необходимые для возникновения побочных эффектов, не определены [6, 7]. Даже кратковременное применение препаратов ГКС следует рассматривать как потенциальный риск развития побочных эффектов.
В 2008 г. R. Richards опубликовал первый систематический обзор исследований, проведенных в период с 1985 по 2006 г. и посвященных эффектам короткого курса пероральных ГКС [7]. Анализ показал, что кратковременный прием системных ГКС не сопровождается синдромом отмены, предпочтительным является однократный прием всей назначенной дозы ГКС с завтраком. Незначительные редкие побочные эффекты при этом включают бессонницу, перепады настроения, беспокойство, увеличение массы тела и диспепсические расстройства [7].
Влияние на психику. Влияние короткого курса лечения ГКС на психику пациентов в силу частоты этого эффекта при длительной терапии изучалось во многих исследованиях. Значительные изменения настроения и психотические реакции крайне редко отмечаются при кратковременном приеме ГКС [10–14]. Исследования показывают, что пациенты, получающие суточную дозу преднизолона 40 мг или выше,
имеют более высокий риск развития психических нарушений [10, 11]. Симптомы могут возникать в течение первых дней лечения, и психологическое здоровье пациента не является точным предиктором развития побочных эффектов. Пациенты, получающие низкие дозы ГКС, имеют небольшой риск развития тяжелых психических нарушений [10–14]. Возникновение побочных эффектов в этой сфере обычно предполагает отмену/снижение дозы ГКС и назначение фенотиазинов [10, 14].
Артериальная гипертензия. Прием коротких курсов ГКС обычно сопряжен с клинически незначимым повышением артериального давления. Пациенты с тяжелыми заболеваниями сердца и/или сердечной недостаточностью требуют тщательного мониторинга во избежание проблем с задержкой жидкости и соли. Возможное снижение уровня калия на фоне ГКС должно особенно тщательно контролироваться у лиц, принимающих дигоксин [15].
Повышение внутриглазного давления. Анализ спорадических отчетов о побочных эффектах позволил предположить, что пероральный прием ГКС может приводить к повышению внутриглазного давления и глаукоме, однако влияние системных ГКС на глазное давление оценивалось лишь в единичных исследованиях [16]. Имеются данные о побочных эффектах короткого курса лечения глазными каплями, содержащими ГКС [16]. Опубликованных сообщений о случаях глаукомы в результате короткого курса лечения преднизолоном до настоящего времени не было, тем не менее вследствие теоретической возможности ее возникновения пациенты с глаукомой в случае назначения им системных ГКС должны проинформировать об этом своего офтальмолога и при необходимости мониторировать уровень глазного давления [16–18].
Гипергликемия. Прием ГКС может сопровождаться повышением уровня глюкозы в крови, в связи с чем пациенты с сахарным диабетом должны контролировать уровень сахара в крови и регулировать дозировку инсулина по мере необходимости [19]. У пациентов, не страдающих сахарным диабетом, контроля гликемии на фоне короткого курса лечения системными ГКС обычно не требуется.
Пептические язвы. Пероральный прием ГКС может вызывать диспепсические явления, однако совместный прием препарата с пищей может сводить эти реакции к минимуму [20, 21]. Причинная роль короткого курса лечения системными ГКС в развитии пептических язв не доказана. Опубликованные единичные сообщения о таких случаях, вероятнее всего, были вызваны сопутствующим приемом нестероидных противовоспалительных средств [20].
Туберкулез. Пациенты, которые принимают ГКС в течение длительного времени, имеют повышенный риск первичного инфицирования или реактивации туберкулеза, а также заболевания первичными формами туберкулезной инфекции, что не отмечено при коротком курсе приема препаратов [22, 23].
Инфекционные заболевания. Более 20 лет назад A.E. Stuck и соавт. исследовали связь между терапией ГКС и последующим развитием инфекционных заболеваний путем мета-анализа данных контролируемых клинических испытаний. Не было выявлено повышенного риска инфекционных осложнений на фоне короткого курса лечения ГКС у пациентов, получавших кумулятивную дозу преднизолона менее 700 мг [23].
В последние годы растет число публикаций о возможности тяжелого и даже фатального течения инфекции Herpes zoster на фоне или непосредственно после короткого курса лечения ГКС. Описаны случаи присоединения вируса ветряной оспы с диссеминацией вируса, развитием осложнений и летальным исходом на фоне короткого курса высоких доз ГКС, у иммунокомпрометированных больных и у пациентов с обострением бронхиальной астмы [24–27].
Иммуносупрессивный эффект ГКС может наблюдаться после 14 дней терапии препаратами ГКС или после приема преднизолона в дозе 2 мг/кг/сут (или >20 мг/сут). Обычно менее продолжительные курсы лечения не связаны с подавлением иммунитета [6, 7]. Влияние на иммунитет нескольких повторных коротких курсов лечения ГКС в течение года, по-видимому, не имеет клинического значения, однако этот вопрос изучен недостаточно [8].
Асептический некроз. Длительный прием системных ГКС может быть ассоциирован с развитием асептического некроза [28–30]. Асептический некроз («аваскулярный остеонекроз») – тяжелое дегенеративно-дистрофическое заболевание суставов, которое обусловлено тяжелой ишемией и сопровождается процессом некроза суставных тканей. Применение ГКС – не единственная возможная, но частая причина этого заболевания. Описаны случаи развития аспетического некроза после лечения ГКС, когда кумулятивная (курсовая) доза по преднизолону не превышала 290 мг [29].
Остеопороз. Развитие остеопороза не связано с короткими курсами лечения ГКС, однако пациентам группы риска рекомендуется проводить профилактику, включающую прием препаратов кальция и холекальциферола [7, 30].
Влияние на плод. Исследования тератогенного влияния ГКС квалифицировали риск их развития как весьма возможный (категория риска D), т.е. при их применении в I триместре беременности аномалии плода или другие необратимые повреждения могут наблюдаться с повышенной частотой [31]. Прием курсов ГКС в более поздние сроки беременности не сопровождался серьезными последствиями для плода (категория риска С) [31]. Преднизон имеет наименьшее негативное влияние на плод по сравнению с другими ГКС. Это обусловлено особенностями фармакокинетики препарата: кровотока плода достигает минимальное количество препарата в активной форме, поскольку плацента богата ферментом 11-β-гидроксистероиддегидрогеназой, которая инактивирует преднизон [7, 31]. Фторированные ГКС, такие как дексаметазон и бетаметазон, незначительно трансформируются этим ферментом, их влияние на плод, таким образом, может быть более серьезным. Преднизон секретируется в грудное молоко в минимальных количествах, в связи с чем Американская академия педиатрии определила, что его прием совместим с грудным вскармливанием [32].
Анафилаксия. Имеются единичные сообщения о развитии анафилактической реакции, индуцированной приемом ГКС [33]. S.M. Erdmann и соавт. описали случай развития анафилаксии у 22-летней женщины с атопическим дерматитом, получавшей перорально преднизон. Последующее кожное тестирование пациентки показало гиперчувствительность немедленного типа к преднизолону, преднизону и бетаметазону и ее отсутствие к метилпреднизолону и дексаметазону [33].
Вакцинация и аллергенспецифическая иммунотерапия (АСИТ). Рекомендуется избегать введения живых вакцин детям на фоне лечения ГКС, поскольку иммуносупрессивное действие ГКС может увеличивать риск развития побочных эффектов [7]. Живые вакцины от полиомиелита или кори/краснухи/паротита не следует назначать пациентам, принимающим ≥20 мг преднизолона ежедневно [7]. При этом безопасно и целесообразно проводить другие обычные профилактические прививки, такие как ежегодная вакцинация против гриппа.
Если пациент получает АСИТ и ему при этом назначены системные ГКС, иммунный ответ на лечение будет нормальным, если доза преднизолона не превышает 20 мг/сут. Тем не менее в большинстве случаев следует отсрочить АСИТ до тех пор, пока курс лечения ГКС не будет завершен, поскольку большие дозы могут изменять результаты иммунизации [7, 33].
Длительное заживление ран. Анализ публикаций в области хирургии и дерматологии не выявил связи между короткими курсами ГКС и задержкой заживления ран [6, 7].
Систематический обзор побочных эффектов. В 2016 г. был опубликован мета-анализ исследований, изучавших побочные эффекты, возникшие при применении короткого курса ГКС в педиатрии [6]. В анализ были включены 3200 пациентов из 38 исследований, удовлетворявших критериям соответствия, из них 22 были рандомизированные контролируемые. Короткие курсы лечения ГКС назначались преимущественно при синдроме крупа (обструктивном ларингите), обструктивном бронхите, аллергическом рините, обострении бронхиальной астмы, нефротическом синдроме, острой почечной недостаточности, лихорадке Денге, судорожном синдроме, остром лейкозе, системной красной волчанке [34–39]. Большинство детей получали преднизолон или дексаметазон. Всего на фоне приема ГКС было зарегистрировано 850 побочных эффектов. Самыми частыми были рвота (5,4%), нарушения поведения (4,7%) и расстройства сна (4,3%) [11, 12, 21, 40, 41]. В числе прочих побочных эффектов на фоне короткого курса лечения ГКС отмечены тошнота (1,9%), повышение аппетита (1,7%), боли в животе (1,3%), отек и покраснение лица (1,1%), присоединение инфекции (0,9%), кашель (0,2%) [6]. В связи с развитием побочных эффектов прием препаратов 44 (1,4%) детьми был прекращен [6]. Мета-анализ показал, что наиболее тяжелым побочным эффектом приема системных ГКС было присоединение инфекционного заболевания, с которым в одном случае был связан смертельный исход [26, 27]. В одном из исследований у 144 (39%) детей из 369 было зарегистрировано повышение артериального давления, у 21 (28%) ребенка из 75 – увеличение массы тела, у 43 (81%) из 53 – подавление функции гипоталамо-гипофизарно-надпочечниковой системы, диагностированное на основании лабораторных исследований [42]. Всеми детьми нормальный уровень секреции эндогенного кортизола был достигнут в течение 10–12 дней после отмены ГКС. Исследователи отмечают, что риск возникновения рвоты был в 3,6 раза выше на фоне приема преднизолона по сравнению с дексаметазоном [43].
Безопасность ГКС при обострениях бронхиальной астмы. Обострение бронхиальной астмы – одна из самых частых причин назначения детям короткого курса ГКС. Как правило, ГКС при обострении астмы используются либо в виде 3–5-дневных курсов преднизолона 1–2 мг/кг/сут, либо преднизона в дозе 1 мг/кг/сут, либо в виде различных ингаляционных ГКС [44, 45]. Подавление функции надпочечников может быть продемонстрировано через два месяца непрерывного приема умеренной дозы (до 1 мг/кг/сут) преднизолона или преднизона. Этот побочный эффект может сохраняться в течение года. После 5-дневного курса лечения преднизолоном или преднизоном в дозе 1–2 мг/кг/сут подавления функции гипоталамо-гипофизарно-надпочечниковой системы не происходит [42]. Кроме того, существуют доказательства того, что несколько повторных коротких курсов также не вызывают эндокринной недостаточности коры надпочечников [42]. Однако здесь следует отметить, что эти результаты исследований были получены от взрослых, их экстраполяция на детский возраст вызывает сомнения.
Семидневный курс терапии системными ГКС обычно не вызывает значительного влияния на функцию коры надпочечников, в то время как двухнедельное лечение высокими дозами может приводить к ее подавлению на период до одного года [41]. В связи с этими фактами в настоящее время Национальные руководства по лечению обострения бронхиальной астмы рекомендуют прием препаратов ГКС перорально от 3 до 7 дней, хотя предыдущие клинические рекомендации (2008) предписывали их использование в течение 7–14 дней [43, 44]. Кроме того, нет никаких убедительных доказательств того, что другие пути введения безопаснее, чем пероральный [1–3, 6, 41].
Ингаляционные ГКС, используемые при бронхиальной астме, не вызывают негативных системных эффектов ни в случае краткосрочной, ни при длительной терапии, если используются низкие или умеренные дозы по беклометазона пропионату (менее 0,5 мг/сут) [3, 5]. Имеются сообщения о подавлении функции надпочечников при длительном применении ингаляционных ГКС в дозах, превышающих 0,75–1,5 мг/сут по беклометазона пропионату, при этом предполагается, что в случае применения флутиказона существует более высокий риск [46].
Заключение
История применения ГКС при различных острых и хронических болезнях насчитывает уже несколько десятков лет. Эти препараты обладают уникальными свойствами, к которым следует отнести прежде всего противовоспалительное и иммуносупрессивное действия. В силу универсальности эффектов ГКС спектр их побочных влияний также отличается своей широтой. Развитие побочных эффектов при применении ГКС напрямую связано с применением высоких доз и длительностью курсов терапии. Использование топических препаратов ГКС в последние годы существенно снизило частоту назначения системных ГКС и, следовательно, вероятность развития клинически значимых побочных эффектов.
Длительное использование ГКС (курсы более 2 месяцев) связано как с угнетением функции коры надпочечников, так и с иммуносупрессией. Исследования показывают, что лечение короткими курсами системных ГКС (перорально от 1 до 2 мг/кг/сут преднизолона или преднизона в течение 3–7 дней) не вызывает этих эффектов, даже если они используются несколько раз в течение одного года. Вместе с тем увеличение продолжительности курса лечения системными ГКС свыше 7 дней, по данным ряда исследований, способствует увеличению риска серьезных побочных эффектов.
Проведенный анализ литературы показал, что в целом короткие курсы лечения ГКС характеризуются удовлетворительным профилем безопасности. Наиболее распространенными побочными эффектами ГКС при их применении от 7 до 14 дней являются диспепсия (тошнота, рвота), нарушения поведения и сна. В большинстве случаев те же побочные эффекты становятся причиной отмены ГКС у детей. Наиболее опасным с точки зрения прогноза может стать применение системных ГКС в продромальном периоде ветряной оспы.
Возможные рекомендации по минимизации побочных эффектов системных ГКС сводятся к определению четких критериев к их назначению, по возможности сокращению периода их применения и употреблению минимально эффективных доз.
Тщательный контроль состояния пациентов в ходе лечения, своевременное выявление факторов риска развития побочных эффектов, а также строгое выполнение рекомендаций по рациональному назначению и применению этих препаратов способствуют повышению безопасности терапии ГКС и улучшению качества жизни больных.
Пациенты (или их родители), которым назначаются короткие курсы лечения ГКС, должны быть проинформированы обо всех существенных рисках развития побочных эффектов и вариантах альтернативного лечения.
Источник финансирования
Подготовка публикации осуществлена на личные средства авторов.


