Герпесвирусы (ГВ) широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции. Свыше 90% людей инфицированы одним или несколькими ГВ человека. Особое значение герпесвирусная инфекция (ГВИ) имеет во время беременности [1]. Установлено, что при ГВИ имеет место серьезный риск внутриутробного инфицирования и неблагоприятного исхода беременности: ее следствием являются до 30% спонтанных абортов на ранних и до 50% – на поздних сроках гестации [2].
В настоящее время известно 8 антигенных серотипов семейства Herpesviridae: вирусы простого герпеса 1-го и 2-го типов (ВПГ-1 и ВПГ-2); Herpesvirus varicellae – возбудитель ветряной оспы и опоясывающего герпеса; цитомегаловирус (ЦМВ); вирус Эпштейна–Барр (ВЭБ); ГВ 6– 8-го типов. Все ГВ способны к пожизненной персистенции в организме человека и обладают выраженными иммуносупрессорным и онкогенным эффектами.
В жизненном цикле ГВ выделяются две стадии: 1) литическая, характеризующаяся активной репликацией вирусной ДНК; 2) латентная, при которой вирус в организме сохраняется в виде субвирусных структур. Данные стадии в процессе жизнедеятельности ГВ неоднократно циклически сменяют друг друга, механизмы латенции и активации ГВ изучены недостаточно, однако известно, что вышеописанные переходы осуществляются под контролем иммунной системы. Важное значение в течении ГВИ принадлежит врожденному иммунитету [2]. Система врожденного иммунитета – первая линия защиты организма при первичном инфицировании ГВ, реактивации хронических и латентных форм ГВИ. Регуляция иммунного ответа (ИО) осуществляется путем выработки про- и противоспалительных цитокинов, первичное инфицирование ГВ и/или реактивация латентной и хронической ГВИ вызывают развитие ранних цитокиновых реакций, лежащих в основе естественного ИО [3]. К ранним цитокиновым реакциям относят синтез провоспалительных цитокинов, к числу которых относят интерлейкины (ИЛ)-1, -6 и -12, факторы некроза опухоли (ФНО)-α и -β, интерфероны (ИФН)-α, -β, -γ и др. Развитие ИО в полной мере подавляет размножение вирусов и препятствует их диссеминации, однако во время беременности за счет физиологической иммуносупрессии чувствительность к неэмбриональным антигенам снижается, что приводит к активации хронической вирусной инфекции. Первичное инфицирование ГВ либо активация длительно персистирующей латентной ГВИ в организме беременной женщины приводит к реализации ИО путем стимуляции Т-хелперов 1-го типа (Th1), в результате чего нарушается баланс между про- и противовоспалительными цитокинами, при этом возрастает риск прерывания беременности. При недостаточном ИО ГВ способны оказывать прямое эмбриотоксическое воздействие на плод [1, 3].
Изучение цитокинового статуса у беременных с различным течением ГВИ очень важно в практическом плане, будет способствовать пониманию патогенеза ГВИ в современных условиях, позволит оптимизировать методы диагностики и терапии беременных, инфицированных ГВ, а также способы прегравидарной подготовки.
Цель исследования: изучение цитокиновой регуляции иммунного ответа на локальном и системном уровнях у беременных женщин с различным течением ГВИ.
Материал и методы
Нами были обследованы 100 пациенток в I и II триместрах гестации в возрасте от 18 до 33 лет (средний возраст – 27±7,5 лет). Всем беременным с помощью твердофазного иммуноферментного анализа оценивали концентрации иммуноглобулинов G и M (IgG и IgМ) в сыворотке крови к ВПГ-1, ВПГ-2, ЦМВ и ВЭБ; путем полимеразной цепной реакции (ПЦР) определяли наличие вирусной ДНК в образцах периферической крови и соскобах эндоцервикса для оценки спектра урогенитальных инфекций. Путем твердофазного иммуноферментного анализа с использованием тест-систем ООО «Цитокин» исследовались уровни ИЛ-4, ИЛ-8, ИЛ-10, ИФН-γ, ФНО-α в плазме крови и цервикальной слизи, с использованием тест-систем ООО «Биохиммак» определяли концентрации ИЛ-17 и трансформирующего фактора роста β (TФР- β) в плазме крови.
Статистический анализ полученных результатов проведен с использованием программы Statistica 8.0.
Результаты и обсуждение
На основании анализа данных клинико-лабораторного обследования у 35 (35,0%) беременных выявлены диагностические маркеры активации ГВИ. При этом у 8 пациенток в сыворотке крови были обнаружены IgM к ЦМВ, у 5 – к ВЭБ, у 4 – к ВПГ-1 и ВПГ-2. При ПЦР-исследовании образцов крови ДНК ВЭБ обнаружена у 9 беременных, ДНК ЦМВ – у 7 и ДНК ВПГ-1 и ВПГ-2 – у 5 обследованных. При ПЦР-исследовании соскобов эпителиальных клеток цервикального канала наличие ЦМВ выявлено у 8 женщин, а ВПГ-1 и ВПГ-2 – у 4. В 30% случаев отмечены ассоциации маркеров активации ГВИ. Клинические проявления ГВИ в виде лабиального герпеса имели место у 3 пациенток, генитальный герпес был выявлен у 2 беременных, 10 женщин отмечали ОРВИ-подобные симптомы, у всех остальных наблюдалась бессимптомная форма ГВИ.
В I (основную) группу были включены 35 (35%) пациенток, у которых выявлены прямые (обнаружение вирусных антигенов) и косвенные (наличие IgM к ГВ) признаки вирусной репликации. Группу сравнения (II группа) составили 65 (65%) беременных с латентным течением инфекции, у которых по данным клинико-лабораторного обследования определялись специфические IgG к ГВ в низких диагностических титрах в отсутствие клинических и лабораторных признаков активации ГВИ.
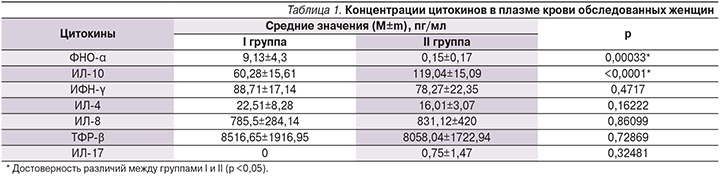
При изучении цитокинового статуса женщин исследуемых групп выявлено, что у беременных I группы был нарушен баланс между противовоспалительными и провоспалительными цитокинами на системном и местном уровнях в пользу последних (табл. 1, 2). При сравнении уровней цитокинов в плазме крови отмечено достоверное увеличение концентрации ФНО-α в I группе по сравнению со II (9,13±4,3 против 0,15±0,17 пг/мл; р<0,05). Концентрация ИЛ-10 в плазме крови также достоверно различалась, составив 60,28±15,61 пг/мл в I группе и 119,04±15,09 – во II (р<0,05).
Уровни ИФН-γ в плазме крови обследуемых не имели статистически достоверных различий, однако его концентрация в основной группе превышала таковую в группе сравнения. Отсутствие статистически значимых различий в уровне ИФН-γ при системном ИО у беременных исследуемых групп может быть следствием иммунодепрессивного воздействия ГВИ на систему ИФН, которое проявляется угнетением интерферонгенеза лейкоцитами с последующим снижением уровня сывороточного ИФН-γ [5]. При сравнении концентраций ИЛ-8, TФР-β и ИЛ-17 в плазме крови обследованных женщин также не обнаружено достоверных различий, хотя уровень TФР-β в I группе был выше, чем во II, что может быть результатом активации адаптационно-компенсаторных механизмов, направленных на подавление системной воспалительной реакции, а также развитие и поддержание иммунологической толерантности к аллоантигенам плода. Следует отметить, что концентрация ИЛ-17 в плазме крови женщин основной группы соответствовала нулевым значениям. ИЛ-17 выделен относительно недавно, в связи с чем остается мало изученным, известно, что он является провоспалительным цитокином, синтезируется Th17, которые образуются путем обратимой дифференцировки Th0, при этом установлено, что модуляция ИО Th1 и Th2 препятствует дифференцировке наивных Т-лимфоцитов в Th17. Антагонистами ИЛ-17 являются ИФН-γ и TФР-β, при этом высокая концентрация ИЛ-17 стимулирует синтез эндогенного ИФН [6]. С учетом этих данных отсутствие ИЛ-17 в плазме крови пациенток I группы может быть связано с тем, что индукция ИО осуществлялась через стимуляцию Th1 и Th2, а также объясняться коротким периодом существования ИЛ-17 или быть следствием изменений иммунной системы во время беременности.

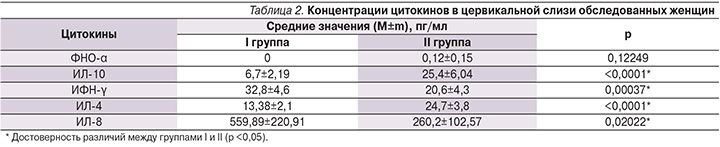
При изучении цитокиновой регуляции ИО на локальном уровне обнаружено резкое снижение уровней ИЛ-4 и ИЛ-10 в цервикальной слизи у беременных I группы по сравнению со II (ИЛ-4 – 13,38±2,06 против 24,79±3,81 пг/мл и ИЛ-10 – 60,28±15,61 против 119,04±15,09 пг/мл). Также обнаружено достоверное увеличение концентраций ИФН-γ и ИЛ-8 в цервикальной слизи среди беременных основной группы по сравнению с группой сравнения (табл. 2).
Нами был проведен корреляционный анализ уровней про- и противовоспалительных цитокинов в плазме крови и цервикальной слизи обследованных женщин. Выявлена прямая корреляционная связь средней силы (r=0,53) между уровнями ИЛ-10 в плазме крови и цервикальной слизи пациенток основной группы (рис. 1). В отношении других цитокинов корреляционной связи не выявлено. Отсутствие сильной корреляционной связи между уровнями цитокинов в плазме крови и секрете цервикального канала указывает на возможность автономной регуляции ИО на местном уровне. Реализация защитных механизмов слизистых оболочек гениталий способствует ограничению инфекционно-воспалительного процесса, препятствует диссеминации вирусных агентов и появлению циркулирующих иммунных комплексов, характерных для системного ИО.
Несмотря на высокую частоту выявления вирусных антигенов в системном кровотоке среди пациенток основной группы, изменения иммунной системы более выражены на локальном уровне, что свидетельствует о важной роли местного ИО в противоинфекционной защите во время беременности.
Было установлено, что в I группе имела место высокая частота неразвивающейся беременности – 8 случаев (22,8%), в то время как во II группе подобных исходов не отмечено (рис. 2).
Частота самопроизвольного аборта в обеих группах была примерно одинаковой, составив 11,4 и 10,0%. Девять (25,7%) женщин основной группы и 10 (15,3%) – группы сравнения были госпитализированы с диагнозом начавшегося выкидыша. Угроза прерывания беременности имела место у 8 (22,8%) пациенток I группы и у 10 (15,3%) – второй. Физиологическое течение беременности наблюдалось у 6 (17,1%) женщин основной группы и у 39 (60,0%) – группы сравнения.
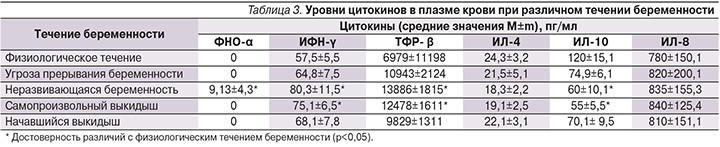
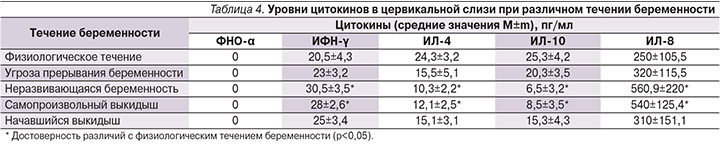
Нами был проведен статистический анализ локального и системного уровней цитокинов у женщин с различным течением беременности (табл. 3, 4). Обнаружено нарушение баланса противо- и провоспалительных цитокинов как на локальном так и на системном уровне у женщин с прервавшейся беременностью и угрозой ее прерывания. При этом следует отметить, что у женщин с прервавшейся беременностью цитокиновые реакции были более выражены на системном уровне. У них достоверно чаще определялось выраженное повышение концентрации провоспалительных цитокинов в плазме крови. У 75% пациенток с неразвивающейся беременностью концентрация ФНО-α составила 9,13±4,3 пг/мл, у остальных женщин уровень этого цитокина не достигал пороговой величины.
Высокие значения противовоспалительного цитокина TФР-β в плазме крови женщин с прервавшейся беременностью скорее всего служат результатом компенсаторной реакции, направленной на подавление системного воспаления (табл. 3). При изучении локального ИО выявлены нарушения цитокиновой регуляции, проявляющиеся в преобладании синтеза провоспалительных цитокинов над противовоспалительными. Максимальные концентрации провоспалительных цитокинов в цервикальном секрете на фоне минимальных значений противовоспалительных определялись у женщин с прервавшейся беременностью.
Исходя из полученных результатов, были сделаны следующие выводы. ГВИ потенцирует высокий риск гестационных осложнений и перинатальных потерь. При изучении цитокинового статуса беременных с активным и латентным течением ГВИ обнаружены существенные нарушения цитокиновой регуляции ИО. Активация латентных форм ГВИ во время беременности является триггерным фактором переключения иммунной стимуляции с Th2 на Th1, при этом реализация ИО осуществляется преимущественно на локальном уровне. Развитие системного ИО служит следствием срыва компенсаторно-приспособительных механизмов и представляет большую угрозу развития неразвивающейся беременности, синдрома перинатальных потерь, внутриутробной инфекции у плода. Причиной системной воспалительной реакции могут быть аутоиммунные заболевания, иммунодепрессия вследствие длительной персистенции ГВ и многие другие факторы. Поэтому изучение цитокинового статуса во время беременности, а также на этапах прегравидарной подготовки будет способствовать выявлению групп риска по гестационным осложнениям и позволит определить необходимость проведения иммунокорригирующей терапии. Назначение иммуномодулирующих препаратов во время беременности в большинстве случаев является единственным способом лечения вирусных инфекций вследствие невозможности проведения этиотропной терапии.
Заместительная терапия ИФН-содержащими препаратами беременных с ГВИ обоснованна, учитывая прямой противовирусный эффект ИФН альфа-2 и выраженный дефицит ИФН, формирующийся при длительной персистенции вирусов в организме, а также в период гестации.
На сегодняшний день на фармакологическом рынке представлен широкий ассортимент ИФН-содержащих препаратов, основным действующим веществом которых является человеческий рекомбинантный ИФН альфа-2. ИФН-содержащие препараты широко используются в акушерстве, позволяя снизить удельный вес невынашивания беременности и внутриутробного инфицирования плода, их применение к беременным осуществляется согласно методическим рекомендациям Минздрава РФ и Московского областного НИИ акушерства и гинекологии «Прогностические критерии и алгоритм интерферонкоррегирующей терапии при вирусных и бактериальных инфекциях у беременных и новорожденных» № 2000/99 от 25.06.2000.



