Впрактике врача-оториноларинголога бывают ситуации, когда стартовая эмпирическая антибактериальная терапия не приводит к быстрому эффекту. В этом случае, оценивая состояние пациента через 72 часа, врачу необходимо сменить антибиотик на более сильный, с широким спектром действия. При этом нередко смену осуществляют на антимикробные средства класса хинолонов – фторхинолоны. Препаратам этой группы присущи хорошие фармакокинетические свойства, высокая степень проникновения в ткани и клетки как человека, так и микроорганизма.
Фторхинолоны выгодно отличаются от других антибиотиков своими свойствами: ингибированием фермента ДНК-гиразы – фермента бактериальной клетки, с широким спектром антимикробного действия (грамотрицательные и грамположительные аэробные бактерии, микобактерии, Mycoplasma pneumonia, Chlamydia pneumoniae); высокой степенью бактериальной активности; возможностью создания в тканях и клетках человека концентраций препаратов, близких к сывороточным или их превышающих; хорошей переносимостью и небольшой частотой побочных эффектов. Кроме того, длительный период полувыведения определяет удобный режим дозирования – 1–2 раза в сутки. Так, препарат этой группы левофоксацин при приеме внутрь имеет большой объем распределения и достигает высоких концентраций в тканях, фагоцитах и жидкостях организма, в частности в тканях околоносовых пазух, а также в макрофагах [1].
В настоящее время синтезированы новые препараты группы фторхинолонов, проявляющие более высокую активность в отношении грамположительных бактерий, прежде всего пневмококков, что позволило выделить их в отдельную подгруппу – 2-го поколения, или новые фторхинолоны (см. таблицу). При этом левофлоксацин и моксифлоксацин выпускают в двух формах: в таблетках и для внутримышечного введения, что позволяет использовать их в виде ступенчатой терапии, что снижает стоимость лечения.
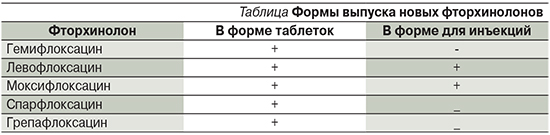
Препараты этой группы оказывают выраженное действие на грамотрицательные бактерии (Moraxella catarrhalis, Legionella spp.), Haemophilus influenzae (включая штаммы, продуцирующие β-лактамазы) [2].
Препараты группы новых фторхинолонов обладают более высокой природной активностью в отношении Streptococcus pneumoniae по сравнению с ранними фторхинолонами (например, левофлоксацин – 1 мг/л). В связи с этим их целесообразно назначать при внебольничных инфекциях дыхательных путей. При этом активность новых фторхинолонов не различается в отношении пенициллинчувствительных и пенициллинрезистентных штаммов пневмококка. В настоящее время установлено, что резистентность пневмококков к новым фторхинолонам минимальная (менее 1%). Высокая активность фторхинолонов 2-го поколения в отношении S. pneumoniae крайне важна, т.к. острые и хронические заболевания в настоящее время достаточно часто вызывает этот патоген.
Препараты группы новых фторхинолонов превосходят ранние по активности в отношении других стрептококков (группы А и С) и стафилококков (Staphylococcus aureus). В отношении Pseudomonas aeruginosa самым активным фторхинолоном остается ципрофлоксацин, из новых фторхинолонов реальной антипсевдомонадной активностью обладает лишь левофлоксацин.
Установлено, что совместный прием ряда препаратов (антациды, сукральфат, соли висмута, кальция, препараты железа) уменьшает биодоступность фторхинолонов при их пероральном приеме, что может приводить к снижению эффективности последних. Следует иметь в виду, что прием пищи замедляет всасывание фторхинолонов.
Имеются ограничения применения препаратов этой группы для беременных и кормящих женщин, детей и подростков в возрасте до 16–18 лет. Это выявлено в эксперименте о повреждающем действии фторхинолонов в отношении хрящевой ткани неполовозрелых животных. Однако эти данные не подтверждены в клинике. Но такое противопоказание оправданно, т.к. строго ограничивает широкое нерациональное использование фторхинолонов в педиатрии до получения надежных доказательств их безопасности для пациентов этой категории.
Анализ базы данных фармаконадзора Италии показал, что относительный риск развития побочных эффектов при применении левофлоксацина не отличался от такового у пероральных антибиотиков других классов [3].
К наиболее частым побочным эффектам при применении фторхинолонов относятся симптомы со стороны желудочно-кишечного тракта (тошнота, рвота, диарея, боли в животе, изменения вкуса), однако в большинстве случаев они носят умеренный характер и не требуют отмены лечения.
В клинических исследованиях левофлоксацина наиболее распространенным побочным эффектом была диарея, встречавшаяся с частотой 4–6%, что существенно ниже, чем при применении пероральных пенициллинов или цефалоспоринов [4]. Побочные эффекты со стороны центральной нервной системы – ЦНС (головная боль, головокружение и нарушения сна), являющиеся классовым эффектом фторхинолонов, при лечении левофлоксацином (1%) наблюдались реже.
Все фторхинолоны примерно с одинаковой частотой вызывают реакции со стороны ЦНС (5–8%), минимальная нейротоксичность отмечена у офлоксацина и левофлоксацина. Реакции со стороны ЦНС характерны для всех препаратов этого класса. Однако их наблюдают нечасто, они, как правило, проявляются головной болью, головокружением, сонливостью, расстройством сна (эти симптомы обычно возникают в 1-й день лечения и исчезают сразу после отмены). Развитие судорог описано значительно реже. Они возникают в основном на 3–4-й день лечения у больных, имеющих предрасполагающие факторы (эпилепсию, мозговую травму, гипоксию, пожилой возраст, сочетанное применение с теофиллином или нестероидными противовоспалительными средствами) и саморазрешаются при отмене препарата [5].
Частота возникновения кожных сыпей при применении левофлоксацина составляет 0,2% [6]. Частота анафилактоидных реакций при лечении левофлоксацином сопоставима с таковой у большинства препаратов этой группы – 1,8–23,0 на 1 млн дней лечения [6]. Частота развития анафилаксии на 1 млн суточных доз составила для левофлоксацина 0,6 [7].
В клинических исследованиях левофлоксацина гепатобилиарные поражения встречались в 0,1–1,0% случаев [6]. Частота гепатита, некроза печени и печеночной недостаточности при лечении левофлоксацином, согласно данным Фармаконадзора Франции, составляет <1 случая на 5 млн назначений [8].
Диффузная мышечная боль, часто в сочетании с мышечной слабостью, обычно возникает на первой неделе лечения фторхинолонами и в большинстве случаев саморазрешается в течение 1–4 недель после их отмены.
Отмечено, что под действием солнечных лучей или УФ (ультрафиолетовые)-излучения фторхинолоны вызывают фототоксические реакции. Поэтому пациентов следует предупреждать о том, что стоит воздерживаться от применения физиотерапевтических процедур, связанных с УФ-воздействием, и от инсоляций.
Во время приема препаратов этой группы в клинике на электрокардиограмме (ЭКГ) отмечено удлинение интервала QT на фоне спарфлоксацина, грепафлоксацина, левофлоксацина в пределах 10 мс, что не имеет существенного клинического значения и не повышает риска опасных желудочковых нарушений ритма [9]. Однако следует с осторожностью подходить к назначению фторхинолонов пациентам с желудочковыми аритмиями в анамнезе или синдромом удлиненного QT-интервала >500 мс, а также избегать сочетанного применения фторхинолонов с другими лекарственными средствами, вызывающими удлинение интервала QT [10, 11].
В эпидемиологических исследованиях частота развития тендинопатий при применении фторхинолонов составила 1:2000 [10], по данным FDA (Food and Drug Administration), 1,3–5,6 на 10 тыс. пациенто-лет [12]. Пятилетнее наблюдение за детьми (n=6000), принимавшими антибиотики, показало, что частота поражений сухожилий или суставов при применении левофлоксацина, составляет <1% и сопоставима с таковой при применении азитромицина [13].
В последние годы наблюдают увеличение резистентности микроорганизмов к фторхинолонам. Отмечается повышение частоты выделения устойчивых к фторхинолонам штаммов P. aeruginosa, Staphylococcus spp., а также снижение чувствительности у некоторых других микроорганизмов.
В связи c этим важным считается строгое обоснование назначения фторхинолонов в адекватной дозе в каждом конкретном случае.
Все ныне предложенные стандарты лечения воспалительных заболеваний верхних дыхательных путей направлены на уничтожение планктонных форм патогенов, в то время как результаты изучения биопленок поставят перед врачами задачи по разработке новых стандартов, особенно при лечении хронических заболеваний. Стандартные лабораторные исследования не дают информации о действии антибиотиков на бактерии биопленок. В связи с этим необходима разработка соответствующих методов молекулярной диагностики, а также стратегий лечения, воздействующих на механизмы формирования и функционирования бактериальных сообществ в виде биопленок.
Известно, что концентрации антибиотиков, требуемых для достижения бактерицидного эффекта для микроорганизмов, структурированных в биопленку, в некоторых случаях в зависимости от природы антибиотика могут быть в 10–100 раз выше, чем для планктонных форм данного патогена [14]. В то же время установлено, что фторхинолоны легко диффундируют через биопленку и весьма эффективно останавливают ее рост [15].
В группу антибиотиков, хорошо проникающих в биопленки различных бактерий, вошли макролиды, фторхинолоны, рифампицин, хлорамфеникол и др. Следует отметить, что антибиотики, эффективные в отношении планктонных бактерий, часто не оказывают необходимого антимикробного действия в отношении бактериальных биопленок. Это связано с тем, что выбор антимикробных препаратов основывают на бактериальной культуре, полученной из планктонных бактерий. Между тем планктонные бактерии отличаются по поведению и фенотипическим формам от бактерий в биопленке. Неэффективность антимикробной терапии в лечении инфекции, обусловленной формированием биопленок, могут быть объяснены также тем, что микроорганизмы в биопленке растут медленнее, поэтому они более устойчивы к антимикробным препаратам, которые действуют на активно размножающиеся бактерии; протеины, связывающие антимикробные препараты, плохо экспрессируются у бактерий в биопленке; бактерии в биопленке активируют многие гены, которые изменяют клеточную оболочку, молекулярные мишени и чувствительность к антимикробным препаратам (внутренняя резистентность); бактерии в биопленке могут выживать в присутствии антимикробных препаратов в концентрации в 1000–1500 раз выше необходимой для эрадикации планктонных клеток того же вида бактерий (клетки-персистеры) [16].
Препараты группы фторхинолонов способны эрадицировать инфекцию, обусловленную формированием биопленок, при условии создания концентрации, превышающей минимально ингибирующую (МИК) в 32–64 раза [17].
Сама анатомия ЛОР-органов благоприятна для развития биопленки, и почти в 60% случаев инфекций верхних дыхательных путей отмечают ее присутствие [18].
В настоящее время в оториноларингологии все шире используют импланты при пластике околоносовых пазух, лица, носа; реконструктивных операциях на среднем ухе и при введении кохлеарных имплантов. Нередко в результате таких оперативных вмешательств развиваются имплант-ассоциированные инфекции. По некоторым данным, наличие импланта увеличивает риск воспаления в 100 раз и более, так что даже минимальная контаминация может приводить к развитию абсцесса [19, 20]. К наиболее распространенным возбудителям имплант- и катетер-ассоциированных инфекций относят возбудителей оппортунистических заболеваний, таких как стафилококки и стрептококки, Escherichia coli и P. aeruginosa [21].
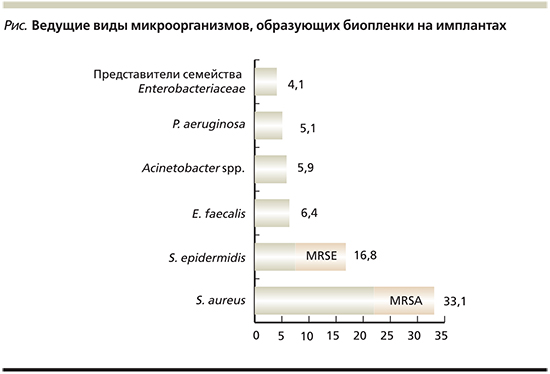
Анализ литературных данных позволил выявить микроорганизмы, которые чаще всего образуют биопленки на имплантах. Это может служить причиной развития хронического воспаления и приводить к необходимости удаления зараженного устройства, включая кохлеарные импланты. Почти все виды являются представителями нормальной микрофлоры организма человека. Так, ведущие позиции занимают два вида стафилококков: S. aureus и Staphylococcus epidermidis – 49,9%, в т.ч. и метициллинрезистентные штаммы (MRSE – Methicillin-resistant Staphylococcus aureus), далее следуют Enterococcus faecalis – 6,4%, представители неферментирующих грамотрицательных бактерий (Acinetobacter spp. и P. aeruginosa) – 11%, и представители семейства энтеробактерий (Enterobacter cloacae, Klebsiella pneumoniae, E. coli) – 4,1% (см. рисунок).
Именно в биопленке намного в большей степени, чем в планктонной культуре, развита межклеточная сигнализация (кворум сенсинг), что позволяет микроорганизмам эффективно координировать скорость размножения и вирулентность. Имеется также система неклеточных структур (каналов для воды и питательных веществ) [22, 23].
Лечение хронических инфекций в настоящее время уже не может основываться на планктонной концепции микробиологии. Представление о биопленках изменяет подходы к диагностике и лечению инфекционных поражений в самых различных областях медицины.
Левофлоксацин обладает отличными фармакокинетическими свойствами, абсолютной (100%) биодоступностью при приеме внутрь, достаточно длительным периодом полувыведения (6–8 часов), обеспечивающим высокие концентрации препарата в крови, превышающие МПК90 (минимальная подавляющая концентрация антибиотика для 90% исследованных штаммов) для многих микроорганизмов, включая основные возбудители инфекций дыхательных путей.
О хорошей переносимости левофлоксацина свидетельствуют и результаты фармакоэпидемиологического исследования в США, в котором оценивалась частота обращений амбулаторных пациентов за медицинской помощью по поводу побочных эффектов фторхинолонов [24].
Риск развития серьезных побочных эффектов при применении левофлоксацина в целом ниже, чем при применении других фторхинолонов, и может быть значительно снижен путем рационального применения препарата, подразумевающего учет факторов риска развития определенных побочных эффектов у конкретного пациента. Рациональное применение левофлоксацина, как и других препаратов фторхинолонов, также позволит снизить темпы нарастания антибиотикорезистентности к ним, что в настоящее время вызывает беспокойство со стороны медицинской общественности.
В частности, на это направлено недавно выпущенное предостережение FDA о необходимости ограничения применения фторхинолонов при острых синуситах.
Особые преимущества левофлоксацин имеет при дисфункции естественных соустьев околоносовых пазух, а также при верификации бактериальной микст-инфекции. Имеется положительный опыт при лечении пациентов с различными формах бактериального синусита, включая хроническую форму. Доказано, что использование левофлоксацина в этом случае эффективно и безопасно [25].
Установлено, что число назначений в мире левофлоксацина продолжает расти [26]. Основанием для роста потребления левофлоксацина служит его более благоприятное соотношение польза/риск по сравнению со многими другими препаратами фторхинолонов, о чем свидетельствуют результаты не только клинических, но и широко проводимых в настоящее время фармакоэпидемиологических исследований.


