Диффузный токсический зоб (ДТЗ), или болезнь Грейвса, – это аутоиммунное заболевание щитовидной железы (ЩЖ), развивающееся вследствие выработки антител к рецептору тиреотропного гормона (ТТГ) и клинически проявляющееся синдромом тиреотоксикоза в сочетании с экстратиреоидной патологией (эндокринная офтальмопатия, претибиальная микседема, акропатия) [1, 2].
В типичных случаях диагностика ДТЗ не вызывает затруднений и основывается на результатах клинических данных и гормонального обследования, включающего определение уровня ТТГ в крови высокочувствительным методом, а также свободного тироксина (Т4 свободный) и трийодтиронина (Т3 свободный) [3]. Аутоиммунный генез заболевания и прогноз определяются по уровню антител к ТТГ (а/т к ТТГ), которые выявляются у 85% пациентов с ДТЗ [4, 5]. Механизм образования тиреостимулирующих антител окончательно не прояснен, хотя отмечается наличие генетической предрасположенности к возникновению ДТЗ [6, 7].
Несмотря на кажущуюся простоту ведения пациентов с ДТЗ, сложности возникают на этапе лечения и связаны они прежде всего с выбором тактики ведения больного. Цели лечения ДТЗ: купирование клинических симптомов тиреотоксикоза, а также стойкая нормализация уровня ТТГ и тиреоидных гормонов [8]. На данный момент в медицинской практике существует несколько видов лечения ДТЗ: медикаментозный (консервативный) – путем подбора тиреостатических препаратов; хирургический (радикальный) – тотальная тиреоидэктомия и радиойодотерапия – РТ [9, 10].
Медикаментозное лечение может применяться для достижения эутиреоза как основной длительный курс терапии, так и с целью подготовки пациента к последующей тиреоидэктомии. В качестве тиреостатиков используются препараты группы тионамидов: тиамазол (метизол, метимазол, тирозол, мерказолил) и действующее вещество пропицил (пропилтиоурацил). Механизм их действия заключается в нарушении синтеза тиреоидных гормонов путем блокирования фермента пероксидазы, участвующего в йодировании тиронина с образованием в ЩЖ трийодтиронина и тироксина, а также в угнетении образования тиреоидстимулирующих аутоантител, периферической конверсии тироксина в трийодтиронин [11].
Консервативное лечение может планироваться только при впервые выявленном (не рецидивном) диффузном (без крупных узловых образований) зобе небольшого размера (до 40 мл) в отсутствие тяжелых осложнений тиреотоксикоза [12]. Основным условием начала тиреостатической терапии является достаточная приверженность пациента терапии. Продолжительность непрерывного лечения составляет 1–1,5 года. Накопленные на сегодняшний день данные свидетельствуют об отсутствии эффективности тиреостатической терапии, превышающей 18 месяцев [13, 14].
Длительность лечения тиреостатиками также ограничена возможностью развития тяжелого, хоть и редкого, осложнения – агранулоцитоза. Медикаментозное лечение ДТЗ требует многократных посещений эндокринолога и сопутствующих гормональных обследований для адекватного подбора дозы антитиреоидного препарата и схемы терапии, что приводит к временным и материальным затратам со стороны пациента. При правильном консервативном подходе стойкая ремиссия отмечается всего лишь у 15–30% пациентов [15].
Целью оперативного метода лечения является удаление органа-мишени – ЩЖ (предельно субтотальная резекция ЩЖ), исключающее последующие рецидивы заболевания и достижение послеоперационного гипотиреоза, купируемое дальнейшим назначением левотироксина [16, 17].
Абсолютные показания к хирургическому лечению:
- пациенты с подозрительными или злокачественными узлами ЩЖ, подтвержденными тонкоигольной аспирационной биопсией (ТАБ);
- пациенты с непереносимостью или побочными эффектами на прием тиреостатиков;
- пациенты с компрессионными симптомами (масс-эффект), зобом большого размера (объем ЩЖ>40 мл);
- пациенты с «радиофобией»;
- пациенты с тяжелой эндокринной офтальмопатией;
- пациентки, планирующие беременность в течение ближайшего года.
Тиреоидэктомия требует длительной предоперационной подготовки путем назначения тиреостатиков для достижения эутиреоидного состояния. Целью такой тактики является предупреждение тяжелого интраоперационного осложнения – тиреотоксического криза, угрожающего жизни пациента. Следует также отметить, что хирургическое лечение, являясь инвазивным, может приводить к развитию таких осложнений, как парез голосовых связок при повреждении возвратного нерва, вторичный послеоперационный гипопаратиреоз, воспалительные нагноительные заболевания послеоперационной раны, косметический дефект. Однако у большинства пациентов осиплость вызвана послеоперационным отеком и легко проходит при назначении дегидратационной и противовоспалительной терапии [18].
Третий вид лечения ДТЗ – РТ, использующаяся вот уже более 60 лет и представляющая собой простой, неинвазивный и эффективный метод лечения [19]. Несмотря на низкую распространенность РТ в качестве лечения ДТЗ в России, в США, к примеру, терапия радиоактивным йодом считается лечением первого выбора для пациентов с тиреотоксикозом. Цель РТ: достичь у больного стойкого гипотиреоза [20].
Главные достоинства терапии ДТЗ с помощью радиоактивного йода:
- риск рецидива минимален (стойкий эффект отмечается у 90–99% пациентов);
- острые осложнения встречаются крайне редко;
- не требуется предварительной подготовки тиреостатиками до состояния эутиреоза, т.е. может назначаться на фоне тиреотоксикоза;
- при необходимости курс лечения можно повторить;
- не существует ограничений для пожилых пациентов и в отношении наличия любого сопутствующего заболевания;
- предпочтительна при послеоперационном рецидиве тиреотоксикоза;
Абсолютным показанием к выбору данного вида лечения ДТЗ является возраст пациентов старше 40–45 лет.
В настоящее время имеется тенденция к пересмотру этого показания и снятию указанных ограничений, т.к. большинство больных ДТЗ – это женщины в возрасте от 20 до 40 лет [21]. Рецидив заболевания после курса медикаментозной терапии и/или тиреоидэктомии, а также развитие побочных эффектов на фоне приема тиреостатиков также служат показанием к проведению РТ.
К минусам данного вида лечения относится рекомендация женщинам воздерживаться от наступления беременности в ближайшие 9–12 месяцев после окончания РТ [22].
Клинический случай
Пациентка К. 79 лет обратилась к эндокринологу с жалобами на тахикардию, эпизодические подъемы артериального давления (АД) до максимальных цифр 160/100 мм рт.ст., чувство тревоги, повышенную утомляемость.
Из анамнеза жизни: состоит на диспансерном учете с диагнозом «хроническая обструкционная болезнь легких, эмфизематозная форма, пневмосклероз. Ретенционные кисты печени. Хронический панкреатит, стадия ремиссии. Хронический холецистит, стадия ремиссии. Язвенная болезнь 12-перстной кишки с ее деформацией, стадия ремиссии. Гипертоническая болезнь. Сенильный остеопороз». Наследственность не отягощена. Аллергии на пищевые продукты и лекарственные препараты ранее не отмечалось. Вредные привычки отрицает.
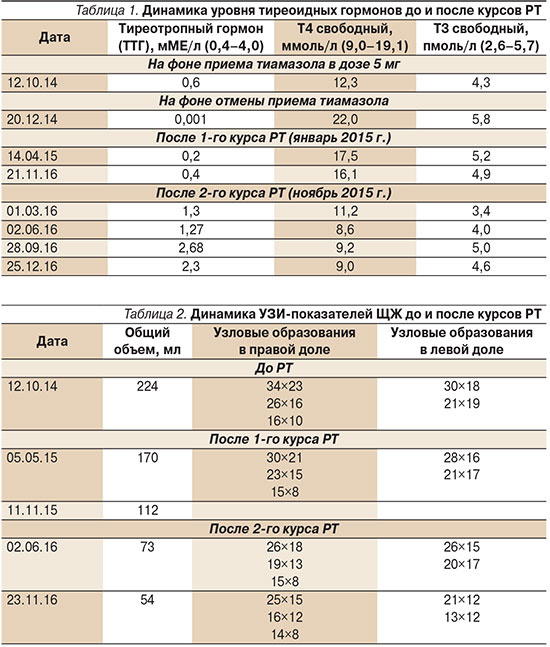
Из анамнеза заболевания: наблюдалась у эндокринолога по месту жительства с диагнозом ДТЗ с 73 лет. При первичной диагностике заболевания была назначена терапия тиреостатиками (тиамазол в начальной дозе 30 мг с последующей титрацией до 5 мг), которую пациентка получала регулярно под контролем уровня тиреоидных гормонов. Через месяц после окончания 1,5-годового курса медикаментозной терапии у пациентки диагностировали рецидив заболевания с повышением уровня свободных фракций тироксина (Т4св) и трийодтиронина (Т3св). В связи с огромными размерами зоба (общий объем ЩЖ – 230 мл) и распространением его роста в заднее средостение с масс-эффектом на близлежащие органы, а также пожилым возрастом пациентке и сопутствующими заболеваниями от хирургического вмешательства пришлось воздержаться. Несмотря на отсутствие эффекта от проводимой тиреостатической терапии, лечение было вновь возобновлено в поддерживающей дозе (5 мг тиамазола ежедневно) под контролем уровня гормонов ЩЖ. При повторных неоднократных попытках отменить прием тиреостатика отмечен резкий подъем уровней Т4св и Т3св в крови. Динамика уровня тиреоидных гормонов пациентки представлена в табл. 1.
Таким образом, общая продолжительность тиреостатической терапии больной составила более 5 лет, побочных эффектов за период наблюдения отмечено не было. РТ пациентке не предлагалась в связи с отсутствием данного вида лечения в регионе проживания.
При осмотре: рост – 152 см, масса тела – 58 кг, индекс массы тела – 25,2 кг/м2. Объективно: кожные покровы чистые, бледные, суховатые на ощупь. Подкожная жировая клетчатка развита недостаточно, распределена равномерно. Периферические лимфатические узлы не увеличены, при пальпации безболезненны, не спаяны между собой и окружающими тканями. ЩЖ увеличена, II степени (по ВОЗ), умеренно-эластичной консистенции, клинически эутиреоз.
В легких выслушивается ослабленное везикулярное дыхание, хрипов нет. Частота дыхательных движений – 18 в минуту. Над всей поверхностью легких ясный легочный звук с коробочным оттенком.
Тоны сердца аритмичны, приглушены, частые экстрасистолы. АД – 150/90 мм рт.ст., частота сердечных сокращений – 78 в минуту. Живот правильной формы, не увеличен, участвует в акте дыхания, при пальпации отмечается незначительная болезненность в области эпигастрия. Печень не выступает из-под края реберной дуги. Селезенка не увеличена. Стул – склонность к запорам (1 раз в 2 дня). Симптом поколачивания поясничной области отрицательный с обеих сторон. Диурез адекватный.
Результаты дополнительных исследований на момент осмотра от 12.10.14: в биохимическом анализе крови: кальций общий – 2,24 ммоль/л (норма – 2,20–2,55), кальций ионизированный – 1,25 ммоль/л (норма – 1,18–1,32).
В гормональном профиле на фоне приема 5 мг тиамазола ежедневно: Т4св – 12,3 ммоль/л (норма – 9,0–19,1), Т3св – 4,3 пмоль/л (норма – 2,6–5,7), ТТГ – 0,6 мМЕ/л, 25-ОН витамин Д – 18,6 нг/мл (норма – 30–80). Общий анализ крови и другие показатели гормонального анализа без патологических отклонений.
Ультразвуковое исследование (УЗИ) ЩЖ: правая доля: общий объем – 224 мл.
На фоне паренхимы обеих долей определяются гипо- и изоэхогенные образования овальной формы с четкими контурами: справа 34×23 мм, 26×16, 16×10 мм; слева 30×18, 21×18 мм. Заключение: Многоузловой гигантский зоб с медиастинальным распространением.
При очередной попытке отмены антитиреоидной терапии у больной вновь развились симптомы тиреотоксикоза, подтвержденные результатами исследования тиреоидных гормонов (от 20.12.14): ТТГ – 0,001 мМЕ/л (норма 0,4–4,0), Т3св – 5,8 пмоль/л (2,6–5,7), Т4св – 22,0 ммоль/л (9,0–19,1). В связи с неоднократными рецидивами ДТЗ на фоне длительной тиреостатической терапии и наличием противопоказаний к тиреоидэктомии больной была предложена РТ.
В отделении радиохирургического лечения открытыми радионуклидами в Обнинске больная прошла 2 курса РТ (1-й курс – в январе 2015 г., 2-й – в ноябре 2015 г.) в дозе перорально 25 мКи в закрытом режиме в течение 3 суток. На фоне проведенных курсов РТ отмечена положительная динамика в виде достижения стойкого эутиреоза и уменьшения размеров ЩЖ (табл. 1, 2).
Результаты гормонального профиля через 3 месяца после окончания 1-го курса РТ (14.04.15) указывали на субклиническую форму гипертиреоза: ТТГ – 0,2 мМЕ/л (норма – 0,4–4,0), Т3св – 5,2 пмоль/л (2,6–5,7), Т4св – 17,5 ммоль/л (9,0–19,1).
Отмечена положительная динамика по данным УЗИ ЩЖ: общий объем ЩЖ уменьшился с 224 до 170 мл, уменьшились и размеры узловых образований.
Результаты компьютерно-томографического исследования органов средостения от 01.03.16 (после 1-го курса РТ): верхнее средостение неравномерно расширено, больше справа за счет наличия элементов медиастинального зоба. Обе доли железы неравномерно увеличены в размерах, больше правая, и неравномерно пролоббируют в верхнее и заднее средостение, распространяясь в основном пара- и ретротрахеально. Примерно общий размер ЩЖ – 61×71×80 мм.
Структура железы неоднородна, с наличием множества гиподенсивных узлов и кальцинатов. ЩЖ неравномерно дислоцирует кпереди и частично компримирует трахею и пищевод (преимущественно), а также частично гортань. Заключение: медиастенальный зоб, масс-эффект.
При очередном осмотре пациентки через 6 месяцев после окончания 2-го курса РТ объективных данных за гипер- или гипотиреоз получено не было. Уровни тиреоидных гормонов от 02.06.16 составили: ТТГ – 1,27 мМЕ/л (0,4–4,0), Т3св – 4,0 пмоль/л (2,6–5,7), Т4св – 8,6 ммоль/л (9,0–19,1).
УЗИ щитовидной железы от 02.06.16: правая доля – 34х66х41 мм; левая доля – 28×57×38 мм; общий объем – 73 мл. На фоне паренхимы обеих долей определяются гипо- и изоэхогенные образования овальной формы с четкими контурами: справа – 26×18; 19×13; 15×8 мм; слева – 26×15; 20×17 мм.
При последующей консультации больной (через 10 месяцев после окончания 2-го курса РТ) получены следующие результаты анализов: в биохимическом анализе крови от 28.09.16: кальций ионизированный – 1,29 ммоль/л (1,18–1,32), кальций общий – 2,29 ммоль/л (2,20–2,55), глюкоза – 5,18 ммоль/л (4,6–6,1). В гормональном профиле: ТТГ – 2,68 мМЕ/л (0,4–4,0), Т3св – 5,0 пмоль/л (2,6–5,7), Т4св – 9,2 ммоль/л (9,0–19,1), 25-ОН витамин D – 20,90 нг/мл (30–80). Выше указанные анализы подтверждают достижение стойкого эутиреоидного состояния у больной на фоне проведенных двух курсов РТ.
Пациентка остается под постоянным наблюдением эндокринолога с контролем уровня тиреоидных гормонов и показателей УЗИ ЩЖ (табл. 1, 2).
Обсуждение
В представленном нами клиническом случае факторами, определившими первичный выбор тактики ведения пациентки с ДТ, стали ее пожилой возраст и наличие противопоказаний к проведению тиреоидэктомии. РТ как вид лечения заболевания не рассматривалась в связи с отсутствием ее на территории проживания больной. Таким образом, предпочтение эндокринолога было отдано в пользу медикаментозной терапии.
Надо отметить, что консервативное лечение ДТЗ – весьма непростая задача, и это связано с постоянной необходимостью титрации дозы антитиреоидного препарата с максимально супрессивной до минимально поддерживающей. При этом целью такой терапии является достижение стойкого эутиреоза путем применения одного тиреостатика либо схемы с добавлением к лечению малых доз левотироксина (схема «блокируй и замещай») [21]. Многие врачи предпочитают добавлять левотироксин только при развитии медикаментозного гипотиреоза, первым признаком которого является изолированное повышение уровня ТТГ. Доза левотироксина не должна быть слишком большой во избежание обострения тиреотоксикоза.
Несмотря на регулярность лечения и системность динамического гормонального контроля, добиться ремиссии заболевания методом консервативного ведения нашей пациентке не удалось. Терапевтическая тактика, к сожалению, нередко приводит к рецидивам тиреотоксикоза. Риск рецидива особенно высок у лиц с большими размерами зоба, эндокринной офтальмопатией, при наличии рецидивов заболевания в анамнезе, при высоких уровнях Т4 и тиреоглобулина, а также при значительном увеличении уровня Т3 [21]. Кроме того, неблагоприятным прогностическим признаком в отношении эффективности консервативного лечения является высокий уровень тиреоидстимулирующих антител [7]. В связи с высокой частотой рецидивов заболевания при антитиреоидной терапии нередко возникает необходимость в хирургическом лечении [1, 21].
По данным анамнеза, у представленной нами больной ДТЗ из-за развития рецидивов и наличия противопоказаний к тиреоидэктомии терапия тиреостатиками многократно возобновлялась. Ограничения для повторных курсов антитиреоидной терапии и большей ее продолжительности (более 18–24 месяцев непрерывно) – это, во-первых, отсутствие данных о лучшей эффективности, во-вторых, возможность развития побочных эффектов, среди которых наиболее часто отмечаются лейко- и тромбоцитопения, токсический гепатит, реже – лимфоаденопатия, полиневропатия, аллергические кожные реакции, артриты и артралгии [23]. Тактика дальнейшего ведения пациента определяется степенью выраженности осложнений.
При очередной консультации было принято решение рекомендовать больной РТ, целью которой является не только достижение гипотиреоза как исхода лечения, но и значимое уменьшение размеров ЩЖ. В нашем случае это имело немаловажное значение, т.к. гигантские размеры ЩЖ оказывали масс-эффект на близлежащие органы и ткани. Ряд авторов считают, что применение РТ при зобе большого размера неоправданно, т.к. в этом случае требуется значительная доза радиоактивного йода для достижения гипотиреоза [24, 25]. По стоимости и частоте осложнений этот метод я во многом превосходит хирургическое лечение. При болезни Грейвса надлежащая активность I131 должна быть назначена однократно (обычно 10–15 мКи) [14, 26]. В отсутствие положительного эффекта от однократного применения назначается повторный курс РТ.
Касаемо нашей пациентки, на фоне первого курса РТ удалось добиться лишь субклинической формы гипертиреоза и уменьшения размеров ЩЖ на 50%. Исходя из этого, больной был рекомендован второй курс РТ, результаты которого превзошли наши ожидания. Показатели тиреоидного профиля свидетельствовали о развитии стойкого эутиреоза, а данные УЗИ указывали на уменьшение объема ЩЖ на 75% от исходного. Таким образом, пациенткой была достигнута ремиссия заболевания через 8 лет от постановки диагноза путем применения двух курсов РТ.
Заключение
Существующие на сегодняшний день методы лечения ДТЗ не лишены недостатков и поэтому при выборе тактики ведения пациента с тиреотоксикозом во главе угла должен стоять принцип индивидуальности. Необходимо выделять определенную группу пациентов с ДТЗ, для которых этот метод лечения является предпочтительным по сравнению с другими. Несмотря на отсутствие широкой распространенности применения РТ ДТЗ в России из-за территориальной труднодоступности, данный вид лечения имеет ряд преимуществ перед консервативным и хирургическим.


