Вакцины для предотвращения пневмококковой инфекции (ПИ) используются в мире уже более 30 лет. Однако до недавнего времени среди инфекций, контролируемых методами иммунопрофилактики, ПИ привлекала недостаточное внимание врачей, прежде всего из-за недооценки ее патогенного значения. Пневмококки, как и многие другие «нормальные» составляющие микрофлоры дыхательных путей и ротовой полости, служат одновременно высоковирулентными патогенами, которые сдерживаются иммунологическими и иными защитными механизмами. Отличие состоит в том, что пневмококки во много раз чаще, чем, например, зеленящий стрептококк, стафилококк или анаэробы, «ускользают» от действия этих механизмов, вызывая тяжелые заболевания, особенно у людей, имеющих какие-либо дефекты в защитных механизмах организма [1]. В группу риска по развитию тяжелой инвазивной ПИ относятся и лица с туберкулезом. Еще в начале ХХ в. было отмечено усугубляющее действие ПИ на течение туберкулеза. Современные исследования также подтверждают неблагоприятное влияние ПИ на развитие заболевания. Туберкулез может предрасполагать к развитию другой бактериальной инфекции или ПИ может активировать латентный туберкулез легких. Особенно отчетливо это показывают наблюдения в странах Африки с высоким бременем туберкулеза. Хорошо известно, что у африканских детей, которые умирают от туберкулеза, часто отмечается сопутствующая бактериальная пневмония [2–4]. По результатам проведенного двойного плацебо-контролируемого исследования 9-валентной конъюгированной пневмококковой вакцины в Южноафриканском регионе была выявлена значимая роль Streptococcus pneumoniae в госпитализации детей с острой внебольничной пневмонией, ассоциированной с культурально-подтвержденным туберкулезом. Полученные данные свидетельствуют о том, что у детей младшего возраста, больных туберкулезом, ПИ может быть одной из основных причин поступления в больницу с диагнозом «острая пневмония» [5]. Молекулярная основа этого взаимодействия неизвестна, но вполне возможно, что предполагаемый механизм восприимчивости после респираторной вирусной инфекции, связанный с интерфероном γ-ответом и его подавлением активности альвеолярных макрофагов, может также играть роль в восприимчивости к пневмококковой инфекции после инфицирования микобактериями туберкулеза (МБТ). Помимо усугубляющего действия пневмококка на туберкулезную инфекцию (ТИ) использование фторхинолонов для лечения туберкулеза с множественной лекарственной устойчивостью у детей привела к появлению инвазивных пневмококковых заболеваний, вызванных левофлоксацин-нечувствительными штаммами, вызывающими пневмонию и нозокомиальное распространение [6].
Согласно позиции Всемирной организации здравоохранения (ВОЗ), вакцинация – единственный способ существенно повлиять на заболеваемость, смертность от ПИ и снижение уровня антибиотикорезистентности. ВОЗ и ЮНИСЕФ (UNICEF – United Nations Children’s Fund), имея подтверждение безопасности и эффективности пневмококковых конъюгированных вакцин, считают необходимым включить эти вакцины для детей во все национальные программы иммунизации. США начали первыми в мире проводить массовую вакцинацию против ПИ с 2000 г., а с 2001 г. она стала доступной в странах Евросоюза. Мировая практика показывает высокую эффективность массовой вакцинации. Например, в США у детей младше двух лет на 57,6% снизился уровень госпитализации по причине пневмококковой пневмонии, на 70% уменьшилась заболеваемость тяжелыми инвазивными инфекциями (сепсисом, менингитами, осложненными пневмониями). В Норвегии отмечена 74%-ная эффективность вакцины в отношении инвазивных инфекций у детей в возрасте 0–5 лет. В Израиле вакцинация против пневмококка позволила добиться снижения заболеваемости тяжелыми отитами на 70% [1, 7].
В России вакцинация детей против ПИ была включена в Национальный календарь профилактических прививок для всех детей первого года жизни в 2014 г., до этого вакцинация против ПИ регламентировалась только в группах риска. Вместе с тем на практике оказывается, что процент охвата иммунизацией в группах риска, в т.ч. среди лиц с туберкулезом, очень низкий. Проблема иммунизации детей с ТИ связана не только с боязнью прививок родителей, но и с тем, что у педиатров имеется чувство неуверенности: достигнет ли вакцинация должной эффективности и не принесет ли ущерба здоровью детей, не вызовет ли осложнений или рецидива основного заболевания?
Современные научные исследования по иммунизации больных туберкулезом немногочисленны. По документам ВОЗ, туберкулез как отдельное противопоказание к проведению прививок не фигурирует. В отечественных методических указаниях проведение прививок при хронических заболеваниях откладывается до наступления ремиссии – полной или максимально достижимой, в т.ч. на фоне лечения. Поддерживающее лечение хронического заболевания антибиотиками и т.д. не должно служить поводом для отвода от прививок [8, 9]. Поэтому, если рассматривать туберкулез как хронический процесс, применение специфической противотуберкулезной терапии не может являться противопоказанием к вакцинации.
В большинстве случаев проведенные ранее исследования относятся к изучению вопросов влияния вакцинации у детей с латентной ТИ. В развитых зарубежных странах исследования по вакцинации больных туберкулезом неактуальны, т.к. ситуация по туберкулезу достаточно благополучная, в странах же, где туберкулез широко распространен, вопрос о возможности вакцинации детей с туберкулезом, как правило, отдельно не рассматривают. Опыт Расширенной программы иммунизации показал, что вакцинация детей с тяжелыми расстройствами питания (квашиоркор, маразм), анемией, хроническими инфекциями, в т.ч. с туберкулезом, оказалась эффективной и не сопровождалась повышенным риском осложнений. В последние годы в России проводится иммунизация детей с латентной ТИ против гриппа, ПИ. Так, на базе НИИ фтизиопульмонологии Первого МГМУ им. И.М. Сеченова оценивалась целесообразность и эффективность вакцинации против ПИ детей, инфицированных МБТ. Число зарегистрированных в течение года после вакцинации случаев острых респираторных инфекций (ОРИ), включая бронхиты и пневмонии, в группе привитых оказалось в 7 раз ниже по сравнению с контрольной группой непривитых и в 13,9 раза – у привитых полисахаридной 23-валентной пневмококковой вакциной (ППВ23) в комбинации с вакциной против гриппа. В настоящее время введение ППВ23 (в комбинации с противогриппозной вакциной) рекомендовано НИИ фтизиопульмонологии Первого МГМУ им. И.М. Сеченова для инфицированных МБТ детей, часто болеющих неспецифическими инфекционно-воспалительными заболеваниями верхних и нижних отделов респираторного тракта. Показано, что комбинация противотуберкулезных и вакцинных препаратов «значительно повышает эффективность профилактики туберкулеза и уменьшает число детей, болеющих неспецифическими инфекционно-воспалительными заболеваниями в период проведения профилактических мероприятий» [10]. Однако в доступной литературе не разработаны критерии вакцинации детей с локальными проявлениями туберкулеза как живыми, так и неживыми вакцинами, в т.ч. против ПИ. Все это определило цель нашего исследования, включившее проведение клинико-иммунологических исследований, оценку клеточного, гуморального ответов и эффективность иммунного ответа после введения пневмококко-вой полисахаридной вакцины (ППВ23) у детей с различными проявлениями ТИ.
Материал и методы
Проведена иммунизация против ПИ препаратом ППВ23 35 детей в возрасте от 3 до 14 лет, отнесенных к категории часто и длительно болеющих ОРИ, находившихся на обследовании в амбулаторно-поликлиническом отделении и отделении терапии туберкулеза легких у детей ФГБУ СПбНИИФ Минздрава России. Перед иммунизацией всем детям был выполнен стандартный комплекс фтизиатрического обследования, дополненный лабораторными (серологические реакции, проба с аллергеном туберкулезным рекомбинантным) и рентгенологическими (мультиспиральная компьютерная томография) методами обследования. Полученные результаты позволили разделить детей на 2 группы: 1-я (n=24) – дети, инфицированные МБТ с различной степенью специфической сенсибилизации, 2-я группа (n=11) – дети с туберкулезом органов дыхания. Детям 1-й группы прививки проводили как на фоне превентивной химиотерапии, так и без специфического лечения (в зависимости от назначений фтизиатра).
При вакцинации детей с туберкулезом (2-я группа) прививки проводили при следующих условиях: основной курс терапии проведен в течение 4 и более месяцев (фаза продолжения терапии); положительная клинико-лабораторная (уменьшение проявлений интоксикационного синдрома, снижение активности туберкулеза, определяемое по динамике биопроб – проба Манту с 2 ТЕ, Диаскинтест) и рентгенологическая динамика специфического процесса. До прививки, на 14-й, 30 и 45-й дни после нее определяли субпопуляцию лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD20+, CD25+, CD95+) в реакции микролимфоцитотоксичности, функциональную активность Т-клеток в реакции бласттрансформации лимфоцитов (РБТЛ) с фитогемагглютинином, спонтанную РБТЛ, общий пул ЦИК (циркулирующих иммунных комплексов) по Digeon, уровень цитокинов: интерлейкина-1Р (ИЛ-1Р), ИЛ-4, ИЛ-6, интерферона γ (ИФН-γ), фактора некроза опухоли α, в сыворотке крови методом иммуноферментного анализа (ИФА); содержание иммуноглобулинов (Ig) классов А, М, G – турбодиметрическим методом, Ig Е – методом твердофазного ИФА. Статистическая обработка полученных результатов проводилась с применением пакета программ Statistica 6,0 (StafSoft, США). Для проверки гипотезы о различии групп использованы непараметрические методы: Mann–Whitney U-test и Wilcoxon matched pair test. Статистически достоверными различия считались при р<0,05.
Результаты и обсуждение
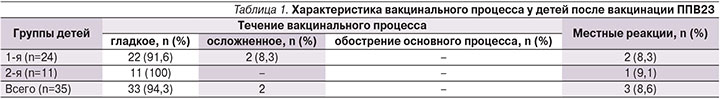
В поствакцинальном периоде общие реакции наблюдались у 3 (8,6%) из всех 35 привитых детей. В 1-й группе общая реакция в виде повышения температуры до 38°С в течение 2 суток после вакцинации наблюдалась у 2 (8,3%) из 24 пациентов. Во 2-й группе у 1 (9,1%) ребенка из 11 детей была отмечена сильная вакцинальная реакция (повышение температуры до 39,5°С) в первые сутки после иммунизации. Местные нормальные вакцинальные реакции (покраснение, уплотнение в месте введения не более 5 см) были отмечены у 3 (8,6%) детей из всех 35 привитых детей, у 2 (8,3%) – из 1-й группы, у 1 (9,1%) ребенка из 2-й группы. Частота развития общих и местных реакций достоверно не различалась в группах и не превышала значений, указанных в инструкции к препарату (1–10%). Гладкое течение вакцинального процесса наблюдалось у 94,3% (33/35) привитых. Наслоение интеркуррентных инфекций диагностировано у 2 (8,3%) детей из 1-й группы. Оба ребенка оказались в тесном семейном контакте по ОРИ (клинически грипп) и заболели на 3-й и 7-й дни после иммунизации. Во 2-й группе все дети имели неосложненное течение поствакцинального периода (табл. 1).
Все дети после вакцинации наблюдались у фтизиатра, им проводили основные методы обследования (клиническое состояние, туберкулиновые кожные пробы, рентгенологический контроль, специфические серологические реакции). Наблюдение в динамике не выявило неблагоприятного течения ТИ ни у одного из детей.
Для оценки клинико-эпидемиологической эффективности полисахаридной пневмококковой вакцины анализировались анамнестические данные: число эпизодов (ОРИ), острых средних отитов и внебольничных пневмоний как наиболее распространенных в детской популяции форм ПИ за предыдущий год и через год после вакцинации.
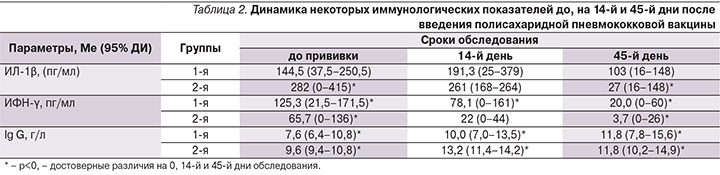
Выявлено, что после иммунизации иммунизации число случаев ОРИ, в т.ч. отитов и внебольничных пневмоний любой этиологии, сократилось в обеих группах: в 1-й – в 2,1, во 2-й – в 2,5 раза. Проанализированы результаты комплексного иммунологического обследования, которое показало, что после иммунизации полисахаридной пневмококковой вакциной статистически значимых изменений в субпопуляциях лимфоцитов не наблюдалось ни в одной из групп. В обеих группах отмечено статистически значимое увеличение уровня Ig G к 14–45-му дню вакцинации (р=0,03). Исследование уровня цитокинов в поствакцинальном периоде выявило снижение уровня ИФН-γ и ИЛ-1 в обеих группах (табл. 2). Аналогичная динамика указанных цитокинов характерна для процесса антителообразования при вакцинации, когда на 2–3-й неделе после прививки происходит снижение продукции цитокинов клеточного и повышение уровня цитокинов гуморального звена.
Заключение
Представленные данные подтверждают безопасность и эффективность введения вакцины ППВ23 детям с различными проявлениями ТИ при условии ее благоприятного течения. Частота развития общих и местных реакций достоверно не различалась в группах и не превышала значений, указанных в инструкции к полисахаридной пневмококковой вакцине (1–10%). Гладкое течение поствакцинального периода наблюдалось у 94,3% привитых лиц. Не отмечено негативного влияния на течение ТИ. Наслоение интеркуррентных инфекций (ОРИ) диагностировано только у 2 (8,3%) детей 1-й группы. Клиническая эффективность вакцинации подтверждена снижением частоты ОРИ в 1-й группе в 2,1, во 2-й – в 2,5 раза. Динамика иммунологических показателей не подтверждает иммуносупрессивного или неблагоприятного действия вакцин. Вакцинация против ПИ эффективна в снижении частоты ОРИ у детей, инфицированных как МБТ, так и с туберкулезом органов дыхания.


